FDA批准肌萎缩侧索硬化(ALS)复方药物Relyvrio,5年来首个新药
时间:2022-10-13 15:52:22 热度:37.1℃ 作者:网络
肌萎缩侧索硬化症(ALS)是一种进行性神经退行性疾病,影响大脑和脊髓中的神经细胞,也被称为“渐冻人症”。这种疾病的患者大脑和脊柱的运动神经元会不断死亡,导致患者的肌肉无力和瘫痪,从无法行走到无法说话、吞咽、呼吸。ALS患者在确诊后平均寿命只有四年。目前尚不清楚该病的确切发病机制。
美国FDA宣布,批准Relyvrio(苯丁酸钠和牛磺酸二醇口服固定剂量配方,又名AMX0035)上市,用于治疗肌萎缩侧索硬化(ALS)。
事实上,2020 年,两个 ALS 组织向 FDA 提交了超过 50,000 个签名,要求FDA批准 AMX0035。同时,在美国已有大量患者通过自制方式(苯丁酸钠和牛磺酸二醇),在实现类似的功效。
一、Relyvrio作用机制
Relyvrio是两种药物苯丁酸钠(sodium phenylbutrate)和牛磺酸二醇(taurursodiol)的复方制剂。它们可以改善细胞内线粒体和内质网的健康状态,从而延缓神经细胞的死亡。临床前试验表明,这两种药物联用的协同效应,能够将神经细胞因为氧化应激而产生的死亡减少90%。FDA曾授予Relyvrio孤儿药资格和优先审评资格。此次获批是基于一项入组了137例ALS患者的2期临床试验获得的积极数据。试验达到其主要疗效终点,即根据修订的ALS功能评定量表测量,在6个月随机化阶段结束时,接受Relyvrio治疗的ALS患者运动功能下降显著减缓。
此外,对所有随机化受试者长达3年的随访显示,在试验开始时就接受Relyvrio治疗的患者,与最初接受安慰剂治疗,在开放标签阶段转为Relyvrio治疗的患者相比,死亡风险降低了44%(HR 0.56;95% CI,0.34-0.92)。并且始终接受Relyvrio治疗组中位生存期比最初接受安慰剂治疗的患者组延长了6.5个月(25.0个月 VS. 18.5个月)。
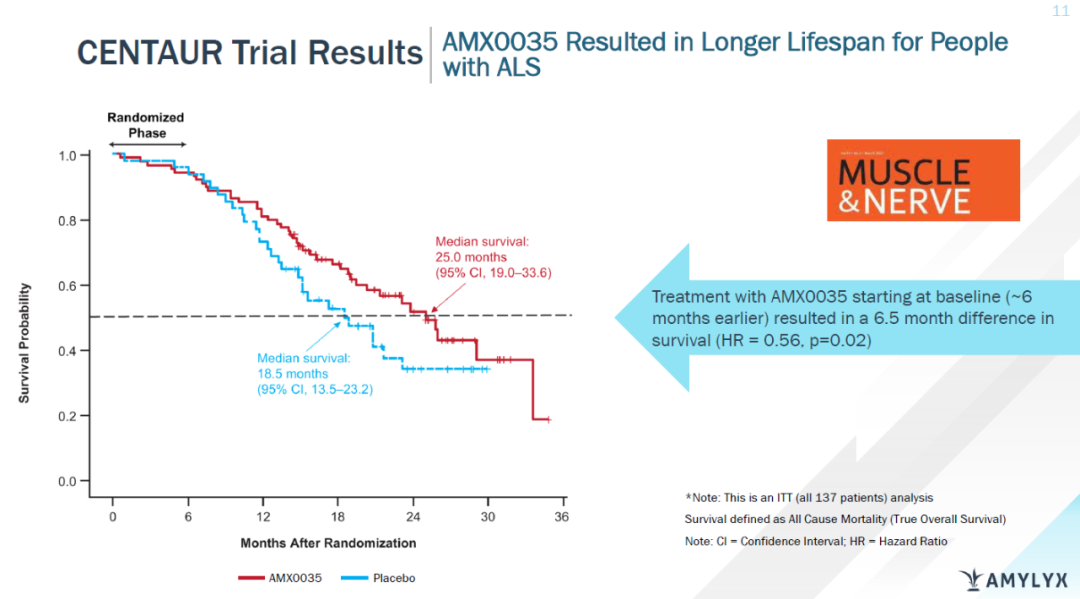 Relyvrio延长ALS患者生存期(图片来源:Amylyx公司官网)
Relyvrio延长ALS患者生存期(图片来源:Amylyx公司官网)
安全性上,总体而言,在24周内,Relyvrio和安慰剂组之间报告的不良事件和停药率基本相似,但是Relyvrio组胃肠道事件的发生率更高。
二、FDA批准Relyvrio一波三折,仍然有争议
这款疗法的获批过程可谓一波三折。今年3月,FDA咨询委员会以6:4的投票结果通过,但是,也提示这款药和的临床数据尚不支持这款疗法的有效性。此后,Amylyx公司递交了对临床试验数据的进一步分析以及来自其它临床试验的支持数据。在今年9月召开的第二次FDA咨询委员会上,委员会成员以7:2的投票结果,支持这一疗法获得FDA批准。今天,FDA最终批准了这一药物上市。
“Amylyx的目标是让每个符合资格使用Relyvrio的病患能够以最快、最有效率的方式使用药物,因为我们知道ALS患者和他们的家人没有时间再等待,”Amylyx的共同首席执行官Joshua Cohen与Justin Klee先生说道,“我们的团队已经准备好帮助ALS患者取得这项重要的新治疗选择。”
不过,这项批准也引起了一些专家的担忧,即针对严重疾病的治疗是否受到足够的审查。
“这项批准为 ALS 提供了另一种重要的治疗选择,这是一种目前无法治愈的危及生命的疾病,”FDA 神经科学办公室主任 Billy Dunn 在一份声明中说。
该机构表示,Relyvrio 是五年来第一个获批用于 ALS 的新疗法,其疗效已在一项为期 24 周的研究中得到证实,其中 137 名患者被随机分配接受 Relyvrio 或安慰剂治疗。 与接受安慰剂的患者相比,接受该药物治疗的患者在进行行走、说话和切食物等基本活动方面的下降速度要慢 25%。
此外,FDA 表示,一项长期分析显示,最初接受 Relyvrio 的患者与服用安慰剂的患者相比,寿命更长。 生产这种药物的马萨诸塞州剑桥生物技术公司 Amylyx 表示,生存获益的中位数约为 10 个月。
三、患者、支持者和专家意义促使FDA批准
患者、支持者和 ALS 专家对他们所谓的具有里程碑意义的批准表示欢迎,称该药物代表了在对抗这种疾病方面取得进展所需的那种适度进步。美国约有 30,000 人患有 ALS,每年诊断出 6,000 例新病例。另外两种药物——包括 2017 年进入美国市场的 Radicava——被批准用于治疗这种疾病,但疗效极为有限。
然而,一些药物政策专家表示,该药物有效的证据不足。一项包含 600 名患者的试验要到 2023 年底或 2024 年初才能完成。
“有一些证据支持该产品的功效,但我认为它没有达到 FDA 通常要求的标准,”约翰霍普金斯大学彭博公共卫生学院的内科医生和流行病学家 G. Caleb Alexander 说。在审查该药物的 FDA 咨询委员会任职。 “对于缺乏有效治疗的毁灭性疾病产品”,“如果有的话,FDA 应该降低多少标准?”
2019 年,奥巴马白宫工作人员布赖恩·瓦拉赫 (Brian Wallach) 和他的妻子在瓦拉赫被确诊后成立了一个名为 I AM ALS 的小组。 该组织将 Amylyx 药物投放市场作为优先事项。
这两个团体敦促 FDA 在清除 ALS 药物方面更快、更灵活,称患者将接受安全风险增加的治疗,以换取哪怕是很小的利益——这一观点已纳入该机构 2019 年对制药行业开发 ALS 疗法的指导 .
事实上,美国的一些 ALS 患者已经在服用药物的主要成分,由于苯丁酸钠已经获得批准,医生可能会为 ALS 患者开出标签外的处方。 营养补充剂牛磺二醇,也称为 TUDCA,可以在线购买。因此,已有很多患者将两种药物联合应用,以达到AMX0035相似的作用。
参考资料:
https://www.fda.gov/news-events/press-announcements/fda-approves-new-treatment-option-patients-als
https://www.biopharmadive.com/news/amylyx-fda-approval-als-drug-relyvrio/632592/


