Mol Psychiatry:抑郁症研究必看【综述】:从突触角度总结抑郁症的六大分子机制
时间:2022-10-22 12:00:06 热度:37.1℃ 作者:网络
重度抑郁症(MDD) 是一种分子病因学尚不清楚的精神疾病。不同分子水平上的研究表明,抑郁症的发病机制涉及多种高度复杂、相互关联的代谢通路,主要包括单胺、HPA轴、神经营养因子和神经发生、兴奋性和抑制性神经传递、线粒体功能障碍、表观遗传学、炎症、阿片系统、髓鞘化和肠-脑轴等。

2022年10月6日德国马克斯·普朗克精神病学研究所Theo Rein在Mol Psychiatry期刊上发表的文章全面总结了抑郁症的六大发病机制假说,阐明信号通路和分子系统在抑郁中如何相互作用,以及每个通路或系统与突触传递的关系。
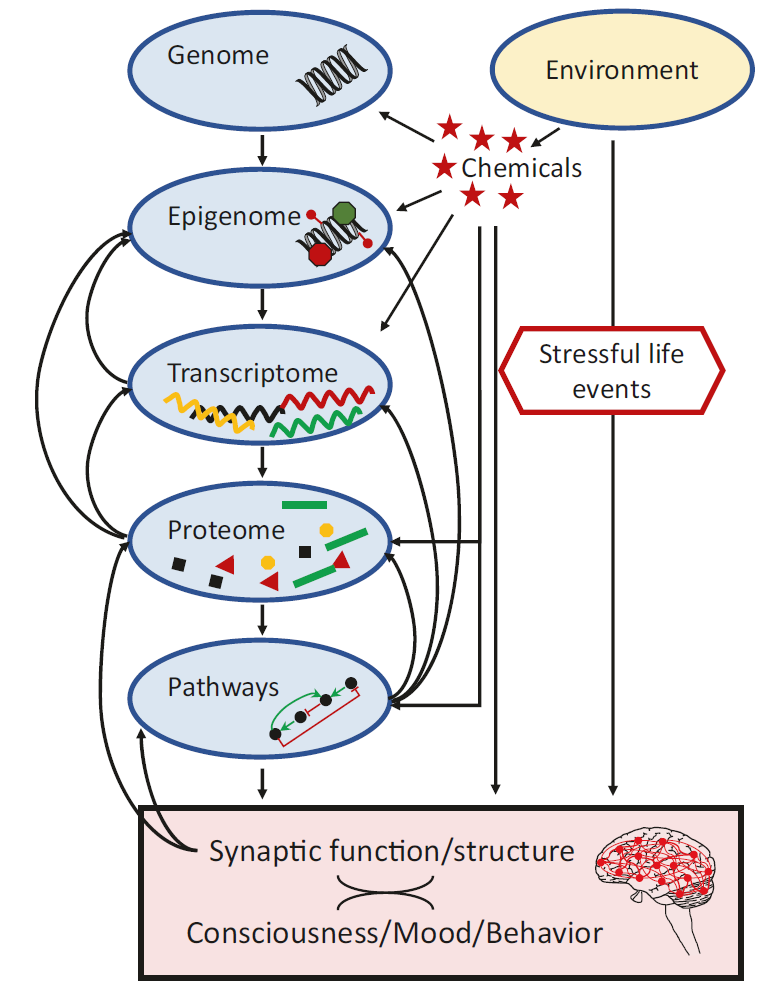
图1:抑郁症的分子机制
1
单胺假说
最初支持“抑郁症的单胺假说”的证据是,单胺氧化酶抑制剂和三环抗抑郁药可以通过增强5-羟色胺和去甲肾上腺素的活性来改善抑郁症状。虽然后来有许多研究支持这一假说,但其缺陷是:抗抑郁药物的临床起效时间通常需要数周,而药物几乎可以瞬间提高单胺水平。
此外,大约三分之一的抑郁症患者对仅通过抑制单胺重吸收而起作用的抗抑郁药没有反应,而且限制5-羟色胺前体色氨酸的可用性并不会在所有患者中诱发抑郁发作。因此,单胺缺乏假说在抑郁患者中可能并不普遍,这表明了其他途径和神经递质与抑郁相关。
抑郁症与大脑、脑脊液和外周组织的其他神经递质紊乱相关,包括GABA和谷氨酸能系统。抑郁患者特定脑区的谷氨酸水平降低。因此,新开发的抗抑郁药治疗侧重于通过靶向AMPA受体或2型代谢型谷氨酸受体来逆转谷氨酸和GABA缺陷。这也导致了快速抗抑郁药(如氯胺酮)的发现。
在基础研究和临床研究中,氯胺酮可快速增加谷氨酸信号,产生快速、持续的抗抑郁作用。氯胺酮通过阻断NMDA受体从而阻断GABA能神经元中的兴奋性谷氨酸信号,从而增加了前额叶皮层的总体活性。
单胺不仅直接影响突触神经传递,还可以通过其G蛋白偶联受体间接影响胞内通路。其中,阿片受体通过异源二聚化与5-HT和多巴胺受体发生功能相互作用。大量的临床和临床前证据表明阿片类受体参与MDD病理。阿片受体通过激活G蛋白介导的机制负向调节神经元的神经递质释放和兴奋性,导致钾通道功能增强,细胞去极化,抑制电压门控钙通道功能,负向调节神经递质释放,进一步影响神经元活性和可塑性。
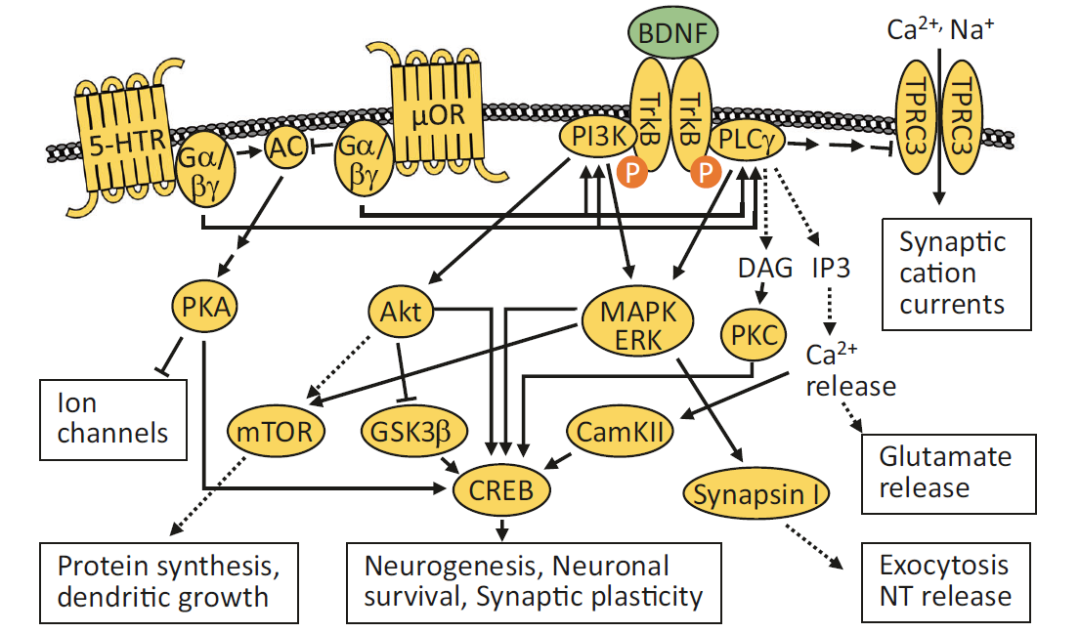
图2:血清素、阿片和BDNF的受体相关信号通路调节神经元活性及突触功能
2
神经营养因子假说
“抑郁症的神经营养假说”认为神经营养支持的中断是MDD相关突触和脑相关功能改变的关键机制。神经营养因子负责神经元网络形成、支持和可塑性。其中,BDNF是神经营养因子家族的重要成员,可以激活原肌球蛋白相关激酶(Trk)和p75受体。大量研究表明持续抑郁和复发患者、抑郁症动物模型中,血液中神经营养因子水平降低。值得注意的是,抗抑郁治疗和电休克治疗增加BDNF水平。
传统和快速抗抑郁药起效不仅需要BDNF表达及其下游信号,而且抗抑郁药可以直接结合TrkB二聚体的跨膜结构域,使多蛋白复合体形成稳定的构象,促进TrkB与BDNF的结合。通过Trk受体,神经营养因子可以激活细胞信号通路,调控细胞命运,轴突生长,树突生长和修剪,以及整体正常的神经元功能。
BDNF最显着的作用之一是促进海马成年神经发生,可能通过上述大多数信号传导起作用。MDD中的海马神经发生缺陷与尸检发现的海马大小和体积减小、神经元和胶质细胞数量下降以及细胞大小的减少有关。研究发现神经发生和突触活动之间存在显着相关性,包括长时程增强(LTP)。成年新生神经元可以通过重新分配已存在的突触来调节树突棘密度和兴奋性突触传递。重要的是,抗抑郁药可诱导神经发生,增加可塑性,并逆转海马萎缩。
3
HPA轴假说
应激暴露(特别是在生命早期),是研究得最完整和已确定的抑郁症风险因素。HPA轴是协调机体应激反应的关键。机体通过应激分泌的糖皮质激素激活糖皮质激素受体(GRs)的负反馈机制来终止应激反应。在一些抑郁症患者中发现皮质醇水平升高、HPA过度活动和HPA轴负反馈功能失调。因此,针对HPA轴的多种药物被开发用于治疗抑郁症,包括皮质类固醇合成抑制剂,GR拮抗剂,促肾上腺皮质激素释放激素受体拮抗剂。
应激诱导大脑树突顶端和突触后树突棘萎缩,导致显着的突触重构。机制上,糖皮质激素通过激活膜受体,增加前额叶皮层中易于释放的谷氨酸囊泡池。应激的突触和行为效应也通过阿片系统介导。糖皮质激素的信号转导与大多数与抑郁相关的通路交互作用,如BDNF, FKBP51和自噬通路。
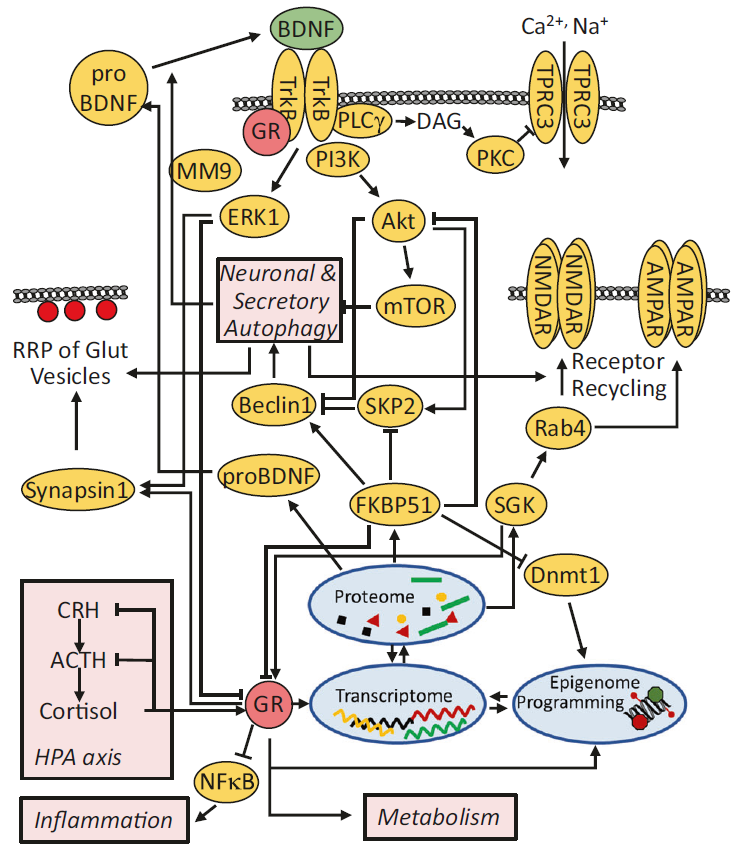
图3:应激信号与多种抑郁相关的通路交织
4
细胞因子假说
“抑郁症的细胞因子假说”认为MDD和炎症过程的失调是双向的。持续的免疫反应,如感染、恶性肿瘤或自身免疫疾病,可导致抑郁。事实上,增强的炎症反应与MDD相关。与MDD相关的特异性促炎细胞因子及其受体包括IL-6、TNF-α、IL-1β、IL-2、IL-2受体、IL-4、IL-10、IL-1受体拮抗剂、转化生长因子-β和c反应蛋白(CRP)。促炎细胞因子也与MDD严重程度相关。
人们提出许多机制解释MDD中炎症的发生,包括炎症小体信号通路、氧化应激、BBB通透性改变及外周免疫细胞入脑等。炎症通路影响突触活性的机制包括促炎细胞因子调节NMDA和AMPA受体亚基的表达,减少AMPA受体磷酸化,最终影响谷氨酸突触和LTP相关过程。
免疫系统与神经内分泌系统密切相关,糖皮质激素在不同情况下发挥促炎或抗炎作用。此外,MDD中增加的炎症介质可显着干扰线粒体氧化磷酸化和ATP生成,最终导致氧化应激增加。
5
线粒体假说和氧化应激假说
支持“抑郁症的线粒体假说”的证据是,大量研究发现一些抑郁患者存在线粒体功能紊乱,线粒体结构和功能改变,包括ATP生成减少,线粒体动力学 (融合、分裂、线粒体自噬) 紊乱。线粒体功能紊乱还会产生自由基和氧化应激。在抑郁症中氧化应激标志物升高,而抗氧化能力降低。此外,随着疾病的进展,线粒体功能障碍和氧化损伤呈进行性发展。
因此,"抑郁症的氧化应激假说"提出氧化应激是导致抑郁症患者脑结构改变的原因。正常水平的活性氧(ROS)是重要的信号分子,在神经元细胞功能中发挥关键作用。然而,当处于高水平和低抗氧化剂存在时,ROS可能对神经元和LTP有害。氧化应激的增加可能会导致进一步的线粒体损伤,增加细胞凋亡,最终导致炎症信号。
线粒体通过多种方式调节突触功能和可塑性,包括ATP的产生,Ca2+缓冲和信号传递,神经递质的合成,建立和维持膜兴奋性,以及调节突触囊泡池和神经递质释放。线粒体可以产生突触可塑性所需的氧和氮,并激活树突中caspase,诱导突触后树突棘的清除。
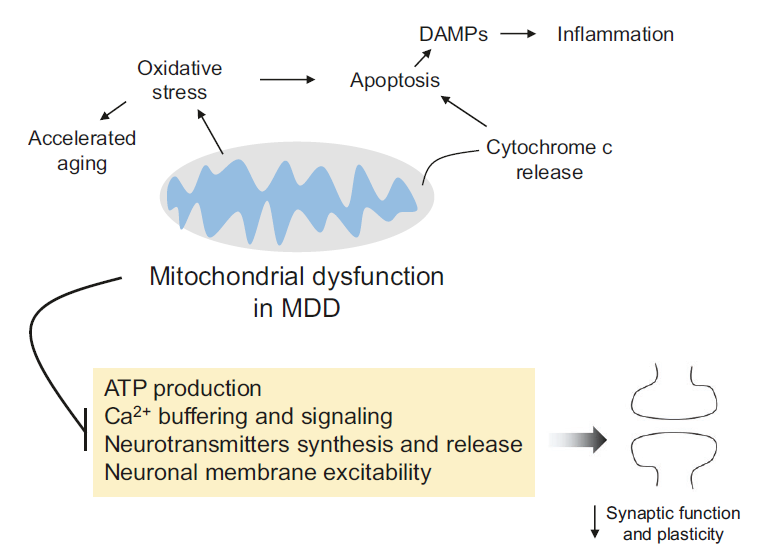
图4:线粒体功能障碍在抑郁症中的作用及其对突触功能的影响
6
“微生物-肠-脑轴”假说
支持“肠-脑轴”假说的证据是:MDD中的肠道微生物组的改变。反之,补充益生菌或地中海饮食对患者产生抗抑郁作用。微生物组改变和抑郁样行为之间的因果关系也可以从粪菌移植微生物群或特定细菌实验中得到证实。微生物通过特定分子调节突触功能影响大脑活性。典型例子是犬尿氨酸途径,它是必需氨基酸色氨酸的代谢产物。色氨酸是最早报道(60-80多年前)与抑郁症有关的营养物质之一。
色氨酸转化为神经递质5-羟色胺与突触功能和抑郁明显相关。然而,色氨酸主要通过犬尿氨酸代谢途径,产生神经毒性(如喹啉酸)和神经保护(如犬尿酸)代谢物。犬尿酸通过与甘氨酸结合位点结合,作为谷氨酸受体拮抗剂直接作用于突触。而喹啉酸是谷氨酸受体激动剂,增强谷氨酸的释放,抑制星形胶质细胞对谷氨酸的再摄取。
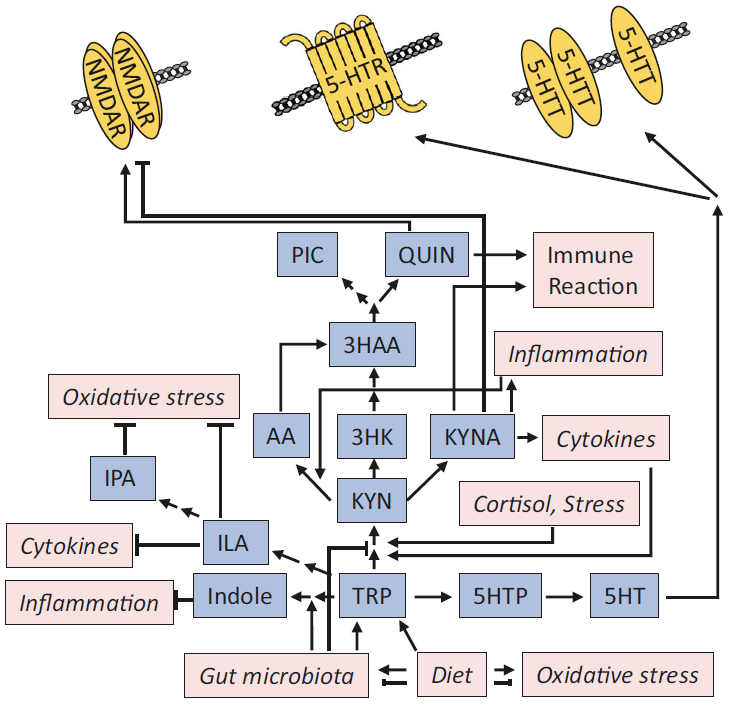
图5:肠道微生物及其代谢物在抑郁症中发挥作用的例证-犬尿氨酸通路
总结
这篇综述总结了促成抑郁症发生发展的主要通路和系统之间的分子联系。每个通路的相对贡献在患者个体之间有所不同,这反映了疾病的高度复杂性。完全理解多种分子途径与MDD的关联是不现实的。
原始出处:
Fries, G.R., Saldana, V.A., Finnstein, J. et al. Molecular pathways of major depressive disorder converge on the synapse. Mol Psychiatry (2022). https://doi.org/10.1038/s41380-022-01806-1.


