PNAS:Aβ寡聚体或是灵长类动物加速衰老的元凶
时间:2023-01-26 06:02:17 热度:37.1℃ 作者:网络
背外侧前额叶皮层(DLPFC)和海马是参与认知功能关键区域,同时也是在衰老和阿尔茨海默病(AD)中突触损伤最为明显的区域。神经胶质细胞衰老也可能与神经退行性疾病的易感性有关,包括:分裂停止、重要细胞内途径的抑制以及炎性信号分子和蛋白酶的释放。在过去的几十年中关于AD药物的开发注入了大量资金,但是却没有有效的治疗方法来预防或延缓AD的进展,其主要原因之一是AD药物大多是依据啮齿类动物模型研究和开发的。另一个重要因素是,尽管当前将近三分之二的AD患者是女性,但大多数AD研究使用雄性动物。因此,加州大学John H. Morrison研究团队选择在雌性恒河猴的侧脑室中注射可溶性的Aβ寡聚体(AβOs)来建立AD模型,以期有不一样的发现。

作者发现AβOs与DLPFC的锥体神经元具有高亲和力,同时大部分与AβOs突触后致密蛋白95(PSD95)共定位,与突触前标志蛋白突触素共定位较少。注射AβOs和老年恒河猴均显示出DLPFC锥体神经元树突棘密度的下降,其中具有高可塑性瘦长型树突棘显著丢失,而成熟的蘑菇型树突棘则没有变化。
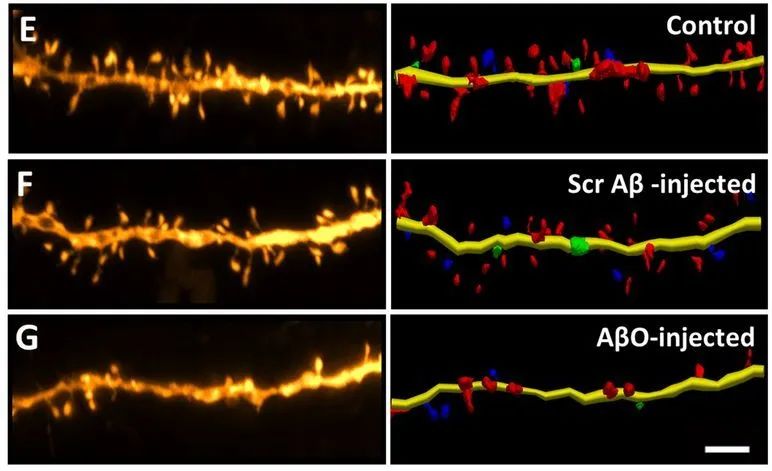
图1. 衰老或注射AβOs引起恒河猴DLPFC的形态变化
作者发现衰老和AβOs都会引起恒河猴DLPFC小胶质细胞的体积增加,注射AβOs后小胶质细胞选择性吞噬突触后蛋白PSD95。同时,作者在海马DG区也发现了注射AβOs后小胶质细胞数量的增多和分支减少的现象。作者在进一步实验中每10天收集实验动物的脑脊液进行检测,发现注射AβOs后,动物的脑脊液中Aβ寡聚体和Aβ1-42不断累积,Aβ1-40则没有变化。在注射AβOs过程中实验动物无明显的神经退行性病变。炎症因子TNF-α水平在注射AβOs后第30天上升,这与DLPFC和海马中小胶质细胞激活的增加以及大脑中的神经炎症反应相关。此外,在注射期间tau蛋白几个关键的磷酸化位点(ser199, ser231和ser396)和总的tau水平没有显著改变,说明注射AβOs并不诱导tau蛋白依赖的病理过程。
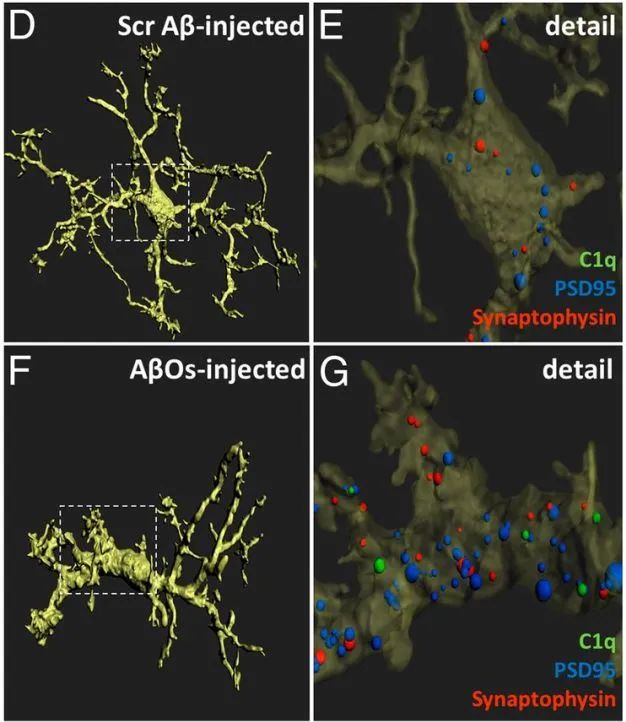
图2. 衰老或注射AβOs诱导小胶质细胞形态变化
基于以上的研究作者提出,AD病理进展可能始于无神经元死亡的“突触”阶段,然后是与神经元死亡相关的变性阶段,最后是发生多种病理改变的临床阶段,每个阶段持续数年。“突触”阶段的第一个事件是AβOs与树突结合,诱发瘦长型树突棘的丢失和神经胶质细胞形态变化。在AβOs开始积累并且靶向突触时,予以干预有望实现更好的治疗效果。
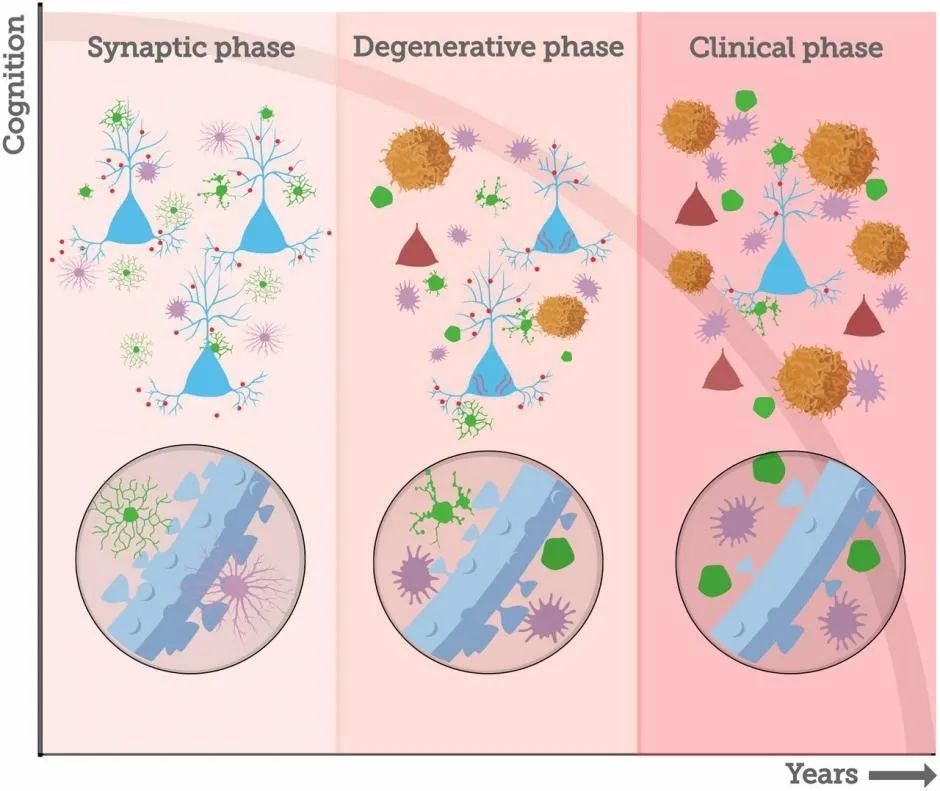
图3. AD病理进程的时间轴
由于雌激素疗法可以影响老年恒河猴的突触健康。激素变化是绝经过渡期女性激素变化的标志之一。因此,在以后的研究中作者将进一步评估卵巢激素替代治疗法在老年女性中的潜在作用。
编译作者:胖兔子可可 (Brainnews创作团队)
参考文献:
Beckman D, Ott S, Donis-Cox K, et al. Oligomeric Aβ in the monkey brain impacts synaptic integrity and induces accelerated cortical aging [published online ahead of print, 2019 Dec 23]. Proc Natl Acad Sci U S A. 2019;116(52):26239–26246. doi:10.1073/pnas.1902301116


