Nature Communications:聂广军/赵潇团队通过磁场时空操纵细菌,实现肿瘤精准免疫治疗
时间:2023-04-12 20:38:11 热度:37.1℃ 作者:网络
早在19世纪,细菌就被用于肿瘤治疗。对肿瘤微环境的深入研究表明,肿瘤细菌治疗的成功得益于许多细菌的天然肿瘤靶向能力,它们优先聚集在肿瘤组织中。转型厌氧菌可特异性定植于实体瘤的缺氧区域,而兼性厌氧菌分别具有趋化受体和鞭毛用于感知和推进,趋化受体引导细菌朝着肿瘤微环境中产生的分子信号前进,而鞭毛则使细菌能够穿透各种生理屏障,“游”进肿瘤组织深处。而肿瘤中的免疫抑制微环境阻止了这些细菌被免疫系统消灭,促进了细菌在肿瘤中的优势生长。
第一代肿瘤细菌疗法使用天然的、活的、灭活或失活的细菌来治疗肿瘤,随着基因工程技术的发展,第二代肿瘤细菌疗法采用了基因工程细菌,具有增强和整合的抗肿瘤功能,并提高了生物安全性。
近年来,随着纳米技术的快速发展,第三代肿瘤细菌疗法出现了,通过采用定制纳米材料辅助细菌,集多种功能于一体,表现出类似生物机器人的行为。纳米材料修饰可以显着扩展工程细菌的功能,使其包含传统基因工程无法实现的活性,这种第三代肿瘤细菌疗法在癌症诊断和治疗方面具有巨大潜力。
近日,中国科学院国家纳米科学中心聂广军、赵潇等人在 Nature Communications 期刊发表了题为:Modular-designed engineered bacteria for precision tumor immunotherapy via spatiotemporal manipulation by magnetic field 的研究论文。
该研究开发了一种模块化设计的工程细菌,借助磁性纳米材料的磁热效应,创新实现交变磁场对体内细菌基因表达和药物释放行为的时间-空间精准操纵,最终实现肿瘤的精准免疫治疗。

传统的第一代细菌疗法利用天然细菌发挥抗肿瘤作用,如FDA批准的治疗膀胱癌的卡介苗,虽然具有较好的治疗效果,但是细菌毒性严重阻碍细菌疗法的进一步应用。第二代细菌疗法通过基因工程改造增强细菌的抗肿瘤功能或者敲除毒力因子获得减毒细菌,极大提高其治疗效果和安全性。
随着纳米技术的迅速发展,借助功能化的纳米材料辅助细菌疗法,构建“细菌-纳米材料杂合系统”,已发展成为更加安全、强效、智能的第三代细菌疗法。体内细菌基因表达的精准控制是细菌疗法安全性和有效性的基础,然而,目前仍缺少有效的精准操纵手段。
传统基因工程改造菌的诱导型启动子是控制细菌基因表达最常用的策略,然而无论是利用肿瘤微环境敏感型启动子(如缺氧、微酸响应型启动子),还是外源诱导剂响应型启动子(如阿拉伯糖响应型启动子),很难实现对体内细菌基因表达的精准操纵。
近年来,近红外光已被用于基因表达操纵,然而有限的组织穿透能力限制了深部肿瘤的应用。作为理想的操纵手段,磁场具有优良的肿瘤组织穿透能力、安全性和非侵入性,但是借助传统的基因工程技术难以实现磁场对细菌基因表达的操纵。
在这项研究中,研究团队借助磁性纳米材料的磁热效应,创新实现交变磁场对体内细菌基因表达和药物释放行为的时间-空间精准操纵,最终实现肿瘤的精准免疫治疗。
修饰在肿瘤靶向菌表面的顺磁性Fe3O4纳米颗粒使其能够接收磁信号并将其转化为42℃热量,在热敏启动子的控制下启动裂解蛋白的表达,实现细菌的裂解和药物蛋白(抗CD47纳米抗体)的释放。
同时,该研究发现并阐明工程菌裂解物的强大免疫原性能够有效激活抗原提呈细胞的I型干扰素(INF-1)通路,与CD47阻断疗法产生协同抗肿瘤效果,将CD47的“别吃我”信号介导的天然免疫强化为CD8+T细胞介导的适应性抗肿瘤免疫反应,对原位结肠肿瘤以及远端肿瘤产生强大的抗肿瘤作用。
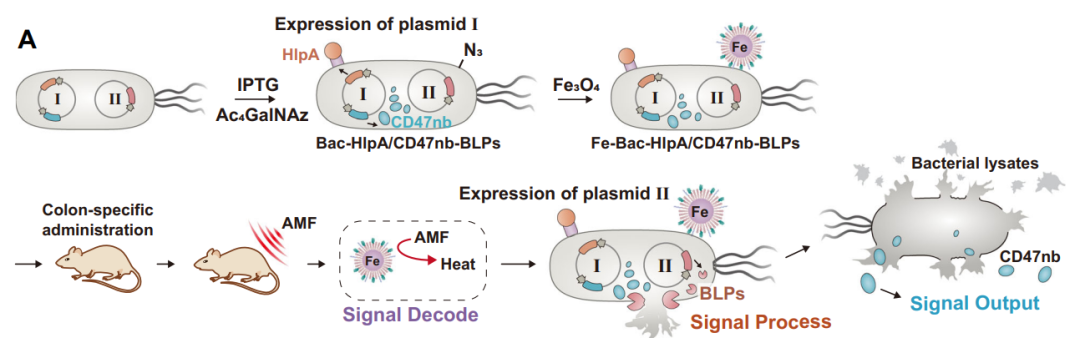
基于磁场精准操纵的工程菌的精准免疫治疗的工作原理及其抗肿瘤免疫效应
综上所述,该研究构建了基于细菌的交变磁场操纵的微型生物机器人AMF-Bac原型,该原型由主动导航、信号解码、信号反馈、信号处理和信号输出五个模块组成。在靶向原位结肠肿瘤后,修饰细菌上的Fe3O4纳米颗粒使AMF-Bac能够接收并将磁信号转化为热信号,从而启动细菌裂解蛋白的表达,导致细菌裂解并释放预表达并存储在AMF-Bac中的抗肿瘤蛋白CD47纳米抗体。
这些结果不仅证明了一种无创、实时和时间-空间的交变磁场操纵肿瘤归巢细菌基因表达的方法,而且还将模块化设计的概念引入到细菌系统的构建中,从而实现肿瘤的精准免疫治疗。
原始出处:
Ma, X., Liang, X., Li, Y. et al. Modular-designed engineered bacteria for precision tumor immunotherapy via spatiotemporal manipulation by magnetic field. Nat Commun 14, 1606 (2023). https://doi.org/10.1038/s41467-023-37225-1.


