ATVB 上海交通大学医学院张力教授团队揭示中性粒细胞弹性蛋白酶介导胸主动脉夹层的作用和机制
时间:2023-08-21 11:39:02 热度:37.1℃ 作者:网络
胸主动脉夹层(Thoracic aortic disp, TAD)是一种致命的主动脉疾病,死亡率和发病率很高,>65岁患者主动脉内膜撕裂的发生率为35/10万。尽管主动脉瘤(AA;另一种致死性主动脉疾病)和TAD有多种相似组织病理学改变,如血管平滑肌细胞(SMC)凋亡或坏死、内侧区域的黏液样变性和细胞外基质(ECM)破裂,但大多数TAD病例(80%)没有发现先前存在的动脉瘤。此外,ApoE敲除小鼠研究表明,TAD先于动脉瘤和血管紧张素II(Ang II)诱导的动脉粥样硬化形成,这表明了这两种致命主动脉疾病的形成存在不同机制。虽然有一些证据表明,TGFβ和Ang II信号失调、缺氧和氧化应激增加、基质金属蛋白酶及其内源性抑制剂失衡以及炎症会促进TAD的形成及发展,但TAD潜在的细胞和分子机制仍然不清楚。
NE(中性粒细胞弹性蛋白酶)是一种丝氨酸蛋白酶,据报道其主要功能是破坏细胞内和细胞外的病原体。它对各种ECM蛋白以及各种非基质蛋白,如细胞因子/趋化因子、细胞表面蛋白/受体表面蛋白和其他功能可溶性蛋白具有强大的蛋白水解活性。NE与多种破坏性和炎症性疾病有关,包括急慢性肺部疾病和心血管疾病。具体而言,在人动脉粥样硬化斑块中均可检测到NE mRNA和蛋白,并且在动脉粥样硬化发展过程中可以观察到NE血浆活性增加。在先前的研究中,张力教授团队已经证实了NE在动脉粥样硬化发生和损伤诱导的新生内膜SMC增生(British Journal of Pharmacology, 2021)中的因果作用。然而,关于NE在TAD中的潜在作用,目前仍知之甚少。
2023年8月17日,上海交通大学医学院附属新华医院张力教授团队在Arteriosclerosis, Thrombosis, and Vascular Biology杂志上发表了题为“Causal Role for Neutrophil Elastase in Thoracic Aortic Disp in Mice”的论文,揭示了NE及其下游靶点TBL1x通过调控炎症细胞迁移和血管平滑肌细胞表型转换在TAD中发挥重要作用,为治疗高危TAD患者提供了新的药物靶点。

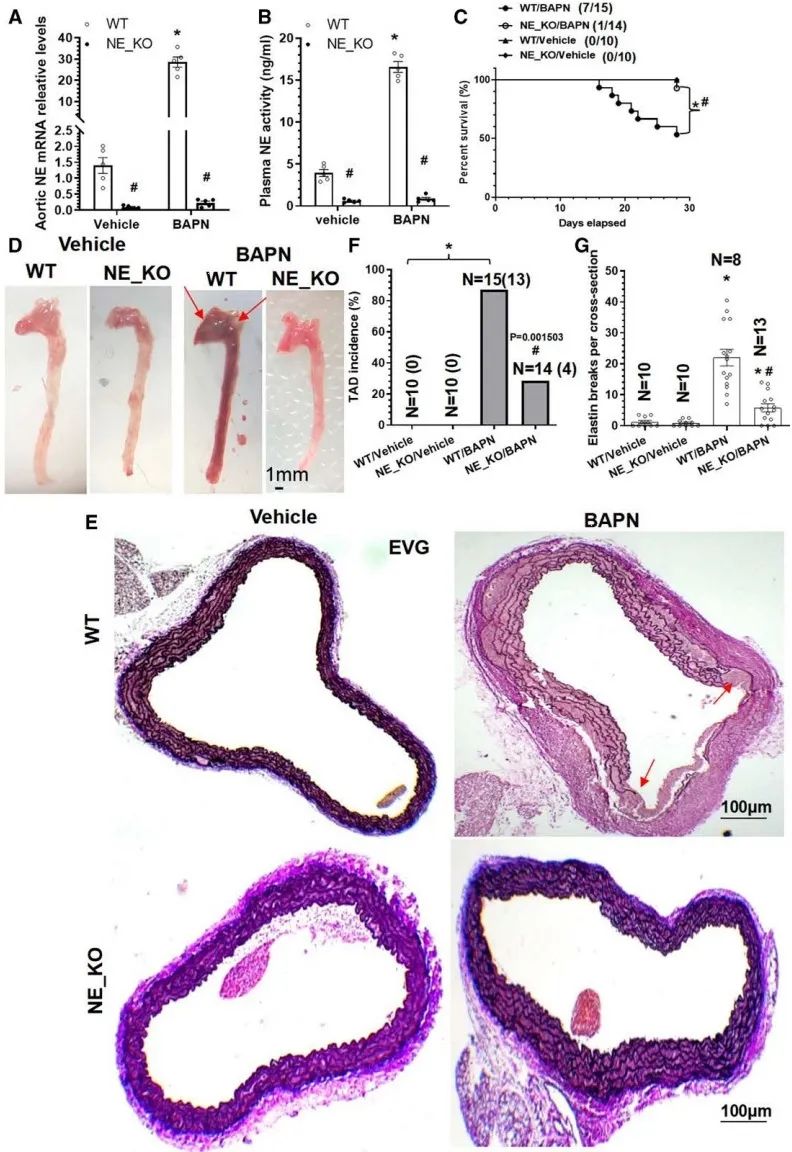
首先,该研究采用NE基因敲除小鼠结合氨基丙腈富马酸盐(BAPN)诱导的小鼠TAD模型,发现NE缺失可抑制TAD的发生发展。与野生型小鼠相比较,NE基因敲除小鼠的TAD发生率和死亡率均明显下降,弹力膜的断裂明显减轻。采用NE抑制剂抑制NE活性,也获得了类似的结果,进一步证实了NE在TAD中的重要作用。
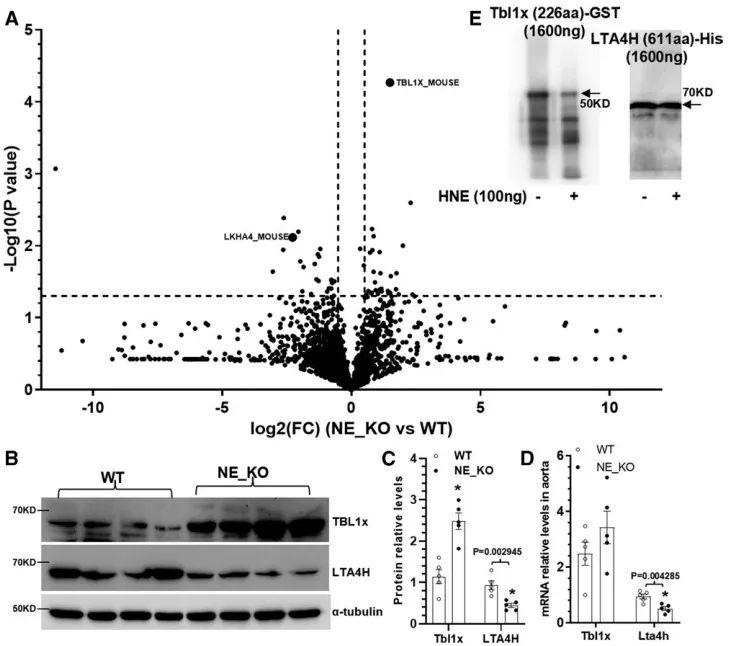
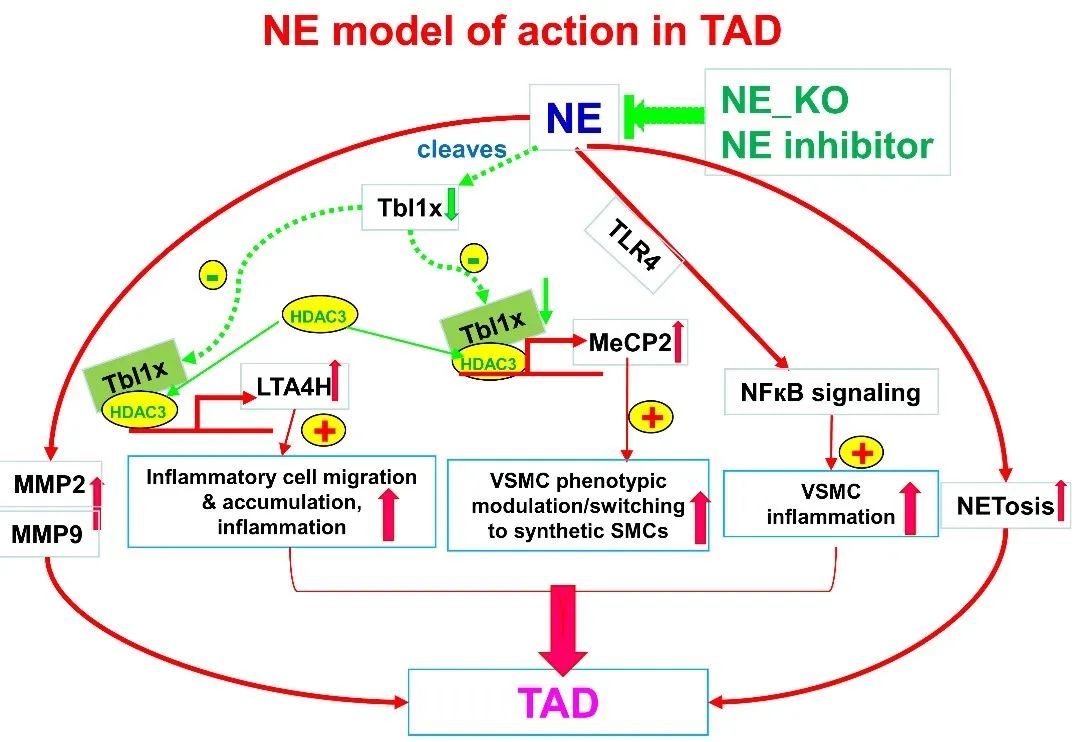
接着,作者采用蛋白组学探索NE调控TAD发生发展的分子机制,发现NE处理后,TBL1x和LKHA4(又名LTA4H)的蛋白水平发生显著改变,可能是NE的下游靶点。Western Blot显示,NE敲除后,TBL1x的蛋白水平升高,LTA4H蛋白水平下降。通过体外降解实验进一步证实,NE可降解TBL1x蛋白。
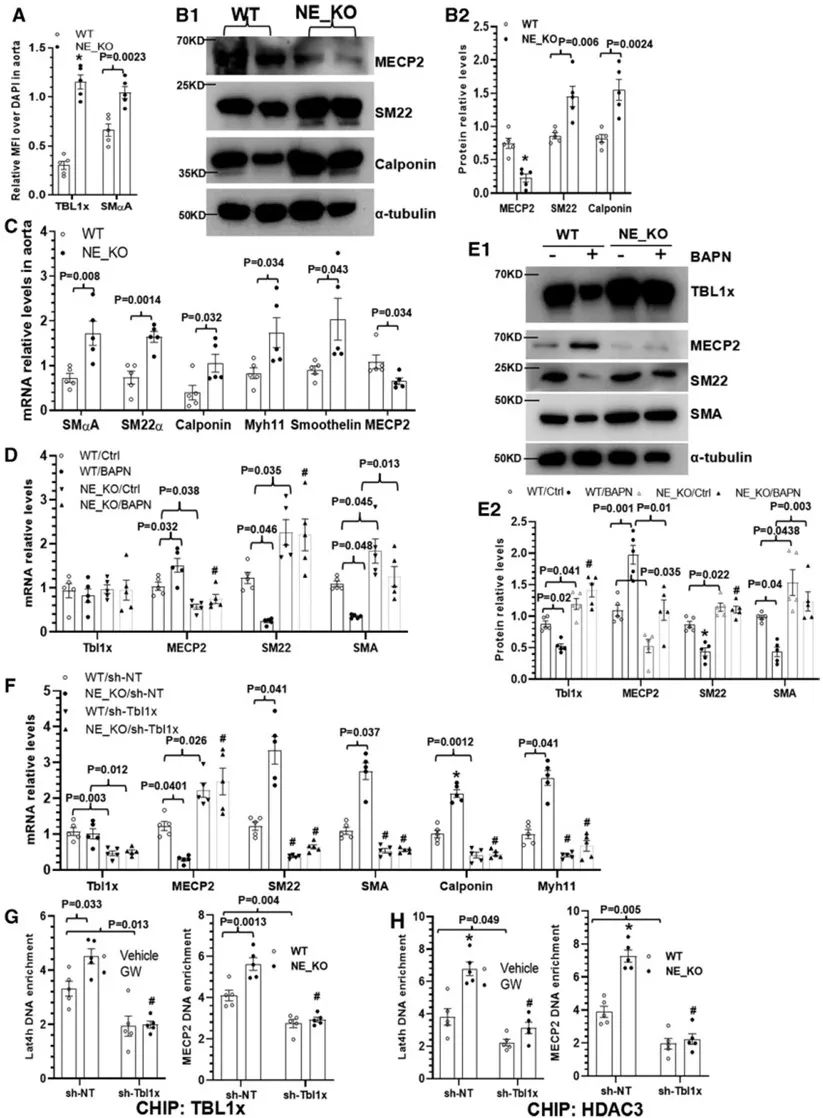
进一步的机制研究发现,NE通过调节TBL1x-LTA4H信号通路介导炎症细胞跨内皮迁移,并且在TAD病理条件下,通过调节TBL1x-MECP2信号轴调节平滑肌细胞表型转换。
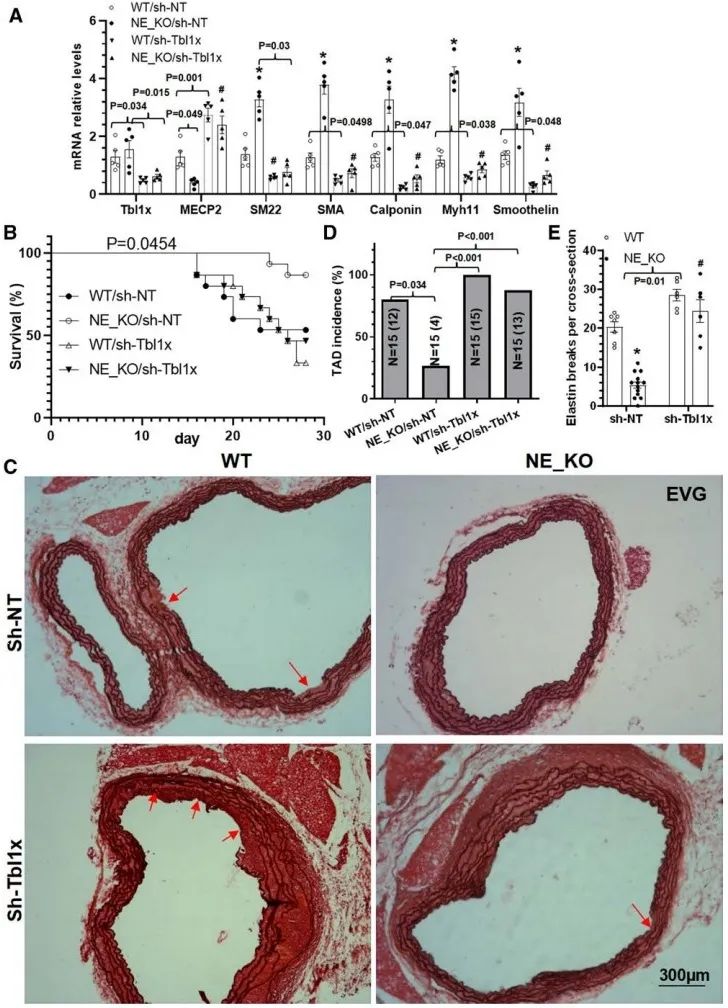
最后,本研究采用腺相关病毒介导的Tbl1x基因敲低实验证实了TBL1x在NE介导的TAD形成中的作用。结果显示,Tbl1x基因敲低后,小鼠的死亡率、TAD的发生率显著增加,NE敲除的保护作用被抵消。
综上,本研究揭示了NE通过降解其下游靶点TBL1x,促进炎症细胞迁移及平滑肌细胞表型转换,进而促进TAD的发生发展,NE缺失和NE活性抑制均可显著抑制TAD的进展,NE-TBL1x信号轴可能是TAD治疗的干预靶点。
上海交通大学医学院附属新华医院张力教授、伦敦玛丽女王大学肖庆忠教授、首都医科大学附属北京安贞医院赵林教授为共同通讯作者,上海交通大学医学院附属新华医院杨眉、伦敦玛丽女王大学周昕苗和Stuart W.A. Pearce为本论文的共同第一作者。本研究得到了国家重点研发计划、英国心脏基金、国家自然科学基金等项目的支持。
原文链接:
https://www.ahajournals.org/doi/epdf/10.1161/ATVBAHA.123.319281


