Cancer Discovery:那仁满都拉/周春等破解三氧化二砷靶向结合急性早幼粒细胞白血病的机制
时间:2023-09-11 14:04:07 热度:37.1℃ 作者:网络
在中国,白血病的自然发病率大概是4/10万,当中有1/4是儿童患者。在儿童白血病患者里,患急性淋巴细胞性白血病的占了80%,急性髓系白血病患者占了15%左右。患急性早幼粒细胞白血病的占后者的10%。在中国,急性早幼粒细胞白血病每年的新发病例有1500~2000例,其中有200到300例是儿童。
急性早幼粒细胞白血病又名急性髓细胞白血病M3型(AML-M3),曾经是最致命的白血病类型之一。在20世纪70年代,该病的主流治疗方案是蒽环类药物联合阿糖胞苷化疗,然而,由于该方案会增加严重出血风险,患者5年无病生存(DFS)率仅30%。
2013年,全反式维甲酸联合三氧化二砷方案成为美国国立综合癌症网络(NCCN)指南以及欧洲指南推荐的急性早幼粒细胞白血病标准治疗方案,也被国际公认为急性早幼粒细胞白血病一线治疗最佳方案。
三氧化二砷的机制进行了很多研究,但仍然还有很多问题没有解决。此前研究表明,90%的APL遗传学特点是染色体t(15:17),即15号染色体上的APL基因PML和17号染色体PML--RAR (x融合蛋白的过度表达,它既能阻止细胞的分化,又能阻止细胞的凋亡。三氧化二砷能快速调节和降解PML-RARa融合蛋白,诱导APL细胞的分化和调亡,发挥治疗APL的作用,并称之为“靶向治疗”。
近日,浙江大学医学院那仁满都拉/周春团队联合法国Hugues de The教授团队,在Cancer Discovery杂志上发表了题为Structural Basis of PML/RARA Oncoprotein Targeting by Arsenic Unravels a Cysteine Rheostat Controlling PML Body Assembly and Function的研究论文。该研究首次解析了PML蛋白B2结构域的晶体结构,并基于对C213V这一关键突变体的探究,突破性发现了三价砷离子通过直接与以Cys213(半胱氨酸)为中心的PML三聚体结合,进而发挥靶向治疗作用,揭开了三氧化二砷如何靶向癌蛋白进而治疗急性早幼粒白血病的谜团。

此前,PML蛋白RING和B1结构域的晶体结构已被成功解析,然而,对于最具有临床意义的B2结构域,由于其具有严重的聚集倾向性和不可溶性,其晶体结构的解析一直是领域内的攻关难点。本研究团队通过不断地优化和尝试,首次成功获得并解析了PML-B2蛋白晶体,发现其包含典型的b-box型锌指折叠,具有保守的β1-β2-α1排列。
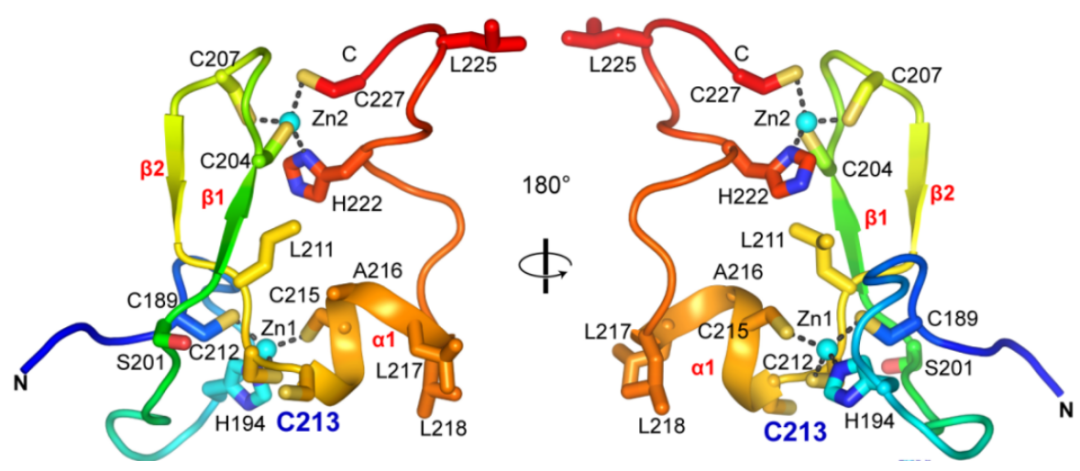
已有研究表明,TRIM5蛋白B2结构域能够通过α-螺旋形成以色氨酸为核心的三聚体结构。受此启发,我们使用Alphafold2对PML-B2的三聚体结构进行模拟。在该预测模型中,PML-B2三聚体由α-螺旋介导的相互作用所驱动,其中处于疏水界面上I202、C213、A216、L217和L218对三聚体的形成起关键性作用。生化实验结果进一步支持了该模型,L217G、I202A、L218G、A216V等突变体由于疏水性破坏而导致PML蛋白相互作用减弱,影响了PML-NBs的组装,并表现出高度流动性;而当218位的亮氨酸突变成疏水性更强的芳香类残基时,PML-NBs则形成了黏连性更强的丝带状结构,且流动性极大降低。此外,SEC-MALS实验结果直接检测到三聚体的存在,进一步验证了模型成立。
三氧化二砷(ATO)在体内生理pH下以三价砷离子(AsIII)的形式存在。在三聚体模型中,3个PML-B2单体通过213位点交互组成了一个以3个游离半胱氨酸为中心的口袋结构,这一结构给AsIII的结合提供了天然理想位点。于是,为了验证AsIII是否通过与C213结合进而发挥功能,我们构建了多种C213突变体。结果发现,虽然去除硫醇基(C213S或C213A)和增加空间位阻(C213L或C213F)都可以使PML蛋白抵抗砷剂诱导的降解,但由于这些突变彻底破坏了PML-NBs的结构,因此无法判别对ATO的抵抗是由于不能与213位点结合,还是由于PML核小体结构破坏导致的。而当C213突变为缬氨酸(C213V)时,则能够维持正常PML-NBs的组装,并使其保持与WT相同的流动性(由于缬氨酸的分支甲基可以在三聚体中心保持疏水相互作用),但该突变体却表现出对ATO完全抵抗。同时,烷化剂NEM能够通过与半胱氨酸残基结合而破坏PML-NBs,但却无法破坏PML(C213V)形成的NBs。该模型有力地证明了PML蛋白中第213位游离半胱氨酸即为ATO的结合位点。
综上所述,本研究基于对PML-B2晶体结构的测定,阐明了砷离子与以C213为核心的三聚体口袋结合,进而驱动PML/PML-RARa发生聚集、泛素化、降解等过程,从生化角度揭示了三氧化二砷能够特异性治疗APL而对其他类型AML疗效不佳的根本原因,为临床靶向药物的开发和克服三氧化二砷耐药提供了重要的理论依据。
那仁满都拉教授、周春研究员、Hugues De Thé、Valérie Lallemand-Breitenbach是本论文的共同通讯作者,Pierre Bercier、浙江大学博士后王茜茜,博士生臧宁为本论文的并列第一作者。
原文链接:
https://aacrjournals.org/cancerdiscovery/article/doi/10.1158/2159-8290.CD-23-0453/728828/Structural-basis-of-PML-RARA-oncoprotein-targeting


