NEJM:PD-L1抗体药对这种罕见肉瘤患者显示有效
时间:2023-09-19 11:07:35 热度:37.1℃ 作者:网络
腺泡状软组织肉瘤(ASPS)是一种极为罕见的软组织肉瘤,全球发病率低于每百万人一例,患者主要是青少年或年轻成人。ASPS一般来说生长缓慢,但预后不佳,且有较高的早期恶性转移倾向。患者的5年总体生存率在各项研究中在20~46%之间。
ASPS的分子特征是der(17)t(X;17)(p11;q25)的染色体易位,涉及两个基因ASPL和TFE3。科学家已发现了两种不同的ASPL-TFE3融合蛋白,二者也带来不同的基因组转录影响。但目前还没有确定这两种不同的基因融合事件是否会导致预后的不同。而且ASPS也一直缺乏标准疗法。这类肿瘤对传统化疗基本耐药,早期治疗包括手术与系统治疗,极少有治愈作用。由于ASPS属于软组织肉瘤,因此被FDA批准用于软组织肉瘤治疗的络氨酸激酶抑制剂pazopanib(帕唑帕尼)也用于ASPS的治疗。
近日,来自美国国立卫生研究院癌症研究所(NCI)的研究人员在 New England Journal of Medicine 上发表了题为 Atezolizumab for Advanced Alveolar Soft Part Sarcoma 的论文。该论文在一个多中心的单臂二期临床试验中显示,PD-L1抗体药atezolizumab(阿替利珠单抗)在约三分之一的ASPS患者中诱导了持久的应答。该结果也是FDA在2022年12月批准阿替利珠单抗用于2岁以上ASPS患者治疗的基础,为这种极为罕见的肉瘤患者带来了新的治疗选择。

过往在多种肿瘤类型里检测免疫检查位点抑制剂(如PD-1/PD-L1单抗、CLTA-4单抗)的临床试验显示ASPS可能对免疫治疗尤为敏感。但相关结果却因为那些试验里的ASPS样本量很小,以及有些涉及联合治疗,很难做明确解读。此外,ASPS对免疫治疗产生应答的分子机制也不甚清楚。由于上述原因,NCI的研究人员与基因泰克(阿替利珠单抗生产商)联合开展了一项二期多中心单臂临床试验,招募2岁以上,过往未接受过PD-1或PD-L1单抗治疗的ASPS患者,来探索阿替利珠单抗针对ASPS的有效性与安全性。
从2017年4月到2022年7月,17个研究中心共计招募了53名患者,其中52人接受了治疗。其中有三位是18岁以下的儿童患者,年龄在12-17岁之间。剩下的成人患者中位年龄是33岁。成人患者使用的阿替利珠单抗剂量为每次静脉注射1200mg,儿童患者则为每千克体重15mg(不超过1200mg)。患者使用阿替利珠单抗超过2年后可选择暂时中止治疗,如有需要再重新开始用药。
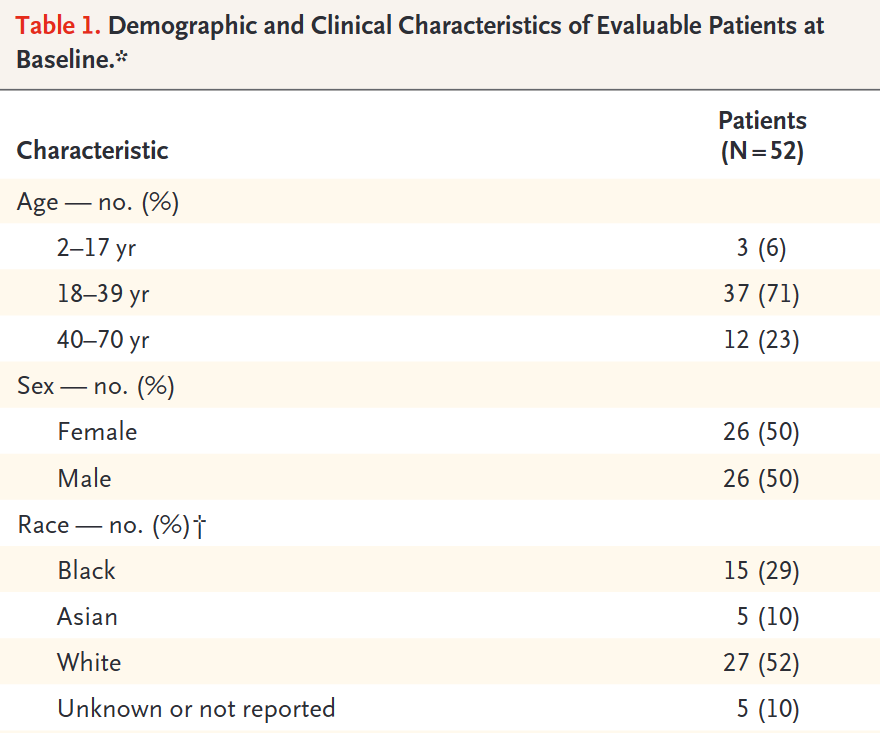
附表. 受试者部分人群特征
试验采用了Simon两阶段设计,如果前9位患者没有应答会终止试验,否则则会继续招募15名患者,而这前24名患者中至少出现3例应答才会继续检测药物有效性。在实际试验中,前19位患者有8例确认的应答。截止2022年7月,研究的中位跟踪时间达到了13.2个月,有7位患者在达到了2年治疗时间后暂时中止了阿替利珠单抗使用。
52名可评估的患者中有19人出现了客观应答,客观应答率达到了37%(95% CI:24-51%)。18名患者是部分应答(PR),1名患者是完全应答(CR)。CR的患者是在开始治疗后11.8个月后达到的。而在数据截止后,又有一名患者在治疗13.7个月后达到CR。全部19名有应答的患者,中位治疗到出现应答时间为3.6个月,中位应答持续时间是24.7个月。患者最大程度肿瘤缩小的中位数是-66.2%,范围在-36.6到-100%。
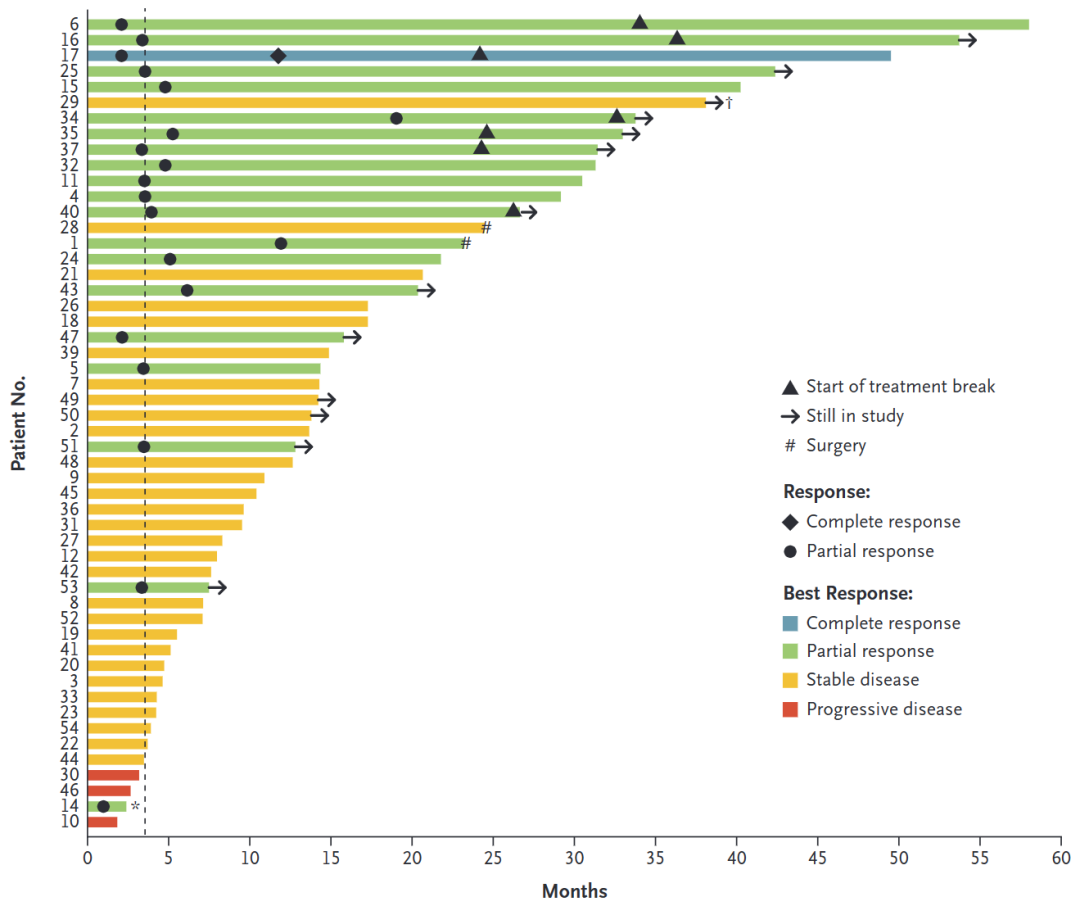
附图1. 受试者的应答状况
患者的中位无进展生存时间是20.8个月。而在针对患者有无接受过络氨酸激酶抑制剂状态的事后分析显示,过往使用或未使用此类药物的患者应答率类似。很多患者的肿瘤在较长时间里持续缩小。例如两位患者在治疗12个月后疾病状况突然好转。
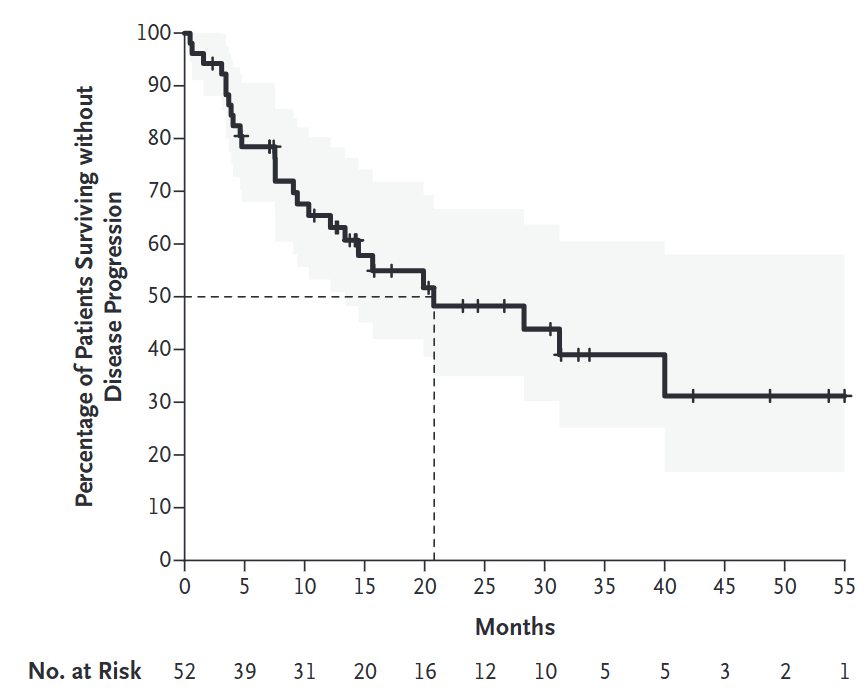
附图2. 受试者无进展生存时间
从安全性上看,阿替利珠单抗的表现与以往单药使用时报告的情况类似。试验中没有4级或5级不良反应,研究者判断与阿替利珠单抗相关的3级不良反应出现在8位患者身上,发生率为15%。
共有19名患者提供了肿瘤活检样本,有8名来自最佳应答为PR的患者,10人是稳定疾病(stable disease,SD),1人是进展性疾病(progressive disease,PD)。试验不具备比较不同应答状况下药物效应动力学表现的统计学效力。但从结果看,很多ASPS肿瘤都具有让阿替利珠单抗表现更好的特征,例如有更多的杀伤性T细胞,基线时的肿瘤微环境不那么具有抑制性(比如较低的调节性T细胞比例)。也有一些肿瘤在治疗期间出现了有利于阿替利珠单抗的转变,如从PD-L1表达阴性转为阳性。
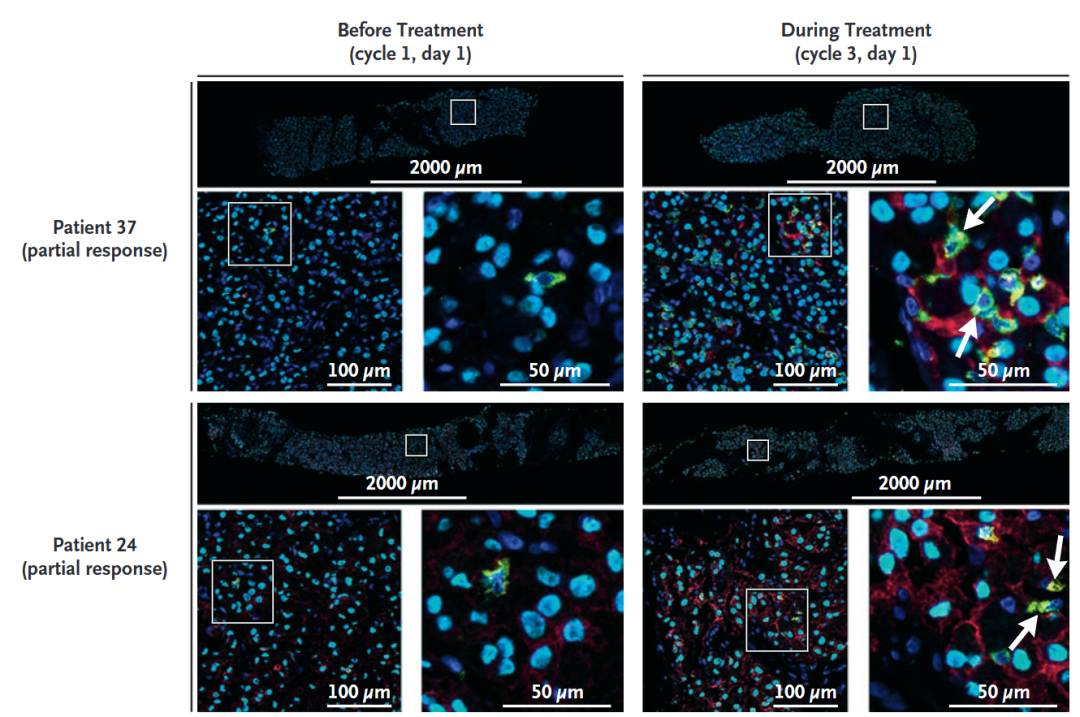
附图3. 一些患者在治疗过程中肿瘤上调了PD-L1表达(红色)且有更多杀伤性T细胞(绿色)侵入
总之,该研究显示阿替利珠单抗在ASPS患者中具有持久的抗肿瘤效果。这在过往其它药物用于ASPS试验中时非常罕见。也正是由于该结果,FDA已于2022年12月批准阿替利珠单抗用于ASPS治疗。
值得注意的是,本试验中阿替利珠单抗单药的应答率与过往ASPS患者用PD-L1与CTLA-4抗体联合治疗类似。但CLTA-4单抗带来更多不良反应,因此该结果也意味着未必需要在ASPS治疗中加入CTLA-4单抗。
研究显示ASPS肿瘤微环境有很多有利于免疫检查位点抑制剂的特征,这可能与ASPL–TFE3融合基因有关,后者的转录激活作用可能带来了更多的肿瘤新抗原,这方面值得进一步探索。患者能在治疗中出现PD-L1表达转变也意味着不能仅因基线肿瘤活检样本的生物标记物状态来排除患者,未来需要考虑使用治疗期间的生物标记物检测来预判疗效。
一个小样本研究显示PD-L1单抗与VEGF抑制剂联用在ASPS中的应答率达到了54.5%。研究人员已开始研究在阿替利珠单抗治疗后仍有疾病进展的患者中,使用VEGF抑制剂的效果。我们也期待今后ASPS这类极罕见的肉瘤患者能有更多有效的治疗方案。


