关注新生,预见未来 | 探究世界首个新生儿基因组测序临床随机试验——BabySeq项目
时间:2023-10-03 14:19:07 热度:37.1℃ 作者:网络
新生儿筛查是一项成功的公共卫生项目,通过足跟血检测进行早期诊断和疾病管理以预防疾病的发生,可有效提高生命质量。随着技术的进步,新生儿筛查已经扩大到涵盖更多的遗传性疾病。在美国医院出生的新生儿可通过足跟血筛查大约30种可遗传、可治疗的疾病,包括血液、内分泌和代谢紊乱疾病[1]。但不同国家地区的新生儿筛查实施情况差异很大,这种现状亟需改善。基因测序技术的发展为扩大新生儿筛查项目提供了前所未有的机会。目前,已有4,000多个基因与可识别的单基因疾病有关,这些疾病影响着全世界约4亿至7亿人[2]。
作为世界首个新生儿基因组测序临床随机试验项目,BabySeq项目旨在探索高通量基因组测序(NGS)在新生儿疾病筛查中的应用[3]。BabySeq项目有助于补充和扩展现有的新生儿筛查,同时筛查数千种新生儿可能在儿童期发病的风险疾病[1]。同时,这些疾病的早期诊断可以反过来促进特定的筛查、监测和治疗方案的研发,从而实现更加个性化和预防性的医疗保健。资料显示,BabySeq项目由布莱根妇女医院(BWH)和波士顿儿童医院(BCH)合作于2013年首次提出并启动,由美国国立卫生研究院(NIH)资助[4]。
BabySeq第一阶段于2013年启动,该阶段计划纳入两个队列:一组是在BWH出生的240名健康新生儿及其父母(如果有的话);另一组是来自BCH新生儿重症监护病房的240名婴儿及其父母。在每组中,一半的新生儿随机接受标准化的新生儿筛查,并进行家族史审查。另一半接受目前的标准护理治疗,并进行全外显子组测序(WES)[5]。
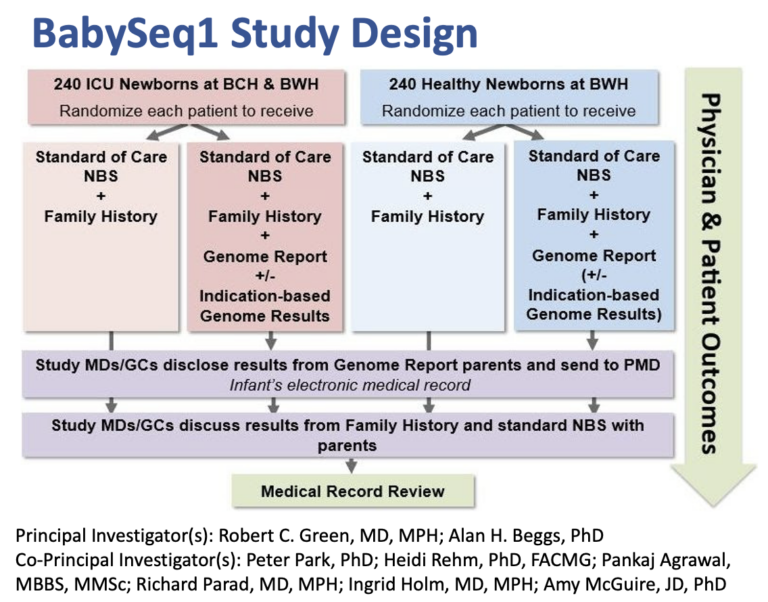
图1.BabySeq项目I期计划概要。来源:参考资料[1]
初步研究:WES揭示新生儿单基因疾病风险
2019年1月,研究团队在AJHG发表了BabySeq项目初步研究成果,文章题为“Interpretation of Genomic Sequencing Results in Healthy and Ill Newborns:Results from the BabySeq Project”[6]。研究发现,11%(18名)的新生儿存在意料之外的单基因疾病风险(uMDRs),在某些情况下,这些变异有助于解释已经进行的表型观察。这表明通过新生儿基因组筛查发现的uMDRs及临床上可操作的变异对新生儿及其家庭成员都具有临床意义。
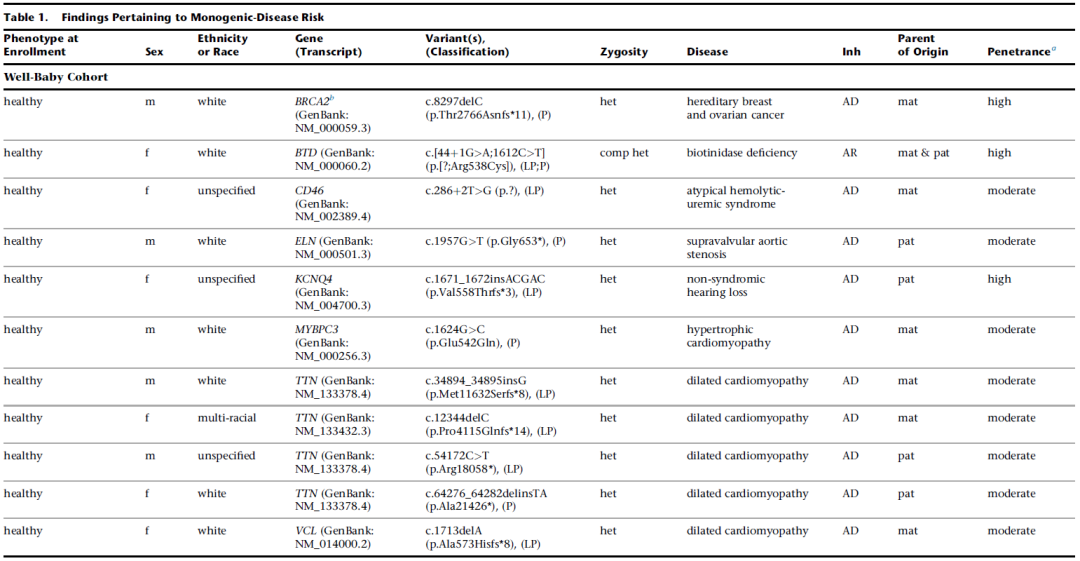

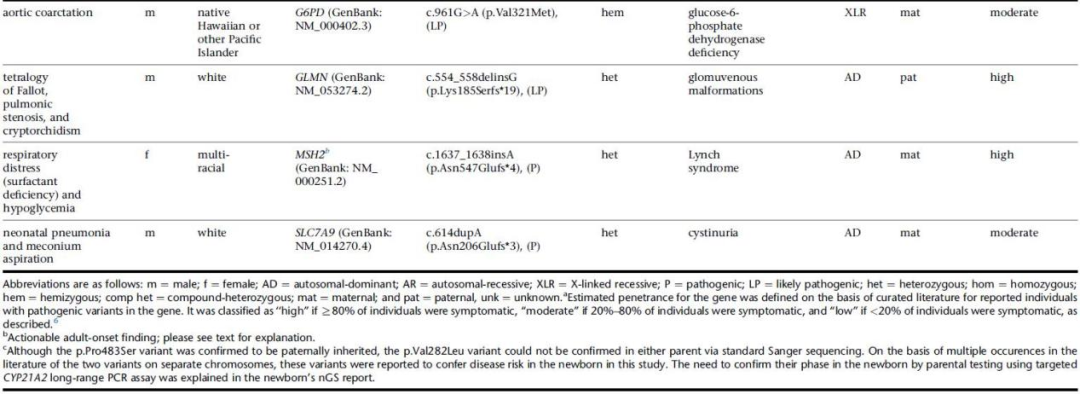
图2.单基因疾病风险发现结果。来源:参考资料[6]
该研究中,BabySeq项目团队招募了325名新生儿及其家庭,其中一半的新生儿接受标准筛查,另一半新生儿同时接受标准筛查和WES。研究团队将外周血来源的DNA与Illumina Content Exome(ICE)探针组杂交,并在Illumina平台上进行测序,并对近1000个基因进行了全面注释并返回了结果。
在参与WES的159名新生儿中,11%新生儿中发现了uMDRs,88%的新生儿至少有一种隐性载体变异,这可能关系到其父母未来的生育计划;5%的新生儿有非典型的药物基因组变异,这与他们如何处理童年时使用药物有关。这一初步研究结果表明,NGS可以在新生儿中有效检测一系列疾病的风险和携带状态,这些疾病是目前新生儿筛查分析无法检测到的,也无法根据新生儿临床资料或家族史预测。此外,检测父母样本还有助于解释和报告新生儿的测序结果。
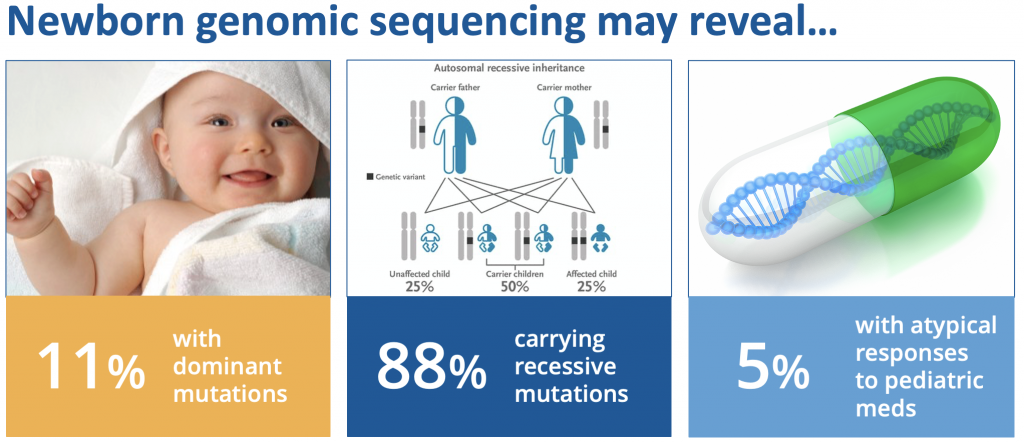
图3.BabySeq项目I期主要研究成果。来源:参考资料[1]
进一步探究:证实uMDR临床可操作性
上述BabySeq初步研究成果揭示了对新生儿疾病的早期诊断可能影响特定的筛查、监测和治疗方案,从而实现更加个性化和预防性的医疗保健。但这些新生儿基因组测序获得的致病基因的临床可操作性仍未可知。
2023年6月,发表在AJHG的一篇研究文章对这一问题进行了解答[7]。对于在首批进行基因组测序筛查的新生儿中发现的uMDRs,研究团队使用改进的临床基因组资源中心(ClinGen)可行动性半定量度量(CASQM)评估了每种uMDR的可操作性,并对婴儿进行了3-5年随访,并追踪了研究发现引发的医疗措施。
结果显示,所有这些突变都是医学可操作的,这意味着儿童可能会从早期治疗或监测中受益。在3名婴儿中,uMDR揭示了现有表型未预料到的遗传病因,在其余14名婴儿中,uMDR为未来的医学监测提供了风险分层。此外,在13名婴儿中,uMDR促使对有风险的家庭成员进行筛查。值得关注的是,三个婴儿的母亲被确定为此前未发现的成人发病癌症高风险,她们选择了接受降低风险的手术。同时,研究团队还创建了雷达图,表示病情的严重程度、外显度、干预的有效性和耐受性(如图4)。
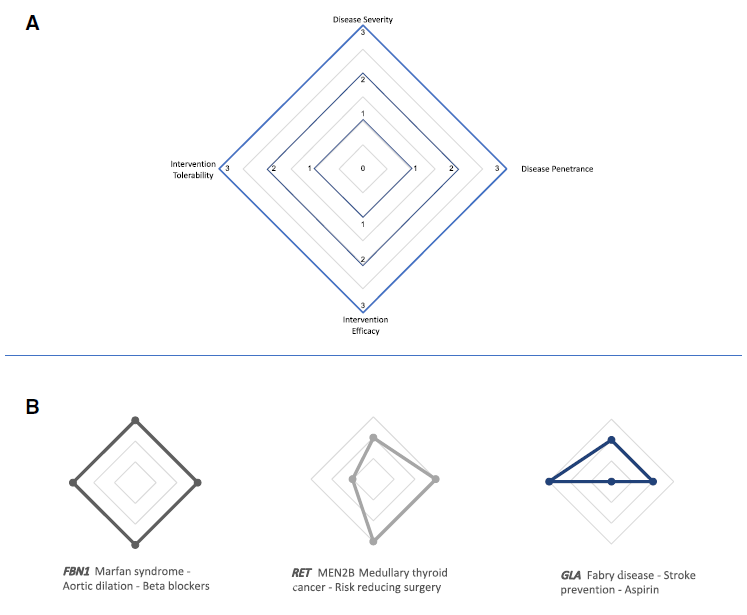
图4.临床可操作性雷达图。来源:参考资料[7]
(A)雷达图上菱形的四个点(从顶部开始,每个图顺时针移动)代表完全表达遗传状况的严重程度,该状况在个体一生中出现的外显率或可能性,特定干预的有效性,以及患者对干预的耐受性。在菱形内具有最大面积的雷达图将代表严重的遗传状况,具有高外显率和高效干预,患者特别可接受。(B)显示了ACMG次要发现列表中三个基因的临床可操作性雷达图。
这些来自BabySeq项目的医疗研究的早期数据表明,超过10%的婴儿可能携带意料之外的单基因风险,这将给这些婴儿及其家庭带来重要的医疗后果。
BabySeq项目的家庭和社会影响
新生儿基因组测序通过识别更多有可治疗遗传疾病风险的婴儿,扩大新生儿筛查的范围,为改善儿童健康和死亡率提供了一个机会。但人们对这些基因信息的效用有着深切担忧。研究人员对早期发现疾病的好处是否超过医疗保健系统增加的成本和负担,以及知道自己携带疾病风险基因对家庭的潜在心理影响方面仍存在分歧。
研究人员认为随机对照试验有助于缓解新生儿筛查会对父母产生有害心理影响的担忧。BabySeq团队发表在JAMA Pediatrics的一篇文章中指出[8],在包括325个家庭的随机临床试验中,接受单基因疾病风险检测的研究组没有出现焦虑或痛苦增加的信号,没有破坏亲子关系(对照组为接受标准的足跟采血新生儿),也没有出现持续的负面心理社会影响。
此外,2023年5月,由马萨诸塞州儿童总医院和哈佛大学医学院的研究团队在JAMA Network Open发表文章,通过问卷调查的研究方法,展示了200多位国际罕见病专家对于新生儿基因组测序的态度[9]。
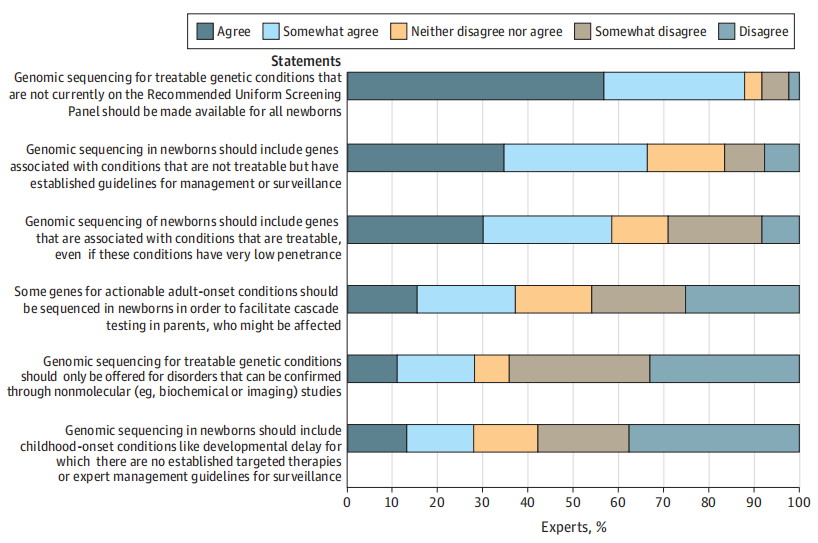
图5.专家对新生儿基因组测序中疾病范围的看法。专家们被要求表明是否同意关于新生儿基因组测序中应包括的疾病类型的6项声明。来源:参考资料[9]
调查结果显示,87.9%的专家同意/部分同意“应当为所有新生儿提供目前未列入RUSP(推荐筛查目录)的可治疗遗传疾病的基因组测序”,25种疾病支持筛查的比例≥85%。总的来说,目前绝大多数领域专家均支持通过基因组测序的方法扩大新生儿可筛查疾病范围,且部分病种纳入筛查获得了专家的高度一致认可。
BabySeq项目Ⅱ期:增加样本多样性
随着BabySeq项目Ⅰ期研究的顺利完成,研究团队已经于2022年2月1日开始了Ⅱ期研究,预计于2025年完成。研究团队计划从波士顿、纽约市、费城、底特律和阿拉巴马州伯明翰的不同人群中招募至少500名新生儿,纳入一个多样化的、具有全国代表性的家庭队列,并使用全基因组测序来确定其疾病风险。BabySeq项目Ⅱ期将同时对基因组测序对新生儿家庭潜在心理影响进行研究,并对有积极结果的婴儿进行随访[10]。
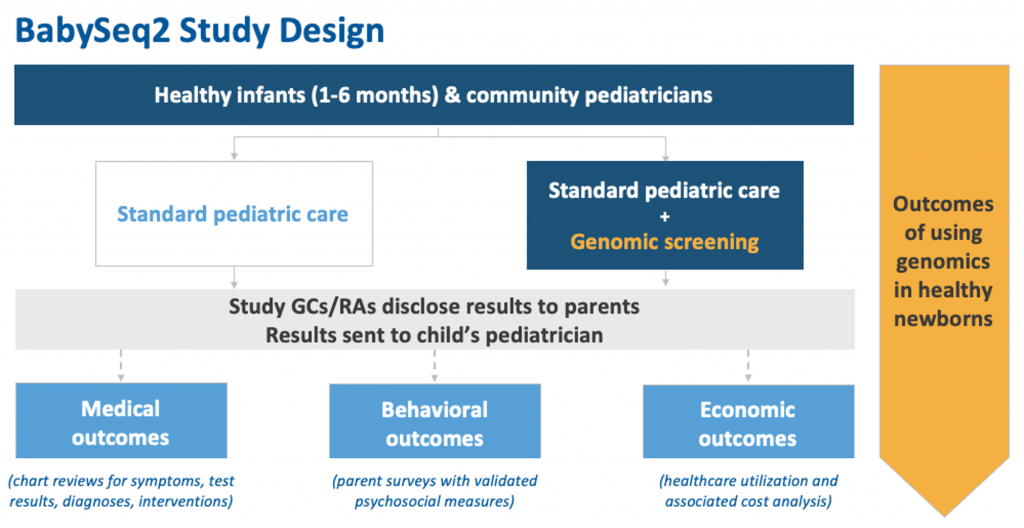
图6.BabySeq项目II期计划概要。来源:参考资料[1]
在精准医学时代,基因组测序技术的扩展推动着其在新生儿筛查的临床实践。随着基因测序成本的大幅下降,全基因组测序可为新生儿筛查带来新的突破,帮助临床医生更全面、更高效、更精准地发现新生儿潜在疾病风险,从而帮助其尽早进行治疗与医学干预,提高生命质量,降低社会负担。
参考文献:
[1] https://www.genomes2people.org/research/babyseq/
[2] Genomic newborn screening: current concerns and challenges. The Lancet, July 22, 2023. DOI:https://doi.org/10.1016/S0140-6736(23)01513-1
[3] https://www.babyseqproject.org/
[4] Brigham and Women's, Boston Children's to Evaluate Benefits and Risks of Infant Clinical Sequencing
https://www.genomeweb.com/diagnostics/brigham-and-womens-boston-childrens-evaluate-benefits-and-risks-infant-clinical
[5] BabySeq Researcher Presents Initial Findings at ACMG
https://www.genomeweb.com/sequencing-technology/babyseq-researcher-presents-initial-findings-acmg
[6] Ceyhan-Birsoy O, Murry JB, Machini K, et al. Interpretation of Genomic Sequencing Results in Healthy and Ill Newborns: Results from the BabySeq Project. Am J Hum Genet. 2019;104(1):76-93. doi:10.1016/j.ajhg.2018.11.016
https://www.genomes2people.org/wp-content/uploads/2018/11/20190101_BabySeq_AJHG__Ceyhan-Birsoy_InterpretationGS.pdf
[7] Green RC, Shah N, Genetti CA, et al. Actionability of unanticipated monogenic disease risks in newborn genomic screening: Findings from the BabySeq Project. Am J Hum Genet. 2023;110(7):1034-1045. doi:10.1016/j.ajhg.2023.05.007
https://www.genomes2people.org/wp-content/uploads/2023/05/20230605_BabySeq_AJHG_Green_UnanticipatedMonogenic.pdf
[8]Stacey P, Hadley SS, Leslie AF, et al. Psychosocial Effect of Newborn Genomic Sequencing on Families in the BabySeq Project: A Randomized Clinical Trial. JAMA Pediatr. 2021;175(11):1132-1141. doi:10.1001/jamapediatrics.2021.2829
https://jamanetwork.com/journals/jamapediatrics/fullarticle/2783316
[9] Gold NB, Adelson SM, Shah N, et al. Perspectives of Rare Disease Experts on Newborn Genome Sequencing. JAMA Netw Open. 2023;6(5):e2312231. Published 2023 May 1. doi:10.1001/jamanetworkopen.2023.12231
[10] https://classic.clinicaltrials.gov/ct2/show/NCT05161169?term=babyseq&draw=2&rank=3


