GUT:DNA甲基化特征在组织和血浆中准确区分胰腺癌和慢性胰腺炎
时间:2023-10-03 14:21:22 热度:37.1℃ 作者:网络
胰腺导管腺癌(PDAC)患者的5年生存率约为9%,转移性PDAC降至3%,其主要原因是晚期诊断、误诊和固有的治疗耐药性。PDAC的一个重要风险因素是慢性胰腺炎(CP),一种持续存在的外分泌胰腺纤维炎症性疾病。大约5%-6%的CP患者会患上PDAC。通常,PDAC和CP的初步诊断是通过成像完成的。

据报道,胰腺病变诊断的敏感性和特异性为CT为89%和90%,MRI为89%和89%,正电子发射断层扫描/CT为91%和72%;对于内窥镜超声引导的细针吸入,它们是89%和81%。基于成像的诊断产生部分不明确的分化,然而,由于PDAC和CP都存在局灶性胰腺肿块。区分PDAC和CP的敏感性和特异性通常仅在65%左右。因此,PDAC可能被错误地诊断为CP,迫切需要治疗诊断后生存期很短的患者可能会延迟。
相反,CP可能会被误诊为PDAC,导致不必要的胰腺切除。据报道,近10%因怀疑胰腺癌而接受手术切除的患者患有CP。需要更可靠地区分它们的过程;改进诊断将有助于选择适当的治疗方案。血清或血浆中的生物标志物是一种选择。碳水化合物抗原19-9(CA19-9)是PDAC诊断最广泛使用的血清标志物。然而,在CP、肝硬化和胆管炎患者中也检测到CA19-9水平升高。已经描述了许多其他血液生物标志物,但它们还不够可靠,无法进行常规诊断。
近年来,机器学习技术以及大规模、全基因组数据的出现促进了癌症诊断的准确生物标志物的识别。它们的应用在建立改善癌症诊断和治疗监测的生物标志物模型方面非常有用。关于PDAC,之前的研究侧重于与基于单一标记类型的健康、无炎症样本相比,识别癌症特异性生物标志物。
2023年8月31日发表在GUT的文章,引入了一种随机森林机器学习方法,该方法考虑到了不同“omic”类型的数据集:信使RNA(mRNA)、microRNA(miRNA)和DNA-甲基化剖面图。对它们进行了比较和组合,以便为PDAC和CP患者的鉴别诊断选择最佳生物标志物。最有前途的生物标志物在独立样本队列中得到了证实和验证,在组织和血浆样本中都产生了100%准确的诊断面板。
研究人员在345个组织样本中分析了DNA甲基化、信使RNA和microRNA水平的全基因组变异及其组合,以进行标记鉴定。为了提高诊断性能,研究人员建立了一种随机森林机器学习方法。结果在另外48个样本上得到验证,并在16个液体活检样本中进一步证实。
研究结果显示,机器学习成功地定义了标记,以区分PDAC和CP患者,而低维嵌入和聚类分析未能做到这一点。到目前为止,DNA甲基化产生了最好的诊断准确性,使转录水平的重要性相形见绌。识别的更改通过从公共存储库中提取的数据进行确认,并在独立样本集中进行验证。蛋白激酶Cβ型基因的CpG岛六个DNA甲基化位点的签名在组织和从患者血浆中分离的循环游离DNA中实现了100%的验证诊断准确性。
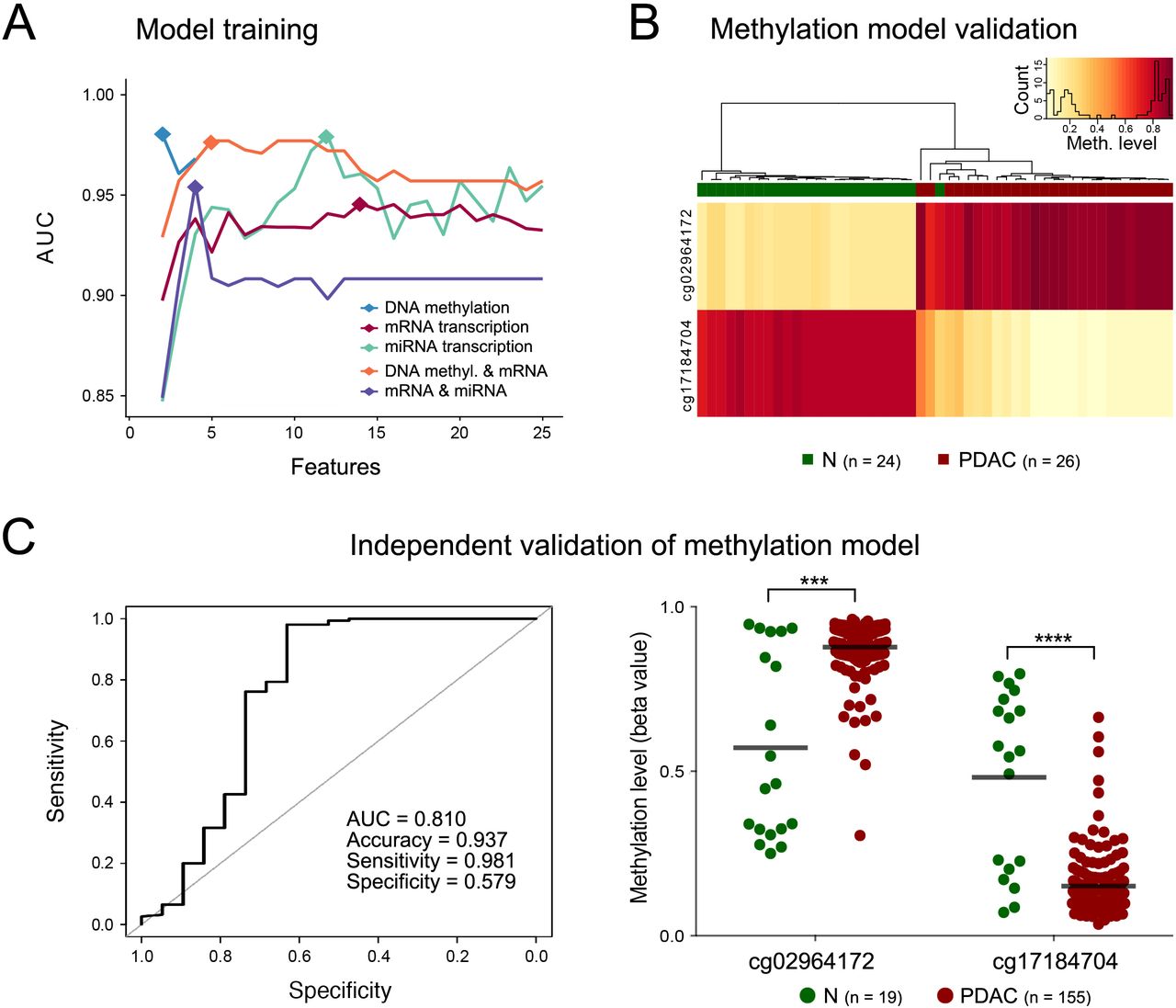
评估PDAC和N样本的机器学习性能
综上所述,已确定的DNA甲基化特征可能会显著提高疑似胰腺癌患者的肿瘤诊断质量。然而,在临床应用方面,仍然需要满足两个要点。除了测序之外,存在其他分析平台,可以产生良好的结果。然而,本文分析需要全基因组亚硫酸盐测序,因为需要对感兴趣区域进行PCR扩增的过程表现不佳。
最有可能的是,这是由于一系列限制因素:可以从PDAC患者的血液样本中分离出的cfDNA副本数量非常少;亚硫酸盐治疗进一步打破了已经支离破碎的cfDNA;最后,代表一个CpG岛,感兴趣的DNA在亚硫酸盐转换后富含A:T,在基于PCR的扩增方面没有产生良好的结果。替代放大过程可以克服这个问题,或者亚硫酸盐测序可以进一步自动化,从而变得足够便宜,可以进行常规诊断。其次,只有在对更大的患者队列和临床试验的结果进行成功的多中心评估后,才能实现向临床常规的转换。
结果增加了越来越多的证据,表明,与其更稳定的遗传因素或更复杂的调控转录变异相比,其表观遗传性质的DNA甲基化可能更适合作为疾病特异性标记。用于选择生物标志物的机器学习算法可以应用于许多其他疾病,这些疾病有相关数据。
原始出处
Wu Y, Seufert I, Al-Shaheri FN, et al DNA-methylation signature accurately differentiates pancreatic cancer from chronic pancreatitis in tissue and plasma Gut Published Online First: 14 September 2023. doi: 10.1136/gutjnl-2023-330155


