四川大学华西口腔医学院林云锋教授团队《Adv Sci》:RNAi经皮免疫——基于多酚介导的框架核酸治疗银屑病
时间:2023-10-09 23:23:13 热度:37.1℃ 作者:网络
【银屑病和皮肤免疫紊乱】
皮肤是宿主免疫防御的重要组成部分,是抵御外部威胁的第一道防线。真皮免疫系统的功能障碍及其作为屏障的作用是常见的慢性炎症性疾病的基础,例如银屑病和特应性皮炎(AD)。银屑病可引起剧烈疼痛、毁容和残疾,影响世界约2-3%的人口。银屑病是过度增殖性角质形成细胞(KCs)和免疫细胞相互作用的结果。目前还没有药物可以完全治愈银屑病。传统的局部治疗和口服药物,如皮质类固醇和甲氨蝶呤(MTX),疗效有限,肝肾毒性严重,甚至致畸。在一些针对免疫系统的生物疗法研究中,发现白细胞介素(IL)−17、肿瘤坏死因子(TNF)-α和IL-23在银屑病的病理机制中比其他细胞因子更关键。TNF-α和IL-23/IL17的生物抑制剂近年来也成为相对有效的一线干预措施。同时阻断TNF-α和IL-17可能比阻断单个靶标更有效。核因子κ-B(NF-κB)是TNF-α和IL-17A的直接转录激活剂。因此,选择NF-κB作为治疗靶点,阻断银屑病的炎症周期,可以使患者受益最大化。然而,生物制剂的开发受到高成本和免疫原性的限制,有限的注射递送方法为宿主带来了严重感染的风险。

近期,四川大学林云锋教授团队在Advanced Science杂志在线发表了题为“Transcutaneous Immunotherapy for RNAi: A Cascade-Responsive Decomposable Nanocomplex Based on Polyphenol-Mediated Framework Nucleic Acid in Psoriasis”的工作。该研究通过构建pH响应性的复合材料STT,可以智能地装载和卸载siRNA以治疗银屑病。STT特异性地沉默和抑制NF-κB信号的传递并抑制DC的成熟,从而影响关键细胞因子TNF-α和IL-23 / IL-17表达的变化,最终减少角质形成细胞KCs的增殖。STT治疗牛皮癣基本上涉及皮肤的先天性和后天免疫,在维持皮肤的免疫稳态方面起着强大的作用。
RNA干扰(RNAi)疗法优于传统疗法,但快速降解和细胞摄取不良是其临床转化的最大障碍。siRNA的透皮递送和纳米药物递送系统的可控组装/拆卸可以最大限度地提高治疗效果。四面体骨架核酸(tFNA)由于其优异的无创透皮作用和可编辑性,无疑是基因透皮转运的最佳载体。作者将酸反应性单宁酸(TA),RNase H响应序列,siRNA和tFNA结合成一种新型透皮RNAi药物,具有可控的组装和拆卸:STT。STT 对酶、血清和溶酶体降解具有更高的抗性,其大小与 tFNA 相似,便于透皮运输。透皮给药后,STT能特异性地沉默核因子κ-B(NF-κB)p 65,从而维持皮肤微环境的稳定性,重塑正常的皮肤免疫防御。这项工作证明了STT在RNAi治疗中的优势以及未来治疗皮肤相关疾病的潜力。
【文章概要】
在这项研究中, 合成的STT由内部siRNA-tFNA(ST)和外部TA组成。为了使纳米载体能够自由组装和卸载siRNA,使用DNA\ RNA杂交序列来响应细胞质中的RNase H。作者合成并验证了STT。TA和核酸之间的氢键和π-π堆叠可以驱动它们的结合。并且由于TA的包绕,使得合成的STT在尺寸上近似于tFNA。并且tFNA的搭载使得STT拥有良好的血清稳定性(图1)。
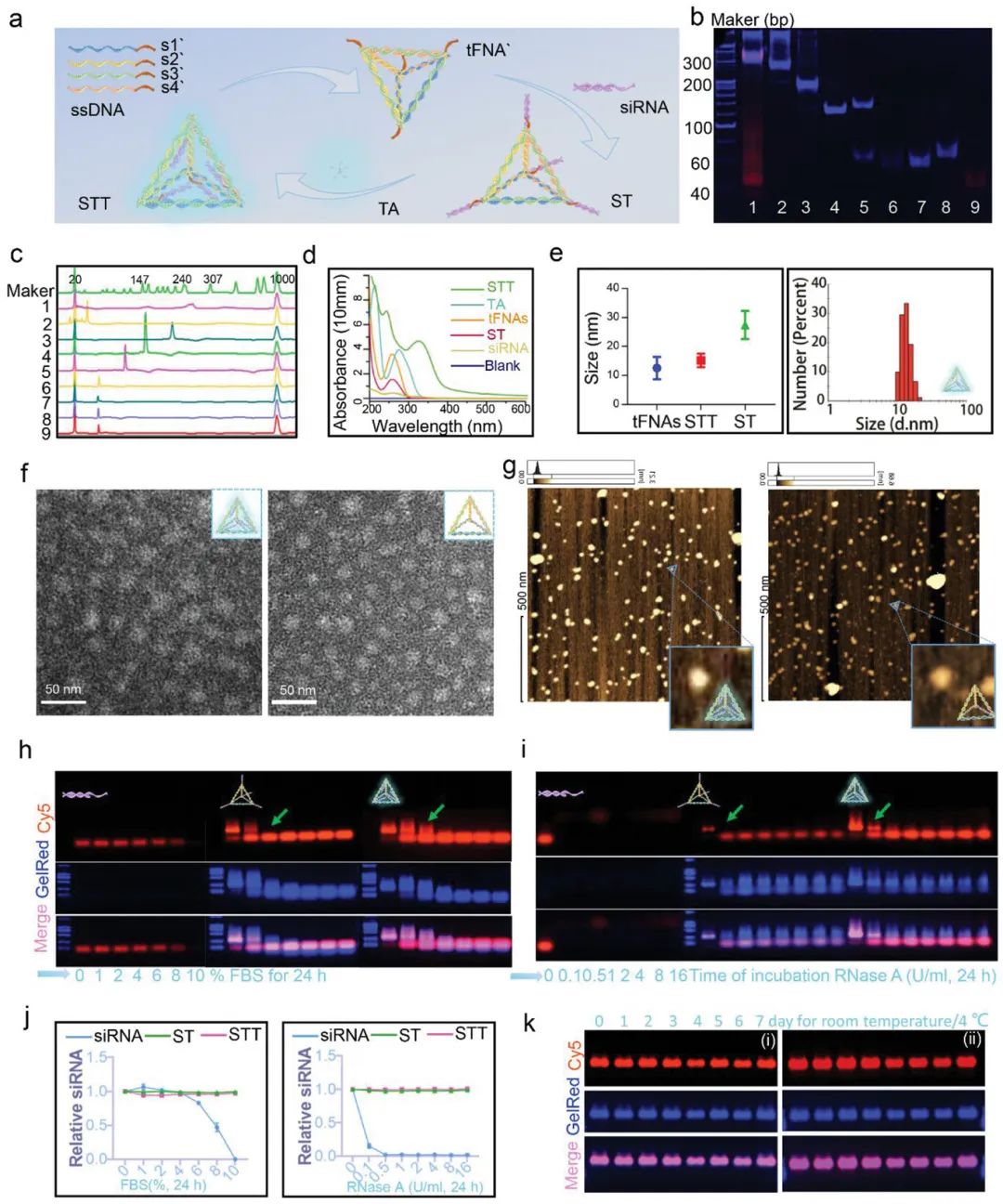
图1. STT的合成、表征和稳定性。
STT能够发挥关键作用的前提是能够通过透皮作用进入组织并且被KCs和DC摄取。并且,透皮基因递送的另一个困难是基因递送,涉及通过内吞作用进入细胞,货物通常被递送到低pH内体或溶酶体中发生降解。而pH响应分解是溶酶体逃逸的基础。该部分实验验证表明STT具有纳米透皮药物智能可控上卸的优势。STT可以被认为是一种稳定、高效、智能的siRNA透皮递送系统,可以快速穿透DC、HaCaT和皮肤组织,避免了传统siRNA递送的缺点。
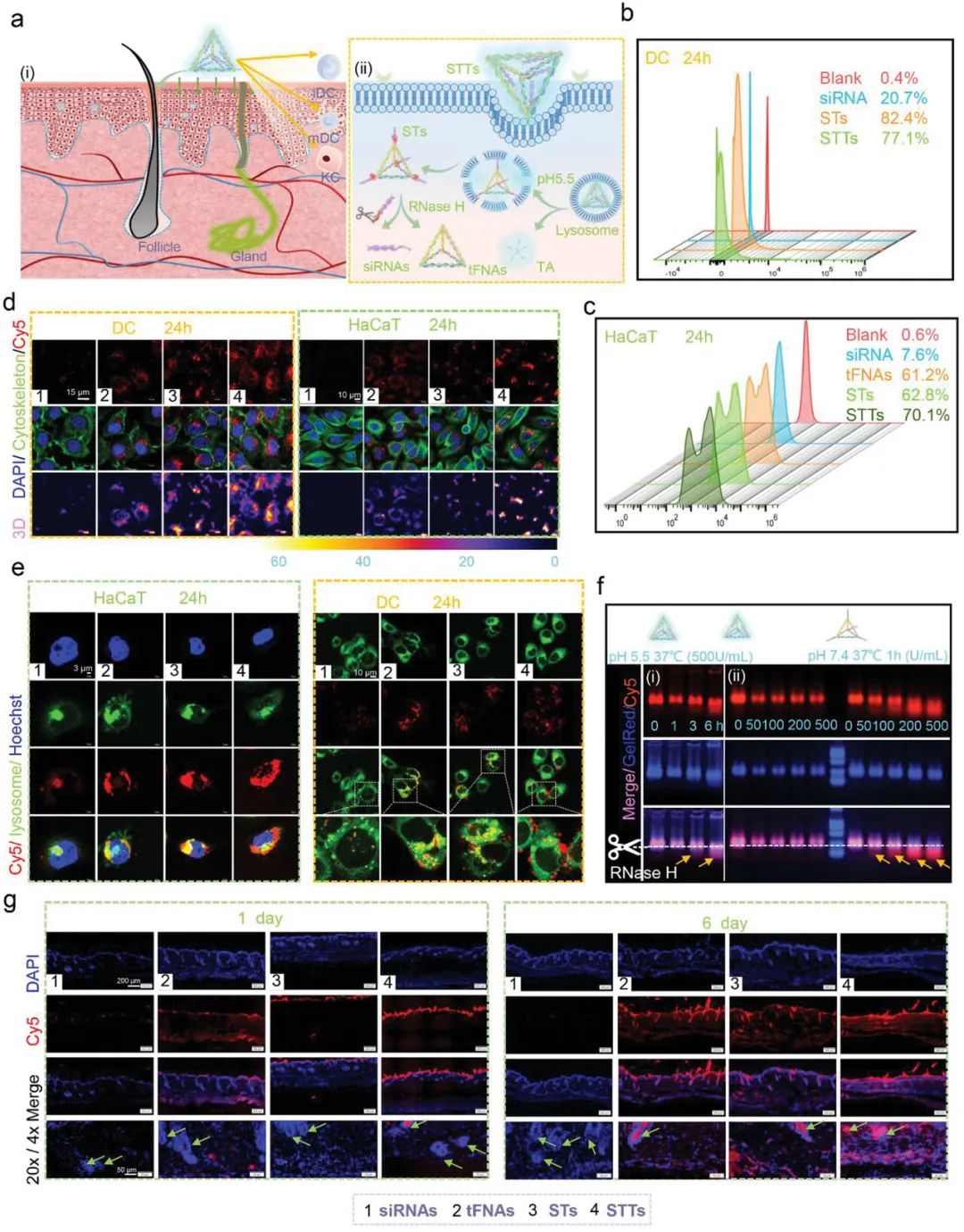
图2. STT的透皮递送和反应性分解。
KCs是人银屑病TNF信号转导的直接和关键靶标。抗肿瘤坏死因子治疗也是治疗银屑病最有效的方法之一。抑制NF-κB可以成功地干扰TNF-TNFR的信号转导,从而改变皮肤炎症。许多银屑病相关基因也与TNF-NF-κB信号转导途径有关。基于他们的研究,STT通过溶酶体逃逸和TA的协同抗炎作用,对NF-κB p65的沉默作用比ST更突出,从而抑制IL-1β、IL-6和TNF-α的表达。STT是通过控制HaCaT的炎症表达来阻断HaCaTs随后传递到DC的炎症信号的先决条件,这有助于避免DC分化和炎症放大(图3)。
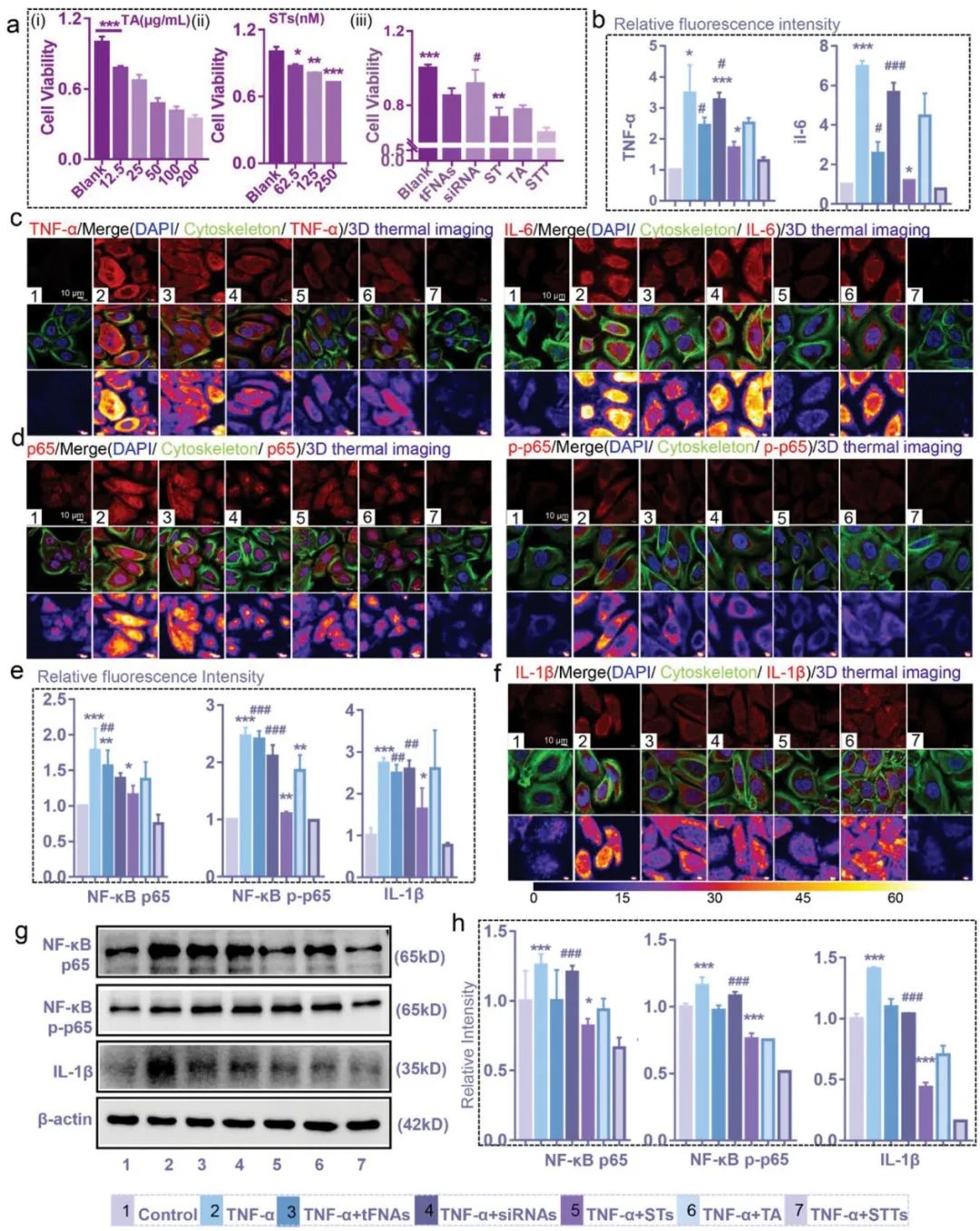
图3. STTs通过抑制NF-κB p65来减少TNF-α诱导的HaCaTs炎症。
在银屑病皮肤的炎症微环境中,免疫刺激DC的激活非常普遍。作为最强的抗原呈递细胞,DC在银屑病的进展中起着重要作用,特别是在先天免疫系统中。成熟髓系DC通过分泌共刺激分子CD80和CD86激活T细胞参与先天免疫,并通过分泌IL-12、IL-23和TNF-α来促进KCs的过度增殖。STTs治疗导致先天免疫DC分泌的IL-1β,IL-12,IL-6和TNF-α减少,这是通过沉默和降低NF-κB p65的表达来实现的。
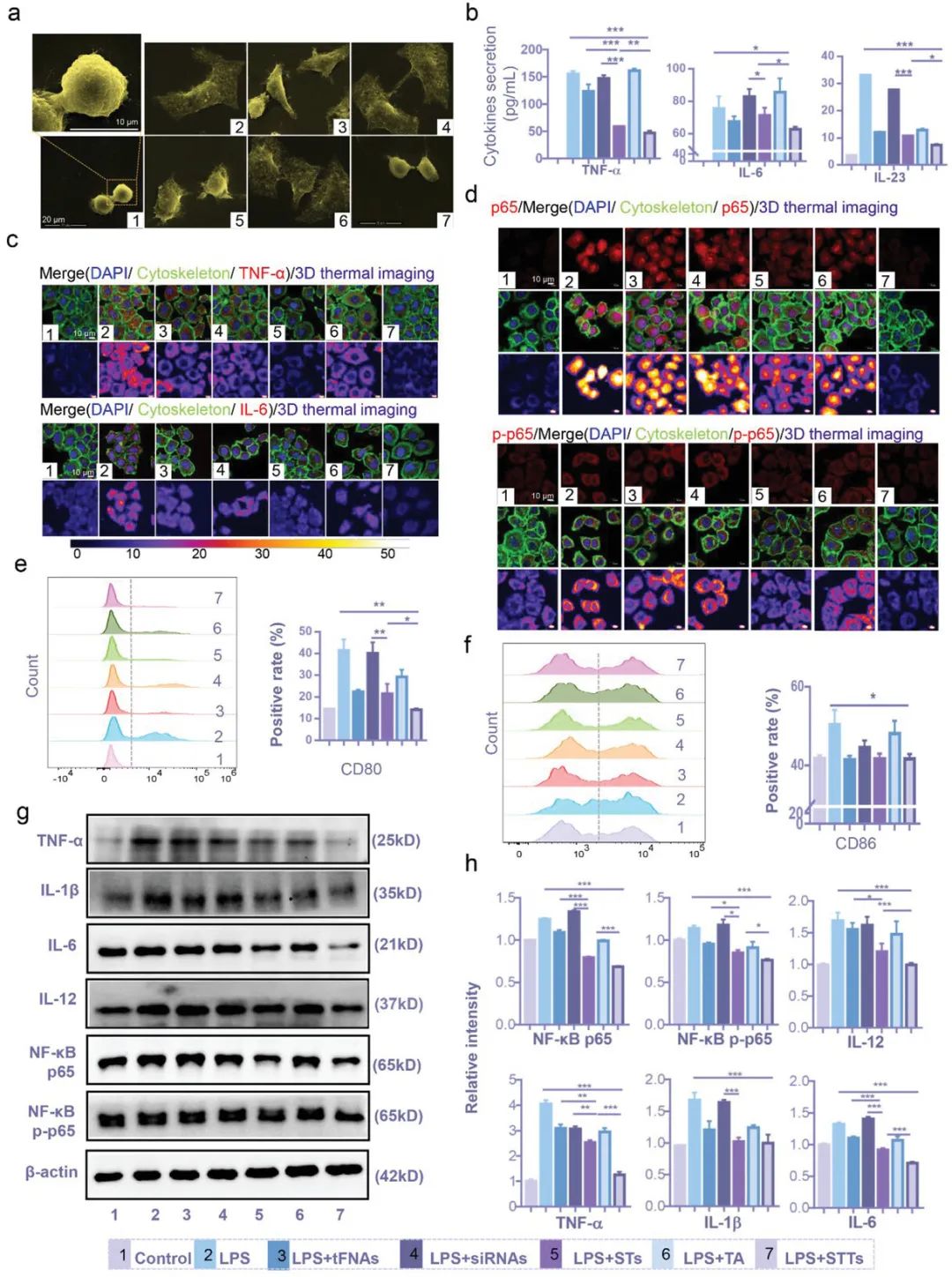
图4. STT通过抑制NF-κB的表达来减少DC的炎症和成熟。
银屑病是一种复发性和无法治愈的皮肤病,需要长期治疗,局部治疗是首选。利用咪喹莫特(IMQ)诱导的小鼠银屑病探讨STTs是否可以通过抑制NF-κB p65的表达来改变银屑病的炎症微环境。由IMQ引起的皮肤炎症通常在第4-5天达到高峰,高度炎症状态在6-7天内持续。银屑病的主要病理表现是KCs的过度增殖。表皮KCs的激活在皮肤炎症(如银屑病和AD)的发生,发展和调节中是必不可少的。用抗Ki67对表皮进行免疫组织化学(IHC)染色以分析KC增殖。当NF-κB p65被阻断时,ST组和STT组观察到KCs的增殖活性显着降低,并且STT的影响比ST更深(图5)。
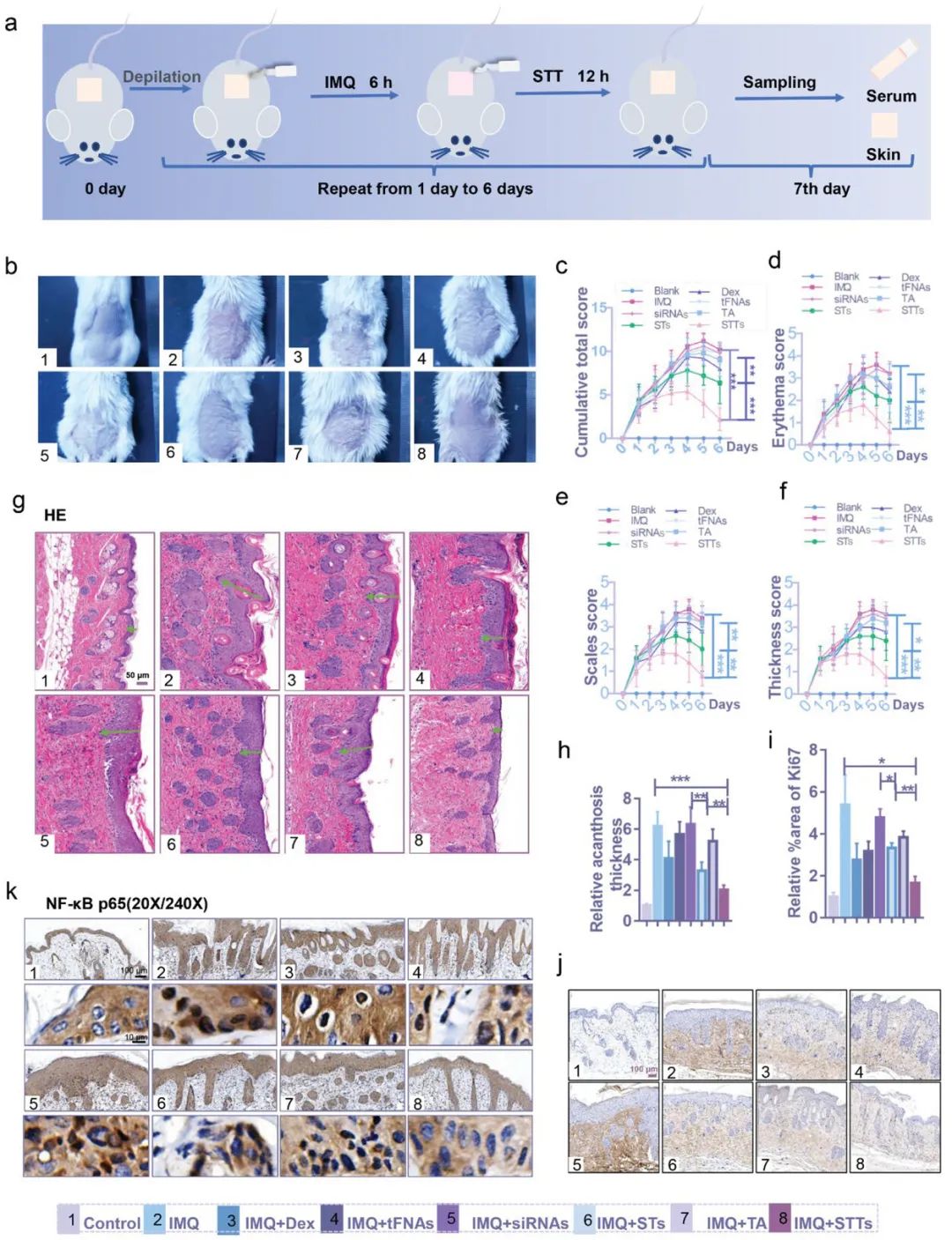
图5. STTs对IMQ诱导的小鼠银屑病的治疗作用。
STTs治疗银屑病的机制是沉默NF-κB p65基因,影响其转录并最终导致NF-κB p65蛋白降解。体外研究证实,STTs可以成功抑制DC和HaCaT中的NF-κB p65信号传导。IMQ对KCs的刺激导致KCs产生大量的TNF-α和IL-1β,TNF-α参与激活NF-κB信号通路,导致DC分泌更多的炎症因子,尤其是TNF-α和IL-23。IL-23激活下游Th17细胞分泌IL-17,IL-65又作用于KCs导致异常增殖。STT通过沉默和抑制NF-κB p65蛋白的表达来中断最初由TNF-α引起的炎症轴的传递,最终降低致病性细胞因子的水平(图6和图7)。
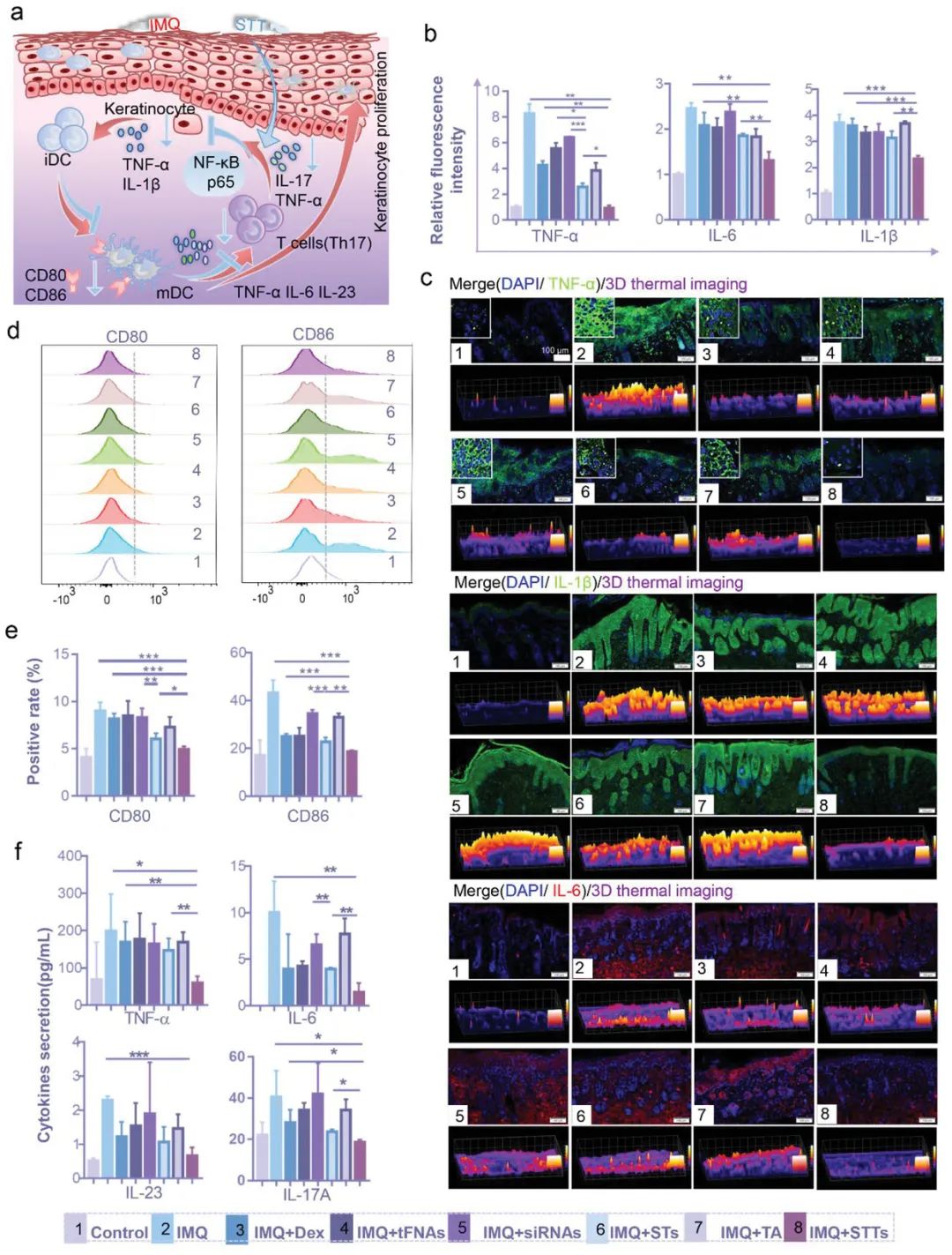
图6. STT治疗IMQ的机制。
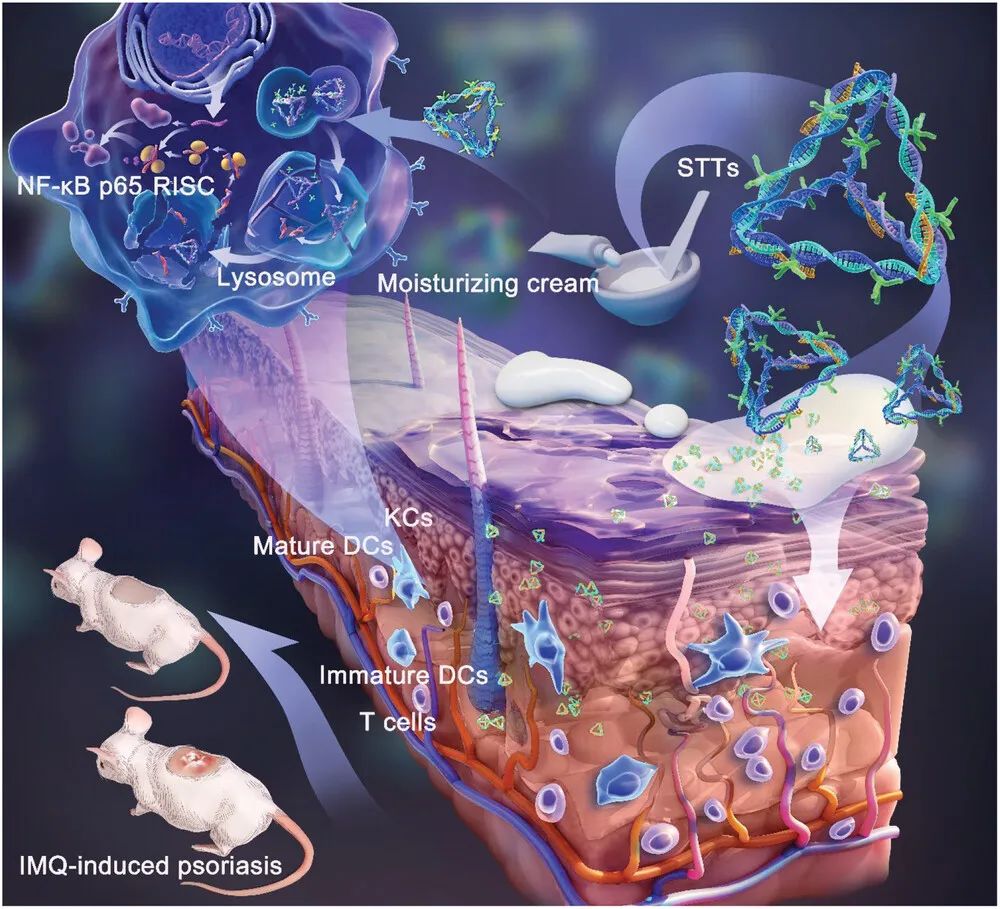
图6. STT的级联反应分解及沉默NF-κB p65对银屑病进行经皮免疫治疗。
【结论与展望】
透皮基因疗法对于由皮肤屏障破坏和免疫紊乱引起的疾病非常有前途。作者最后介绍道,作为一种透皮RNAi药物,STT不仅具有良好的透皮和细胞摄取效率,而且确保了siRNA递送过程中的稳定性。STT特异性地沉默和抑制NF-κB信号的传递并抑制DC的成熟,从而影响关键细胞因子TNF-α和IL-23 / IL-17表达的变化,最终减少KCs的增殖。STT治疗牛皮癣基本上涉及皮肤的先天性和后天免疫力,在维持皮肤的免疫稳态方面起着强大的作用。STT的出现为疫苗接种、伤口愈合以及皮肤癌和其他皮肤病的治疗提供了新的前景。
四川大学华西口腔医学院林云锋教授为该论文的通讯作者,四川大学华西口腔医学院博士研究生张梅为该论文第一作者,该研究得到了国家自然科学基金等项目的支持。
原文链接:
https://doi.org/10.1002/advs.202303706


