Oncogene: 一文说透环状RNA在癌症中的现状和未来
时间:2023-10-22 23:33:19 热度:37.1℃ 作者:网络
近日,来自美英两国的研究团队在杂志Oncogene上发表了一篇题为“Going circular: history, present, and future of circRNAs in cancer”的文章。环状单链CircRNAs是一种多功能分子,由于它们固有的稳定性和对核糖核酸酶的抗性,可在癌症诊断、治疗和预防中的应用中作为诊断和预后生物标志物。然而,它们的圆形形状限制了它们的注释,并且缺乏完整的功能说明,这使得它们的检测和生物医学应用仍然具有挑战性。在此,作者回顾了circRNA的生物发生和功能,以及它们在肿瘤发生中的作用和在癌症靶向治疗中的潜在效用。

图片来源:Oncogene
环状RNA在正常和病理环境中的生物发生
circRNA是由pre-mRNA的反向剪接产生的,内含子下游5'剪接位点与上游3'剪接位点连接,形成一个封闭的连续的头对尾分子,称为环状RNA(circRNA)。由此产生的分子没有末端5 'cap和3 'polyA尾巴,外切酶不易接近,因此比线性RNA更稳定。
不同种类的circRNA也可以在包括癌症在内的病理环境中产生(如下图)。例如,转录终止失败和转录进入下游基因后的反向剪接会产生read-through circRNAs (rt-circRNAs),可能与病理表型有关。融合环状RNA (f-circRNAs)起源于癌症相关的染色体易位,能够赋予细胞抵抗凋亡诱导药物治疗的能力,促进细胞转化和细胞存活。
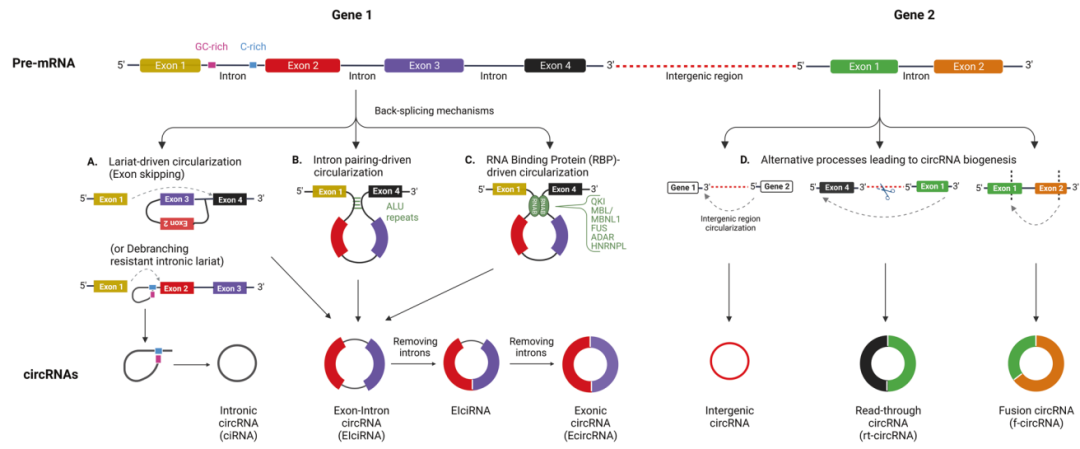
导致环状RNA生物发生的机制。图片来源:Oncogene
CircRNAs的生物学功能和作用机制
CircRNAs作为转录调控因子 circRNAs可通过单独或与RBP联合作为亲本基因的转录调节因子。研究发现它们要么上调特定转录因子的表达并激活其亲本基因的转录,要么通过形成RNA-DNA杂交(R-loops),导致过早转录终止,上调无活性的异构体。CircRNAs还可以诱导启动子CpG去甲基化,上调其亲本基因的活性。主要位于细胞核内的环状RNA,如EIciRNAs,可以通过RNA-RNA碱基配对U1 snRNP,然后在亲本基因启动子处与RNA聚合酶II相互作用,从而增强其表达。
CircRNAs作为miRNA海绵 环状RNA(circRNA)包括多个miRNA结合位点,可特异性吸附miRNA,发挥竞争性内源性RNA (ceRNAs)的作用,将miRNA与靶mRNA“隔离”,从而影响miRNA对靶mRNA的负调控。比如在癌症中circHIPK3通过吸附多种miRNA(如肿瘤抑制因子miR-124)来调节细胞生长,而circITCH作为癌症抑制因子,通过吸附多种miRNA(包括miR-7、miR-17和miR-214)来抑制食道鳞状细胞癌(ESCC)中的Wnt/β-catenin通路。
CircRNAs作为RNA稳定性的调节剂 circRNAs可以影响其他RNA分子的稳定性,包括lncRNAs和mRNA。比如通过形成RNA duplex来稳定其同源mRNA,或通过募集蛋白质,其相互作用增加了mRNA的稳定性和/或翻译,例如circXPO1通过募集IGF2BP1增强CTNNB1 mRNA的稳定性来促进肺腺癌(LUAD)的进展。
circRNA作为RBP调节因子 circRNAs不仅参与反向剪接和基因转录调控,还能够与RBP结合,指导其细胞定位。例如,在乳腺癌中一个显著的肿瘤抑制例子是circFOXO3,它同时结合p53和E3泛素连接酶MDM2,促进了P53的降解,同时阻止了源自其亲本基因的促凋亡Foxo3的降解。
作为翻译多肽的circRNA 尽管大多数circRNA被认为是非编码的,但有一小部分circRNA通过不基于Cap的机制具有翻译能力,生成了具有一定功能的肽段。与癌症相关的已翻译环状RNA的例子包括SHPRH基因的环状形式(circSHPRH),它编码SHPRH-146aa的蛋白质,可能是肿瘤抑制因子。circE-Cad在CDH1基因上编码的E-cadherin变体引起促进肿瘤的作用,该变体通过与EGFR相互作用并激活下游STAT3信号通路,参与维持胶质母细胞瘤的癌性。
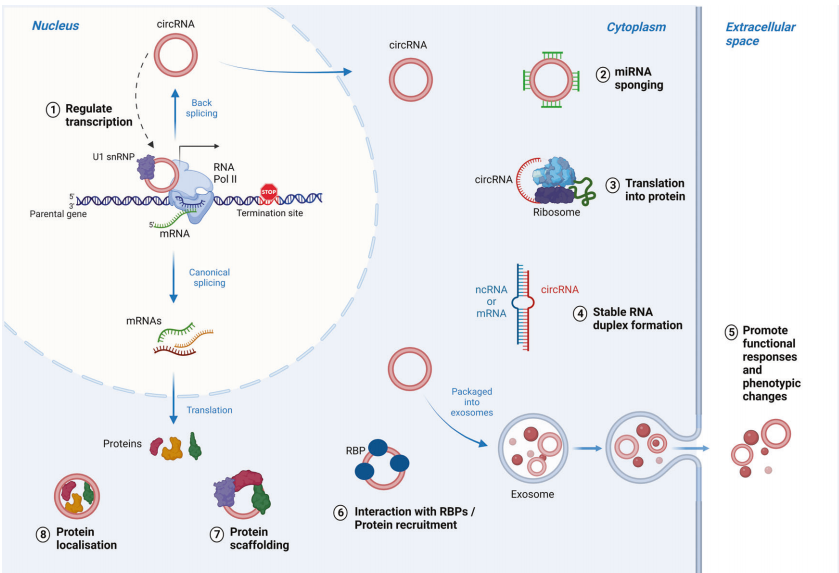
CircRNA的生物功能。图片来源:Oncogene
环状RNA的检测和表征:挑战和策略
CircRNA的检测方法 检测环状RNA面临挑战,因为其环状构象和序列与线性mRNA对应物重叠。高通量测序技术(例如RNA-seq),可采用去除rRNA的文库的制备和随机引物合成cDNA,增强包含环状RNA的大型非聚腺苷化转录本的注释。传统的方法,如RT-qPCR以及Northern blotting也可以帮助区分单个环状RNA和线性对应物,然而受到低灵敏度、低通量和复杂步骤的限制。microarray也被用作合适的筛选工具,但这种方法有时会导致线性RNA的错误检测。环状RNA的鉴定和定量需要特别设计的生物信息学管道。算法灵敏度和精度的差异可能导致对circRNA的低估和不完整的注释。
一些研究使用RNA荧光原位杂交(RNA-FISH)对circRNA进行定量和定位,也被用于证实circRNA和靶miRNA的共定位,然而,探针设计通常具有挑战性,整体技术耗时且昂贵。最近发展的RT-ddPCR可提供绝对拷贝数和检测低丰度环状RNA的能力,已经成功地用于分析血浆中的circRNA水平。特别适合分析环状RNA的是滚环扩增(RCA)方法,可产生由数百个重复片段组成的长链单链cDNA,从而放大了信号。
circRNA功能表征方法 同一基因组位点转录的circRNA和线性RNA通常是共表达的,这使得功能获得和功能缺失的研究具有挑战性。通过设计引导RNA, CRISPR-Cas13可以敲低环状RNA,而不会对相关的线性mRNA产生任何影响。基于表达载体的策略,通过在内含子两侧设计重复序列可驱动环状而非线性外显子,在研究新的circRNA功能方面具有巨大的优势。尖端的方法,如新的牛津纳米孔技术,特别适合于长读测序;NanoString平台可更准确定量单个环状RNA,无需扩增或逆转录。
CircRNA作为生物标志物
CircRNAs作为预后生物标志物 CiRS-7/CDR1as被广泛用作结肠癌、肺癌和乳腺癌的预后因子。circERBB2也有很强的预测胃癌预后的潜力,其在胃癌术前患者血浆中的水平与淋巴结转移的发生显著相关。致癌的cirUBAP2通过与不同miRNA的海绵作用和HCC、乳腺癌和骨肉瘤的不良预后相关。CircRNA panel比单个CircRNA更具有预后价值。对术后收集的冷冻组织进行RNA-seq分析,可以通过四个基于circRNA的特征(称为circScores)根据复发风险的高低对结肠癌患者进行分组。
CircRNAs作为诊断性生物标志物 一组研究人员开发了一种独特的circRNA检测方法,可以检测尿源性细胞外囊泡中的5种circRNA,具有区分高级别前列腺癌和良性前列腺增生的潜力。CircRNA表达谱也有助于将乳腺癌亚型分为HER2阳性、雌激素受体阳性和三阴性乳腺癌。同样,通过检测circACVR2A和circCCNB1表达水平,可以区分非小细胞肺癌中的腺癌和鳞状细胞癌。血清中富集的外泌体衍生的circHIPK3和circSMARCA5的下调水平,可以对多形性胶质母细胞瘤进行早期诊断。
CircRNAs作为预后和诊断生物标志物 一些circRNA可以作为预后和诊断生物标志物提供双重效用。例如,circ0001785不仅在乳腺癌检测中比癌胚抗原(CEA)和癌抗原15-3 (CA15-3)具有更高的诊断效率,而且在预测乳腺癌进展中的组织学分级、TNM分期和远处转移方面具有很强的预后潜力。同样,circLDLRAD3也被认为是胰腺癌诊断和预后的一个有前景的生物标志物,因为它在患者血浆中被发现升高,并且与静脉和淋巴浸润密切相关。
CircRNAs作为癌症治疗的预测性生物标志物 CircRNA表达已被证明对化疗、放疗和免疫治疗的反应中发生变化。例如,circCRIM1与miR-422a竞争性结合,阻止其对FOXQ1的抑制作用,最终导致鼻咽癌转移、EMT和多西他赛化疗耐药。在子宫内膜癌中,对紫杉醇的耐药性是由一个关键的致癌circ0007534介导的,该circRNA吸收miR-625,随后增加其靶基因ZEB2的表达,ZEB2是EMT的主要调节因子。外泌体circZNF91介导胰腺癌缺氧和常氧肿瘤细胞之间的信号传递,并促进化疗耐药。类似地,外泌体相关的circ0032821通过miR-515-5p调节SOX9促进胃癌(GC)细胞对奥沙利铂的耐药。
对免疫检查点抑制剂(ICIs)的耐药性的发展是使用新型抗PD -1和抗PD - L1治疗癌症的主要限制之一。在非小细胞肺癌中,circFGFR1通过与miR-381-3p相互作用并上调其靶CXCR4诱导PD-1抗体的耐药。另一种抗PD -1耐药相关的circRNA是cirUHRF1,它由HCC细胞通过外泌体分泌到周围微环境中,并通过隔离和阻止miR-449c-5p与检查点靶基因TIM-3结合,引发自然杀伤细胞(NK)功能障碍、免疫逃避和抗PD -1免疫治疗的抵抗。
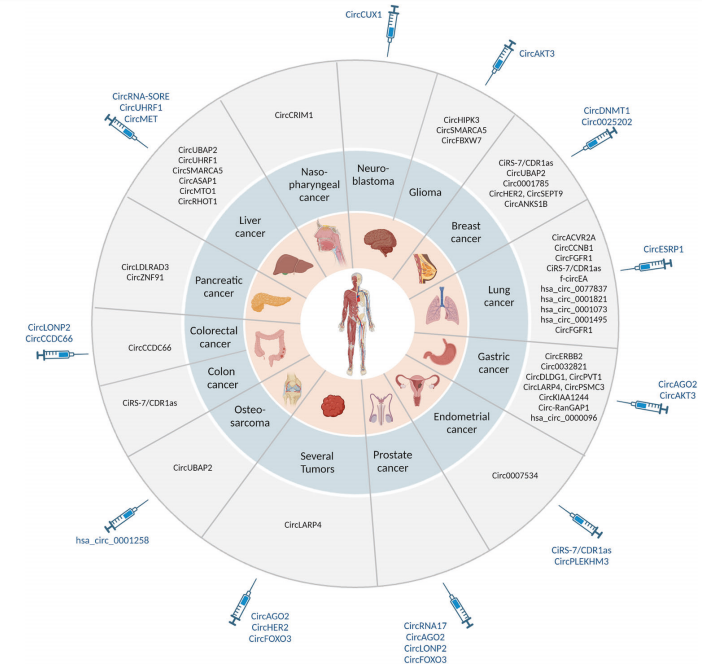
CircRNA作为人类癌症的生物标记物和治疗靶点。
图片来源:Oncogene
circRNA的治疗应用
基于circRNA敲低的治疗应用 递送siRNA或shRNAs完成的RNA干扰(RNAi)已被用于在体内沉默单个或多个环状RNA。例如,针对circCUX1的shRNA治疗已被证明可有效降低小鼠肿瘤生长,circCUX1是一种在神经母细胞瘤(NB)中普遍过表达的circRNA,能够通过吸附miR-16-5p促进细胞增殖和侵袭。单链DNA反义寡核苷酸(AONs)也被用于选择性地抑制或降解致癌环状RNA。例如,靶向circLONP2的AONs可显著降低直肠癌细胞体内的转移,circLONP2通过促进miR-7的成熟和外泌体传播来增强侵袭性。金纳米颗粒(AuNPs)通常可与siRNA、shRNA或AON偶联,可以更好地完成RNAi分子的递送。
基于circRNA过表达的治疗应用 CircRNA可通过直接递送到细胞中来增加其水平,通过利用环状RNA在拮抗致癌miRNA方面特别有效。circRNA的递送可以通过脂质和/或聚合物纳米颗粒的封装来实现。一组研究人员利用AuNPs质粒靶向癌细胞,异位过表达circFoxo3,并证明circFoxo3触发应激诱导的细胞凋亡,抑制肿瘤异种移植物在体内的生长,提高总生存率。
耐药相关的治疗策略 针对与癌症治疗耐药相关环状RNA治疗策略也被研究以克服治疗失败。circRNA-SORE可干扰酪氨酸激酶抑制剂的活性,如索拉非尼。通过使用靶向circRNA-SORE的siRNA治疗皮下耐受索拉非尼的患者来源异种移植物小鼠,可以恢复对索拉非尼治疗的反应性。过表达circ0025202可抑制肿瘤生长,增强他莫昔芬的疗效。在体内移植了恩杂鲁胺耐药细胞的小鼠模型中,CircRNA17过表达已被证明可以恢复对恩杂鲁胺的敏感性,用于前列腺癌的治疗。通过shRNA抑制circUHRF1可以调节抗pd -1治疗的反应,并提高总生存率。西格列汀可以消除circMET诱导的耐药作用,和抗PD -1分子联合使用已被证明可提高免疫功能正常小鼠的抗肿瘤免疫,并且可能更有效地治疗HCC患者。
在特异性环状RNA被有效地利用为临床有用的生物标志物或癌症治疗的治疗靶点之前,还需要进一步的研究。目前正在进行的研究正在评估将circRNA生物学引入临床实践对癌症患者的潜在治疗益处(如下表)。
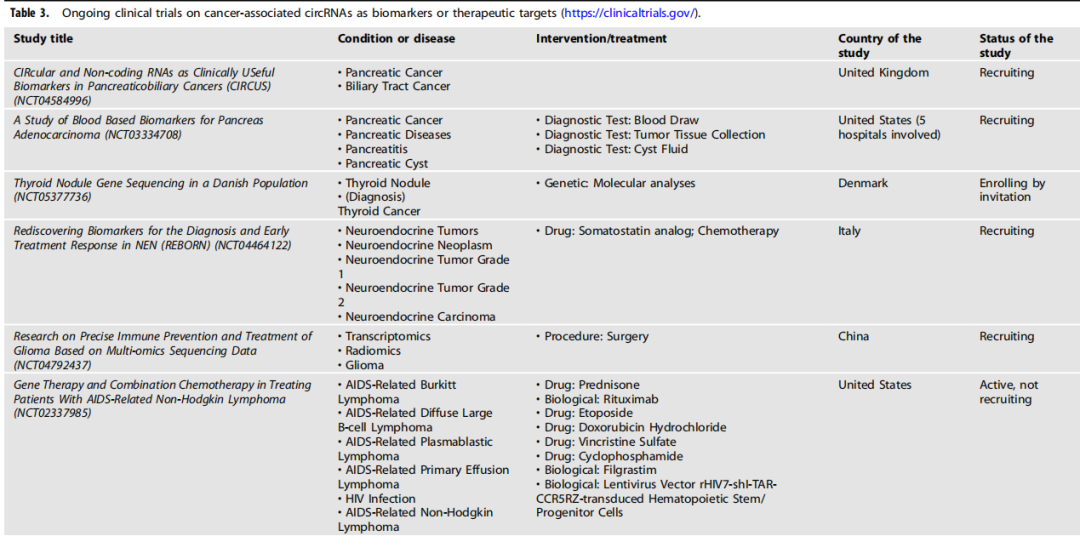
circRNA作为生物标志物或治疗靶点的临床试验。
图片来源:Oncogene
总结和讨论
随着测序方法在深度、准确性和读取长度方面的提高,新的未表征环状RNA,特别是低丰度环状RNA的注释会继续增长。从临床角度来看,circRNA研究的出现为癌症研究开辟了新的可能性。CircRNAs与多种生理条件和细胞生物学特征相关,包括干细胞和多能性。它们作为早期癌症检测、诊断、预后甚至治疗反应预测的有效生物标志物具有潜在的效用。在许多组织和疾病中,CircRNAs通常参与不止一种分子机制;在治疗上靶向环状RNA可能会导致非癌细胞和组织中的脱靶效应。此外,在不同的癌症类型中发现了由相同环状RNA吸附的多个miRNA,表明它们对特定癌症表型的贡献可能与环境有关。测量细胞和组织中正确的拷贝数和circRNA/miRNA比率仍然是研究circRNA的基础,也是了解它们在正常发育和疾病中如何发挥作用的必要步骤。
基于人工智能的新方法可能有助于识别circRNA特征中的共享和独特特征,例如表达水平、可变剪接模式、共表达网络或特定结构基序。然而这将依赖于高质量的数据生成、仔细的实验设计和严格的计算分析,circRNA的特性和功能仍然没有完全阐明。
综上所述,circRNA在癌症诊断和治疗方面无疑具有巨大的潜力。circRNA的初步研究必然集中在它们的发现和表征上;在不久的将来,需要在临床研究的背景下对患者样本进行更详细的生物学验证。


