病理干货 | 甲状腺结节诊断的分子病理
时间:2023-10-31 14:28:30 热度:37.1℃ 作者:网络
甲状腺肿瘤是内分泌系统最常见的肿瘤之一,近年来我国甲状腺癌发病人数以每年20%的速度持续增长,成为全国发病率第 7 位的癌种。甲状腺结节患者女性多于男性,一般人群通过触诊的检出率为3%~7%。借助高分辨率超声的检出率可高达20%~76%[1],在中国成人中通过超声检查发现直径0.5 cm以上甲状腺结节的患病率达20.43%,其中8%~16%为恶性肿瘤。
01 甲状腺结节的筛查
甲状腺结节和分化型甲状腺癌诊治指南(第二版)[2]指出:推荐有下述情况之一的需要筛查甲状腺癌:童年时期头颈部放射线暴露、全身放射治疗史、一级亲属甲状腺癌家族史以及有甲状腺癌相关的遗传综合征家族史或个人史。
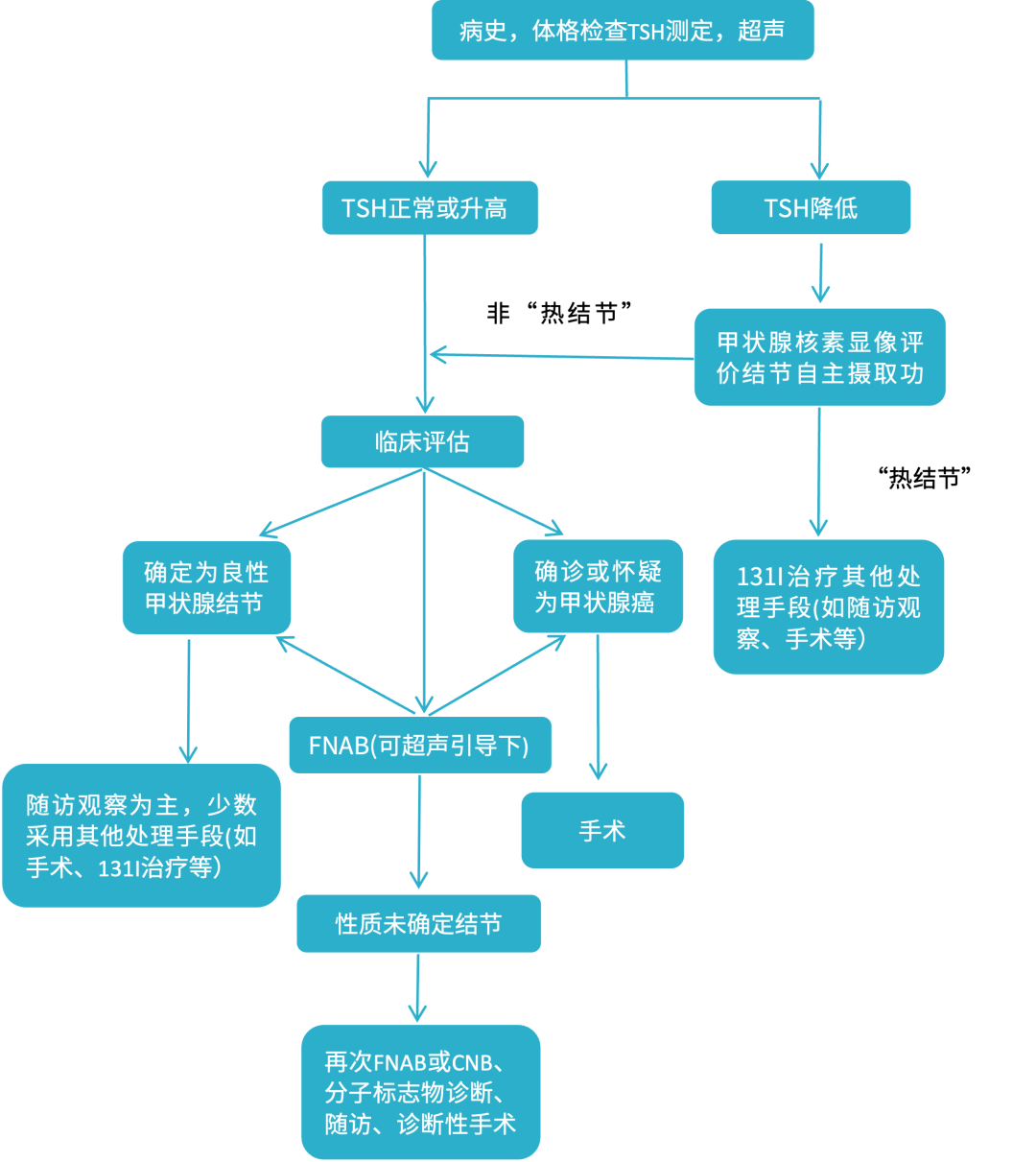
▲图1:甲状腺结节的临床评估和处理流程
02 甲状腺结节良恶性判断
甲状腺结节实验室检查一般包括促甲状腺激素(TSH)、游离甲状腺素(FT4)、游离三碘甲状腺原氨酸(FT3)、甲状腺球蛋白(Tg)、降钙素等,应对所有甲状腺结节患者进行实验室检查帮助明确甲状腺功能是否存在异常,但是实验室检查不能作为甲状腺结节良恶性的判断依据。高分辨率超声通过对结节进行超声评估可协助鉴别甲状腺结节的良恶性,并通过超声评估指标进行评分预测甲状腺结节恶性风险。超声引导下细针穿刺活检(fine needle aspiration,FNAB)细胞学诊断是评估甲状腺结节良恶性最重要和目前最常用的首选方法。
03 超声引导下细针穿刺(fine needle aspiration,FNAB)适应证
术前行FNAB 可有效提高甲状腺恶性肿瘤检出比例,避免不必要的手术。超声引导下FNAB适用于首诊可疑恶性的甲状腺结节、考虑复发、转移性甲状腺癌的术前明确诊断。FNAB的适应证(符合以下条件之一):
(1) C-TIRADS 3类的甲状腺结节,最大径≥2 cm。
(2) C-TIRADS 4A类的甲状腺结节,最大径≥1.5 cm。
(3) C-TIRADS 4B-5类的甲状腺结节,最大径≥1 cm。
(4)定期观察的甲状腺结节实性区域的体积增大50%以上或至少有2个径线增加超过20%(且最大径>0.2 cm)的患者。
(5)最大径<1 cm的C-TIRADS 4B-5类甲状腺结节若存在以下情况之一,需行FNAB:
-
①拟行手术或消融治疗前。
-
②可疑结节呈多灶性或紧邻被膜、气管、喉返神经等。
-
③伴颈部淋巴结可疑转移。
-
④伴血清降钙素水平异常升高。
-
⑤有甲状腺癌家族史或甲状腺癌综合征病史。
04 超声引导下细针穿刺(fine needle aspiration,FNAB)细胞学诊断
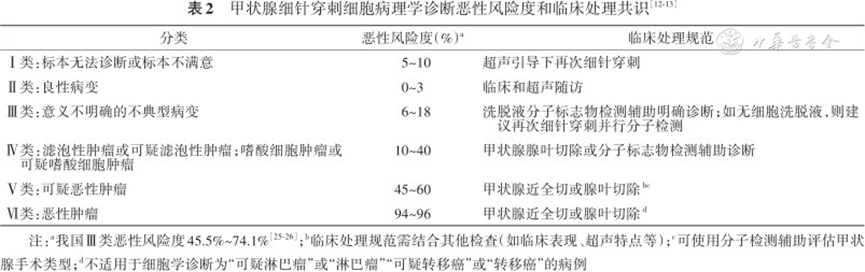
Bethesda诊断报告系统用于甲状腺细胞学诊断。甲状腺细针穿刺细胞病理学诊断专家共识(2023版)[3]对穿刺细胞病理学诊断分类进行修改,使其更符合中国临床情况(见表1)。甲状腺细针穿刺细胞病理学诊断共分六大类,其中Ⅲ类意义不明的不典型病变、Ⅳ类滤泡性肿瘤/可疑滤泡性肿瘤和Ⅴ类可疑恶性肿瘤因部分细胞形态重叠交叉,故准确评估该类病变的恶性风险具有挑战性(见表2)。有报道美国意义不明的不典型病变的恶性风险度评估为16.0%~37.8%,我国为45.5%~71.4%。分子病理检测有助于协助Ⅲ、Ⅳ和Ⅴ类病变明确诊断。

05 分子病理协助甲状腺结节良恶性诊断
中国甲状腺癌诊疗指南(2022版)[4]推荐,经FNAB不能确定良恶性的甲状腺结节(见表2),可对穿刺标本进行某些甲状腺癌的分子标记物检测,如 BRAF突变、RAS突变、RET/PTC重排等,有助于提高确诊率。
BRAF在甲状腺乳头状癌(papillary thyroid carcinoma,PTC)中突变率约为40%~90%,其中V600E最为常见。BRAF在甲状腺滤泡癌(Follicular thyroid carcinoma,FTC)中较少突变,在良性结节中罕见突变,因此,BRAF是PTC非常重要的肿瘤标志物。BRAF突变甲状腺结节恶性风险达到99.8%[5]。一项纳入9924个FNAB样本的meta分析证实,BRAF V600E突变诊断PTC的特异度为100%,灵敏度为69%[6]。另一项研究表明术前单纯 FNAB 的敏感性和准确性分别为76%和79%,如联合应用术前BRAF基因检测,可分别上升至92%和91%[7]。BRAF突变假阳性非常低,因此,FNAB细胞标本伴BRAF突变可以高度怀疑恶性结节。
RAS 基因家族与人类肿瘤相关的基因有三种—HRAS、KRAS 和 NRAS,RAS基因突变在滤泡亚型乳头状甲状腺癌(follicular variant papillary thyroid carcinoma, FVPTC)中突变率最高,但其在甲状腺良性结节中也有发现,因此,RAS不能作为结节良恶性诊断的靶标。但RAS突变可能和肿瘤的预后分级有临床相关性,所以可作为一种很有发展前景的诊断学标志。
10%~20% 的PTC存在RET基因重排/融合,RET和BRAF突变基本上是相互排斥的,且在 Bethesda Ⅲ类结节恶性诊断率为60%,无假阳性存在,故RET因重排/融合是PTC诊断特异性非常高的标志物。携带RET基因重排/融合的年轻甲状腺癌患者往往早期出现包膜外侵、淋巴结转移和远处转移,分期较高。甲状腺癌RET基因检测与临床应用专家共识(2021 版)[8]建议:PTC 中RET 基因可与多个伴侣基因发生重排/融合,其中CCDC6-RET 和 NCOA4-RET 是最为常见的形式,伴有RET基因重排/融合的PTC恶性程度更高,建议尽早积极外科手术治疗。
RET基因胚系突变是遗传性甲状腺髓样癌(Medullary thyroid carcinoma,MTC)(100%)形成、发展的基础.除甲状腺外,RET基因胚系突变导致的肿瘤还可累及肾上腺、甲状旁腺、皮肤等不同器官。而RET基因体细胞(60%~90%)突变见于散发性MTC [9],最常见的是密码子918位点突变。
TERT突变在分化型甲状腺癌中的发生率为0%~15%,在甲状腺低分化癌(Poorly differentiated thyroid carcinoma,PDTC)和未分化甲状腺癌(Anaplastic thyroid carcinoma,ATC)中为 40%~45%,而在良性结节中比较罕见。TERT 启动子突变在甲状腺癌诊断、失分化与转移等方面起重要作用,特别是与BRAF突变共存时,PTC侵袭性及复发风险显著增加,因此,TERT基因是甲状腺癌诊断和侵袭性评估的重要肿瘤标志物。
多基因检测在甲状腺结节良恶性判断、甲状腺癌手术方式、手术范围、靶向治疗、复发转移风险评估等方面起到重要作用。在国外,临床上应用基因 panel 评估甲状腺结节良恶性,目前比较成熟的 panel主要包括 BRAF、RAS、RET/PTC 和 PAX8/PPARγ 等基因[10]。2015 版美国甲状腺学会ATA 指南推荐基于不同临床应用目的选择合适的 panel,需关注分子检测的潜在作用和局限性。甲状腺癌基因检测与临床应用广东专家共识(2020 版)专家组意见9:应结合客观条件和诊治需要选择不同的基因panel检测。推荐检测可包括BRAF、KRAS、NRAS、HRAS、TERT、PIK3CA、TP53、RET、PAX8/PPARγ、AKT1、PTEN、CTNNB1、NTRK、ALK、EIF1AX 等具有重要临床意义的基因[9]。
06 总 结
我国甲状腺癌的发病率快速增长,国家癌症中心报告的2016年中国甲状腺癌的年龄标准化发病率分别为男性5.1/10万人年、女性15.8/10万人年。我国甲状腺癌5年生存率为84.3%,与美国(98.7%)等发达国家仍存在差距[11]。早诊断、早治疗可显著提高甲状腺癌患者生存期。超声引导下细针穿刺联合分子生物学检测对于发现早期微小病变至关重要。另外通过这些肿瘤标志物可对甲状腺癌侵袭程度等进行评估,帮助临床精准规范管理,为制定科学、个体化治疗方案提供重要的参考价值。
*本文(包括图片)仅供行业交流学习用,不作为医疗诊断依据。
参考文献
[1] Durante C , Crani G , Lamartina L, et al. The Diagnosis and Management of Thyroid Nodules: A Review[J]. JAMA, 2018, 319(9): 914-924. DOI:10.1001/jama.2018.0898.
[2] 中华医学会内分泌学分会,中华医学会外科学分会甲状腺及代谢外科学组,中国抗癌协会头颈肿瘤专业委员会等.甲状腺结节和分化型甲状腺癌诊治指南(第二版)[J],中华内分泌代谢杂志, 2023,3(39):181-226.
[3] 甲状腺细针穿刺细胞病理学诊断专家共识编写组,中华医学会病理学分会细胞病理学组. 甲状腺细针穿刺细胞病理学诊断专家共识(2023版))[J]. 中华病理学杂志, 2023, 52(5):441-446. DOI: 10.3760/cma.j.cn112151-20220916-00782.
[4] 中华人民共和国国家卫生健康委员会.甲状腺癌诊疗指南(2022年版).
[5] 广东省医学教育协会甲状腺专业委员会, 广东省基层医药学会细胞病理与分子诊断专业委员会. 甲状腺癌基因检测与临床应用广东专家共识(2020 版)[J/CD]. 中华普通外科学文献(电子版), 2020, 14(3): 161-168.
[6] Fnais N, Soobiah C, AI-Qahtani K, et al. Diagnostic value of fine needle aspiration BRAF (V600E) mutation analysis in papillary thyroid cancer: a systematic review and meta-analysis .Hum Pathol, 2015,46(10):1443-1445. DOI:10.1016/J.humpath. 2015.06.001.
[7] Zhao CK,Zheng JY,Sun LP,et al.BRAFV600E mutation analysis in fine-needle aspiration cytology specimens for Diagnosis of thyroid nodules :the influence of false-positive and false-negativeresults[J]. Cancer Med, 2019, 8(12): 5577 -5589.DOI:10.1002/cam4.2478
[8] 广东省医学教育协会甲状腺专业委员会,广东省基层医药学会细胞病理与分子诊断专业委员会.甲状腺癌RET基因检测与临床应用专家共识(2021版)[J/CD].中华普通外科学文献(电子版), 2022, 16(1): 1-8.DOI:10.3877/cma.j.issn.1674-0793.2022.01.001
[9] Drilon A, Hu ZI, Lai G, et al. Targeting RET-driven cancers: lessons from evolving preclinical and clinical landscapes[J]. Nat Rev Clin Oncol, 2018, 15(3): 151-167.
[10] Nikiforov YE, Ohori NP, Hodak SP, et al. Impact of mutational testing on the diagnosis and management of patients with cytologically indeterminate thyroid nodules: A prospective analysis of 1056 FNA samples[J]. J Clin Endocrinol Metab, 2011, 96(11): 3390-3397.
[11] 郑荣寿,孙可欣,张思维等. 2015年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志,2019,41(1):19-28.DOI:10.3760/cma.j.issn.0253-3766.2019.01.008.


