上海瑞金瞿介明教授/倪大龙教授/美国威斯康星大学蔡伟波教授《ACS Nano》:钼纳米点用于急性肺损伤的治疗
时间:2023-11-27 16:30:25 热度:37.1℃ 作者:网络
急性呼吸窘迫综合征(ARDS)是一种常见的呼吸危重症疾病,尤其自COVID-19的全球大流行以来,其发病率与死亡率更是持续居高不下,然而目前仍然缺乏有效的治疗手段。尽管ARDS的发病机制复杂且尚不明确,但许多研究指出过量活性氧(ROS)的产生和不可控的炎症反应在ARDS的疾病发生进展中起重要作用。随着纳米技术和生物医学技术的深入交叉融合,越来越多功能性纳米材料被引入医学领域,大量研究证明了多种具有抗炎与抗氧化功能的纳米材料可以改善各类疾病。
近期,上海交通大学医学院附属瑞金医院瞿介明教授、倪大龙教授和美国威斯康星大学麦迪逊分校蔡伟波教授团队制备了一种功能性纳米材料钼纳米点(MNDs)用于治疗急性肺损伤(ALI),该材料具有超小尺寸、良好生物相容性和ROS清除能力等特征和优势。细胞实验验证了该钼纳米点具有清除ROS和抑制细胞凋亡的作用。在脂多糖(LPS)诱导和铜绿假单胞菌(PAO1)感染诱导的两种ALI小鼠模型上,气管滴注给予MNDs能明显改善小鼠肺组织的氧化应激水平、炎症反应程度、肺泡毛细血管屏障通透性和组织损伤严重程度,且具有良好的安全性。进一步小鼠肺组织的RNA-seq结果表明MNDs可通过抑制NLRP3炎症小体激活从而抑制焦亡来发挥治疗作用。相关研究内容以标题为“Molybdenum Nanodots for Acute Lung Injury Therapy”的论文发表在ACS Nano。

【文章要点】
MNDs通过将商品钼粉在冰浴条件下超声剥离制备而成,合成的MNDs粉末易溶于水形成深紫色溶液。作者通过细胞实验初步证明MNDs可以通过清除ROS来减轻氧化应激对细胞的损伤,随后构建LPS诱导ALI小鼠模型来探索MNDs在体内的抗氧化作用,LPS诱导肺损伤是最常用的一种ALI动物模型。将小鼠随机分为对照组(Control组)、LPS组(Normal saline组)、LPS + 0.1 mg/kg MNDs组(0.1 mg/kg MNDs组)、LPS + 1 mg/kg MNDs组(1 mg/kg MNDs组)。如图1所示,作者通过肺组织DHE染色、检测MPO水平和SOD、MDA活性,说明了MNDs可以在LPS诱导的ALI小鼠肺内通过清除ROS来减轻氧化应激反应。
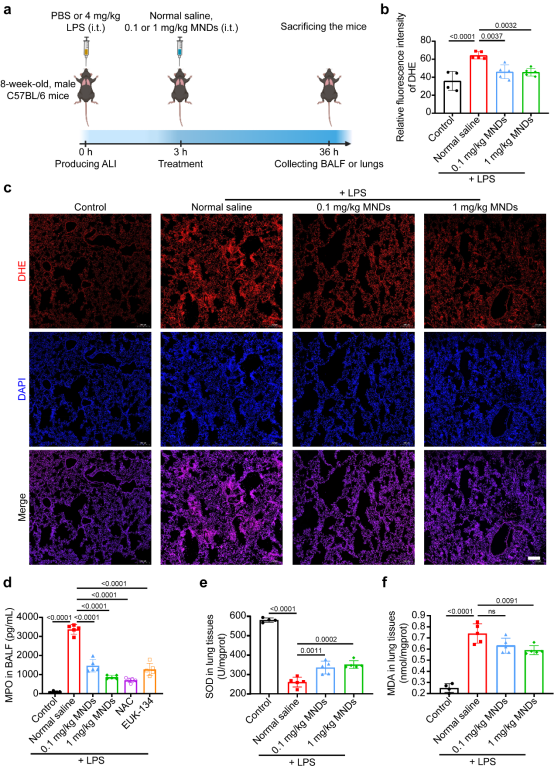
图1 在LPS诱导的ALI小鼠中验证MNDs抗氧化作用
根据文献报道,过量ROS会引起肺泡毛细血管屏障功能障碍并且表达大量促炎因子,导致肺组织损伤和肺水肿。因此作者进一步探索MNDs是否可以改善LPS诱导ALI小鼠肺中的炎症反应和组织损伤情况。结果表明,相较于未治疗组,给予0.1和1 mg/kg MNDs治疗组的小鼠BALF中白细胞与中性粒细胞计数均明显下降。作者为了进一步验证MNDs抗炎作用,通过ELISA法检测BALF中的促炎因子和抑炎因子水平。结果发现用MNDs治疗后ALI小鼠BALF中促炎因子TNF-α和IL-6明显下降,而抑炎因子IL-10在高剂量即1 mg/kg MNDs治疗组中显著升高。以上证据表明,MNDs可以抑制炎症细胞涌入肺中,并减少促炎因子的产生,具有良好的抗炎功效。通过检测BALF中蛋白水平和计算肺湿干比,作者发现MNDs可以改善肺泡毛细血管屏障功能、减轻ALI中的肺水肿情况。进一步的肺组织病理切片结果显示,未予治疗的ALI小鼠肺组织中有明显的炎症细胞浸润、肺泡壁增厚和肺泡腔融合,MNDs治疗后肺组织损伤情况明显好转。因此,肺组织病理学结果提供了直接证据,证明了MNDs对LPS诱导的ALI小鼠具有积极的保护作用(图2)。
为了进一步确认MNDs疗效,作者在PAO1诱导的ALI小鼠模型中也进行研究,并且得到与LPS模型中相似的结果,说明在LPS和PAO1诱导的ALI小鼠模型中,MNDs可以通过清除ROS发挥抗炎和抗氧化作用。

图2 在LPS诱导的ALI小鼠中验证MNDs抗炎作用
接下来,为了揭示MNDs的潜在治疗机制,作者对小鼠肺组织进行了RNA-seq检测分析。在与炎症反应相关的差异表达基因中,作者发现MNDs治疗后,Nlrp3、Casp1、Gsdmd和Il1b的表达明显下调。此外,GSEA分析结果显示,与炎症小体复合物相关的上调基因在ALI组中明显富集,提示MNDs可能抑制NLRP3依赖性焦亡通路的激活。为了进一步验证该猜想,作者使用定量实时PCR方法检测转录组学中发现表达显著下调四个基因的mRNA水平,结果表明MNDs治疗的确显著抑制肺组织中Nlrp3、Casp1、Gsdmd和Il1b的表达。随后,为验证MNDs是否能抑制NLRP3依赖性焦亡通路的激活,作者进行了蛋白质印迹分析。由于MCC950是特异性NLRP3炎症小体的抑制剂,因此作者设置MCC950治疗组作为阳性对照组。与LPS组相比,MNDs治疗组小鼠的NLRP3、Caspase-1剪切片段、GSDMD N-末端和IL-1β剪切片段水平明显降低,这表明MNDs可以抑制NLRP3炎症小体的激活和焦亡的发生。ELISA结果显示,给予MNDs治疗的小鼠肺组织匀浆中IL-1β的水平显著降低,这与蛋白质印迹的结果一致。此外,免疫组化染色结果进一步证明,LPS + MNDs组肺部的Caspase-1蛋白水平明显低于LPS 组,这些发现与实时定量PCR的结果一致。综上所述,MNDs通过抑制LPS诱导的ALI小鼠肺内NLRP3炎症小体激活和焦亡发生,从而发挥保护肺组织的作用。(图3)
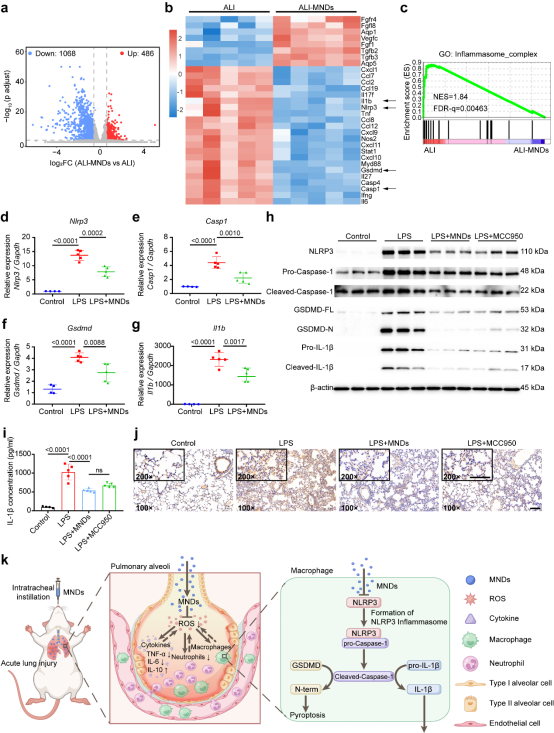
图3 通过RNA-seq分析探索和验证MNDs发挥治疗作用的机制
【结论与展望】
本研究中作者制备了一种功能性纳米材料钼纳米点,MNDs可以通过清除ROS发挥抗炎和抗氧化作用来改善肺组织损伤情况,深入机制探索发现MNDs通过抑制NLRP3依赖性焦亡通路来保护肺组织免受损伤(图6k),同时MNDs具有良好的生物相容性,有望成为一种安全、有效、具有临床转化意义的ARDS治疗药物。
原文链接:
https://doi.org/10.1021/acsnano.3c08147


