NCB:沈博团队合作揭示骨髓移植后神经促进造血干细胞和血管再生的机制
时间:2023-12-01 14:00:21 热度:37.1℃ 作者:网络
骨髓中含有促进放射或化疗(骨髓消融)后造血再生的周围神经,但对其如何调节知之甚少。
2023年11月27日,北京生命科学研究所沈博及西南医学中心Sean Morrison共同通讯(高祥为第一作者)在Nature Cell Biology在线发表题为“Leptin receptor+ cells promote bone marrow innervation and regeneration by synthesizing nerve growth factor”的研究论文,该研究发现瘦素受体表达(LepR+)基质细胞产生的神经生长因子(NGF)是维持成人骨髓神经纤维所必需的。
在无神经的骨髓中,稳态造血功能正常,但骨髓消融后造血和血管再生功能受损。骨髓消融后,LepR+细胞及其产生的脂肪细胞增加了神经生长因子的产生,促进了骨髓中的神经发芽以及造血和血管再生。神经通过激活LepR+细胞和脂肪细胞中的β2和β3肾上腺素能受体信号,增加其多种造血和血管再生生长因子的产生,从而促进再生。因此,外周神经和LepR+ 细胞促进骨髓再生是通过一种相互关系,即LepR+ 细胞通过合成神经生长因子来维持神经,而神经通过促进LepR+ 细胞产生生长因子来促进再生。

周围神经促进多种组织的再生,但在大多数情况下,人们对其促进再生的机制知之甚少。骨髓含有周围神经,包括交感神经、副交感神经和感觉神经纤维。腰交感神经横断使骨髓中的交感神经纤维和雪旺细胞耗竭,导致造血干细胞(HSC)耗竭。在稳态条件下,系统性6-羟多巴胺的交感神经去支配不会影响造血干细胞的频率或功能,但交感神经和感觉神经的系统性消融会消耗骨髓造血干细胞。神经纤维调节造血干细胞/祖细胞进入血液的昼夜节律动员以及通过放疗或化疗进行清髓消融后造血的再生。神经纤维通过激活β肾上腺素能受体来促进造血再生和衰老过程中造血功能的变化,尽管β肾上腺素能受体促进造血再生的机制以及它们作用的细胞尚不清楚。
成年小鼠骨髓中表达瘦素受体(Leptin receptor- expressed, LepR+)的基质细胞可合成生长因子,促进造血干细胞和祖细胞的维持以及成骨和血管再生。LepR+细胞通过合成干细胞因子(stem cell factor, SCF)促进造血干细胞和早期受限祖细胞的维持CXCL12、IL7、pleiotrophin和Csf1。SCF16和CXCL12的分析报告基因,以及单细胞RNA测序表明,LepR+细胞是成人骨髓中这些因子的主要来源。LepR+细胞还通过产生血管生成素-1和VEGF-C2促进血管再生。
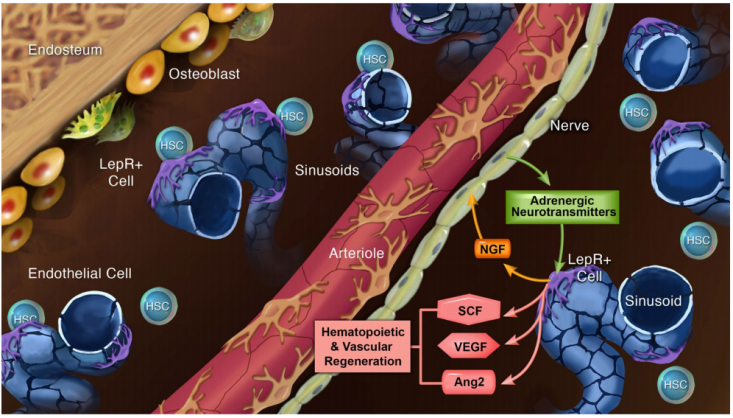
骨髓中LepR+基质细胞和神经纤维之间的相互关系示意图(图源自Nature Cell Biology )
LepR+细胞还包括形成成人骨髓中脂肪细胞和成骨细胞的骨干细胞和祖细胞。由LepR+细胞形成的成骨细胞有助于维持和修复成人骨骼,并分泌促进成骨的因子。成人骨髓中由LepR+细胞产生的脂肪细胞通过合成SCF35促进骨髓消融后造血干细胞的再生和造血。LepR+细胞和脂肪细胞也通过分泌脂联素促进HSC的维持和静止,从而抑制炎症。
该研究发现,骨髓神经纤维由LepR+细胞合成的NGF维持,反过来,神经通过分泌肾上腺素能神经递质激活LepR+细胞中β2/β3肾上腺素能受体信号传导,促进造血和血管再生。因此,外周神经和LepR+细胞促进骨髓再生是通过一种相互关系,即LepR+细胞通过合成神经生长因子来维持神经,而神经通过促进LepR+细胞产生生长因子来促进再生。
原文链接:
https://www.nature.com/articles/s41556-023-01284-9


