STTT:华中科技大学刘国辉/张英泽/米博斌发现丙戊酸诱导骨质流失的潜在机理
时间:2024-01-26 19:15:56 热度:37.1℃ 作者:网络
丙戊酸(VPA)对骨稳态的临床作用和潜在机制仍有争议。
2024年1月22日,华中科技大学刘国辉、张英泽及米博斌共同通讯在Signal Transduction and Targeted Therapy在线发表题为“Bone-targeting engineered small extracellular vesicles carrying anti-miR-6359-CGGGAGC prevent valproic acid-induced bone loss”的研究论文,该研究发现骨靶向工程小细胞外囊泡携带抗miR-6359-CGGGAGC可预防丙戊酸诱导的骨质流失。
该研究表明在体内和体外,VPA处理通过miR-6359/ SIRT3/MAPK信号通路增强破骨细胞的形成和活性,导致骨质流失。这是首次有研究表明VPA通过miR-6359在体内加剧骨质流失。此外,结果表明,E-sEVs可以靶向骨中的破骨细胞前体,并在体内显著逆转VPA诱导的骨质流失。因此,E-sEVs是治疗VPA相关性骨质流失的潜在治疗剂。

骨质疏松症的特点是全身性骨骼病理,以骨密度降低和骨组织微结构变性为特征,导致脆性和骨折易感性增加。年龄、雌激素缺乏、药物等因素破坏骨吸收与骨形成协调过程的平衡,促进骨质疏松症的发生。丙戊酸(VPA)是一种支链短链脂肪酸,是一种广泛和长期使用的药物,用于治疗各种类型的癫痫,特别是广泛性癫痫患者。然而,接受VPA药物治疗的患者患骨质疏松症的风险一直在增加,骨密度(BMD)下降和骨量流失加速证明了这一点,这增加了骨质疏松性骨折的患病率,造成了严重的健康并发症和医疗保健费用。此外,很少有专门针对癫痫患者接受VPA治疗后骨质疏松评估的指南。有限的研究直接检查了常规治疗,如抗吸收或合成代谢治疗,对VPA诱导的骨质减少或骨质疏松症的影响。因此,重要的是要调查潜在的机制,并确定可能有效的治疗方法,以解决这一流行病。
MicroRNAs (miRNAs)是一种小的单链内源性非编码RNA,被认为是多种生物过程的调节剂,如细胞增殖、细胞周期、分化和器官发育。同样,miRNAs也通过在转录后水平负调控特定基因的表达,广泛参与骨质疏松症的发生和进展。据报道,有几种miRNAs可调节破骨细胞发生和成骨细胞骨形成,这些miRNAs的失调与以骨量损失为特征的骨骼疾病有关。例如,在老年骨折妇女和去卵巢小鼠中发现,增加的破骨细胞miR-214-3p被转移到成骨细胞中,从而抑制骨形成在前列腺癌(PCa)来源的小细胞外囊泡(sEVs)中富集miR-92a-1-5p可下调I型胶原蛋白的表达,从而促进破骨细胞的形成,抑制成骨。具体来说,miRNAs水平的改变与骨形成和骨吸收标志物以及骨密度的波动相关。在服用VPA的癫痫患者中也观察到这些骨转换标志物的变化,表明miRNAs可能参与了VPA诱导的骨质流失和骨质疏松症。
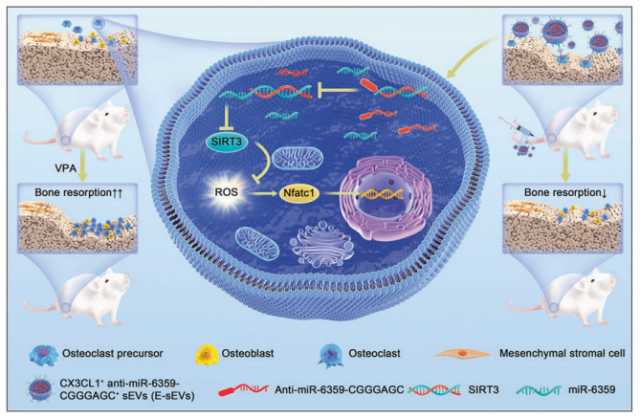
VPA诱导骨质流失的机制以及E-sEVs如何预防骨质流失(图源自Signal Transduction and Targeted Therapy )
该研究证实了VPA治疗与患者和小鼠的骨量和骨密度(BMD)下降有关。这种效果归因于VPA诱导的破骨细胞形成和活性的升高。通过RNA测序,在体外观察到VPA处理的破骨细胞前体中前体miR-6359的表达显著升高,并且进一步证实了体内成熟miR-6359 (miR-6359)的显著上调。具体来说,在VPA刺激后,miR-6359主要在破骨细胞前体和巨噬细胞中增加,而在中性粒细胞、T淋巴细胞、单核细胞和骨髓间充质干细胞(BMSCs)中没有增加,这影响了破骨细胞的分化和骨吸收活性。
VPA诱导的miR6359在破骨细胞前体中的富集通过沉默SIRT3蛋白表达,进而激活MAPK信号通路,从而增强破骨细胞的形成和活性,从而加速骨质流失,从而增强活性氧(ROS)的产生。目前,还没有药物可以有效治疗VPA引起的骨质流失。因此,作者构建了靶向骨内破骨细胞前体的工程化小细胞外囊泡(E-sEVs),通过在anti-miR-6359序列的3 '端引入EXOmotif (CGGGAGC),自然携带anti-miR6359。该研究证实了E-sEVs具有良好的骨/破骨细胞前体靶向性,并对VPA诱导的骨质流失具有保护治疗作用,但对卵巢切除术(OVX)和糖皮质激素诱导的骨质疏松模型没有作用,加深了对VPA诱导的骨质流失的潜在机制和治疗策略的理解。
原文链接:
https://www.nature.com/articles/s41392-023-01726-8


