首例:洛拉替尼成功治疗阿来替尼耐药的ALK阳性转化性小细胞肺癌患者
时间:2024-03-16 20:00:43 热度:37.1℃ 作者:网络
在间变性淋巴瘤激酶(ALK)阳性的非小细胞肺癌(NSCLC)中,发生小细胞肺癌(SCLC)的组织学转化极为罕见。迄今为止,关于转化为小细胞肺癌的病例报告十分有限,该类患者的最佳治疗策略和预后尚不明确。本文患者罹患ALK融合伴V1180L突变NSCLC,经阿来替尼治疗并耐药后,组织学转化为SCLC,随后接受洛拉替尼治疗并取得缓解。本文首次描述了洛拉替尼治疗SCLC患者的有效性。
本研究证实了洛拉替尼对携带ALK V1180L突变的ALK阳性转化性SCLC患者的疗效。此外,它强调了在ALK-TKI耐药后转化为SCLC的患者中进行基因检测的必要性,因为如果确定了驱动基因,靶向治疗可能仍然有效。

背 景
间变性淋巴瘤激酶(ALK)融合(也称为重排)是继EGFR基因突变后,在非小细胞肺癌(NSCLC)中发现的另一个肿瘤驱动因素,同时为肿瘤治疗的精准靶向治疗提供了一个潜在的靶点。NSCLC中ALK重排的总发生率约为 3-7% 。虽然这一比例不高,但由于NSCLC患者数量众多,每年新发诊断ALK阳性NSCLC病例仍超过 75000 例。2011年,FDA批准了首个ALK抑制剂克唑替尼,用于治疗晚期ALK阳性NSCLC,标志着ALK抑制剂治疗肺癌时代的开始。从第一代克唑替尼到第二代塞瑞替尼、阿来替尼、布格替尼,再到第三代洛拉替尼,这三代药物与酪氨酸激酶结构域有着不同的结合模式。因此,它们对ALK耐药突变的敏感性有所不同。总的来说,ALK融合对ALK-TKIs表现出较高的反应率,即使出现脑转移也能够延长生存期。然而,ALK-TKI使用后会不可避免的出现获得性耐药性,最终导致疾病的复发或进展。耐药机制包括ALK激酶结构域内的二次突变、ALK融合基因拷贝的扩增、旁路和下游通路的激活,以及向小细胞肺癌(SCLC)的转化。
从NSCLC到SCLC的组织学转化代表了表皮生长因子受体(EGFR)突变的NSCLC对酪氨酸激酶抑制剂(TKIs)产生耐药性的一种常见机制,这在约 4-14% 的患者中发生。然而,ALK-TKI耐药导致转化为SCLC是一种罕见的现象。表1汇总了到目前为止,现有文献中与ALK阳性NSCLC转化为SCLC相关的病例报告。在大多数情况下,发生SCLC转化后,靶向治疗和化疗的疗效往往有限,最终会导致疾病快速进展。在这些研究中,有研究者认为免疫联合化疗可能有效。
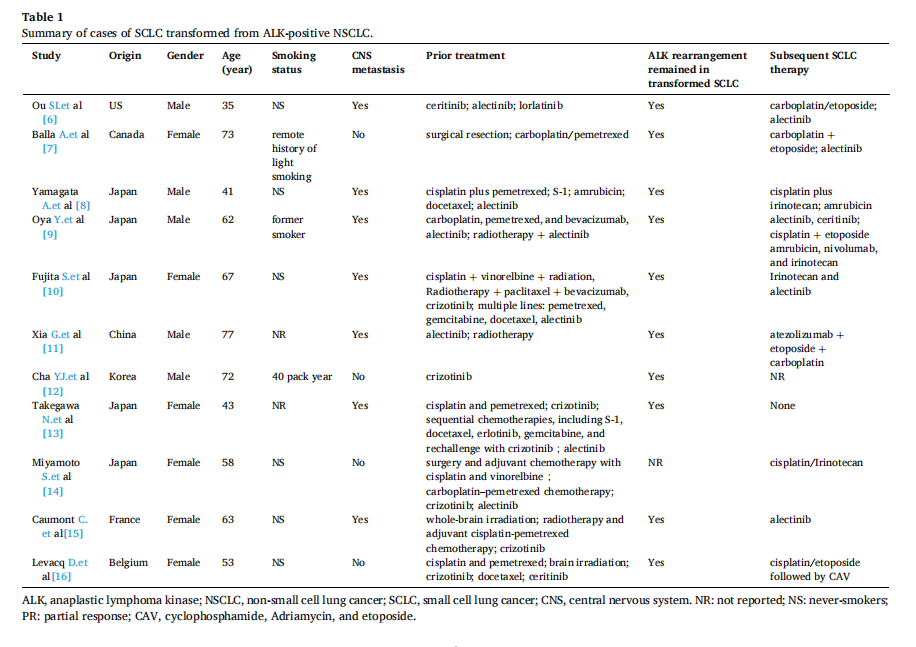
▲表1 由ALK阳性的NSCLC转化而来的SCLC病例汇总
本文报告了一个经ALK-TKI诱导从NSCLC转化为SCLC的病例,该患者在阿来替尼耐药后转化为携带ALK V1180L突变的SCLC。随后的洛拉替尼治疗使疾病得到显著控制。本文提示了洛拉替尼在ALK阳性、发生组织学转化的SCLC患者中的潜在疗效,并强调了重新评估在ALK-TKI耐药后检测SCLC相关基因的必要性。
病 例
患者男,52 岁,有 25 年吸烟史,无既往病史。因持续咳嗽 3 个多月,就诊于当地医院。初次就诊时,胸部CT扫描显示左肺下叶有一个病变,提示肺癌,存在纵隔和左肺门淋巴结转移、双侧肺结节和心包积液。初次就诊 9 天后,进行了经皮肺活检,结果显示:CK5/6(-)、CK7(+)、CK(+)、Ki-67(约50%+)、P40(-)、TTF-1(+)、Napsin-A(-)、Syn(+)、CD56(+)、CgA(-)和ALK(D5F3)(+)。这些表现与浸润性低分化癌一致,有浸润性腺癌的倾向。检查显示多发性骨和脑转移,IVB分期(cT3N2M1)。PD-L1表达阴性。三天后,基因检测发现存在EML4-ALK融合(V3变异)、KRAS G12D突变、TP53突变、RB1突变和PIK3CA突变。
该患者未在当地医院接受进一步的治疗。在基因检测后的第 34 天开始使用恩沙替尼进行靶向治疗。随后,患者转诊至安徽省胸科医院。入院后的 3 天内进行了胸部CT(图1A)和脑部MRI(图2A)。由于保险原因,在恩沙替尼治疗 12 天后,患者改用阿来替尼治疗,未观察到明显的不适。1 个月后的随访检查显示肺部和颅内病变明显减少(图1B),疗效评估为部分缓解(PR)。随后的评估显示肿瘤稳定(图1C)。2 个月后,MRI显示颅内病变减少(图2B)。经阿来替尼治疗 8 个多月后,随访胸部CT显示肺部病变进展(图1D),颅内MRI显示颅内病变进展(图2C)。影像检查提示疾病进展 5 天后,进行支气管镜活检,病理表现为小细胞肺癌(图3)。免疫组化显示CK(核周点样+)、TTF-1(+)、Syn(+)、CD56(+)、Ki-67(约90%+)呈阳性,而CD3和CD20均为阴性。临床决定停止阿来替尼治疗。然后患者接受了一个周期的依托泊苷和顺铂(EP)化疗。随后,第二次组织基因检测结果显示EML4-ALK融合(V3变异)、ALK V1180L突变、TP53突变、RB1突变,肿瘤突变负荷(TMB)为11.3 muts/Mb,微卫星稳定(MSS)。随后,随访显示左肺病变状态相似(图1E),在第一个周期的EP治疗后,左胸出现不适。3 天后,患者接受第二周期EP化疗,但疗效不佳。
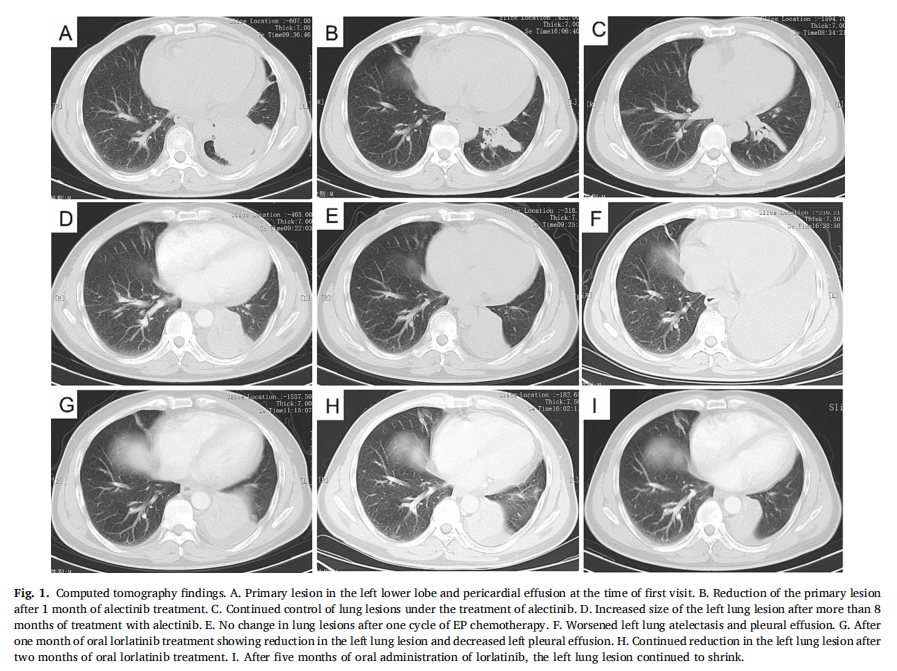
▲图1 CT检查结果

▲图2 颅部MRI结果
经过 2 个周期的EP治疗后,患者开始口服洛拉替尼(100 mg QD)。首次应用洛拉替尼 6 天后,随访胸部CT显示左肺塌陷和左侧胸腔积液加重(图1F),经适当治疗后有所改善。25 天后,胸部CT显示左肺病变缩小,左胸腔积液减少(图1G),随后的颅内MRI显示颅内病变减少(图2D)。在接下来的 28 天里,胸部CT显示左肺病变的大小进一步缩小(图1H),患者的整体生活质量持续改善。经洛拉替尼持续治疗 5 个月后,肺部和颅内病变继续缩小,且无不良反应。
讨 论
本文报告了一例最初诊断为神经内分泌分化和EML4-ALK融合(V3变异)的晚期肺腺癌患者。患者对初始的阿来替尼治疗反应积极,但在耐药后转化为ALK V1180L突变的小细胞肺癌。EP化疗的疗效有限,并伴有明显的不良反应。然而,在使用洛拉替尼后,肺部和颅内病变明显减少,且治疗耐受性良好,患者的生活质量取得明显改善。
患者最初诊断为浸润性腺癌并伴有神经内分泌分化。值得注意的是,SCLC通常起源于具有神经内分泌分化的上皮细胞。NSCLC中神经内分泌分化的存在可能是导致SCLC转化的因素之一。NSCLC向SCLC的转化仍是一个有争议的话题。一些理论认为,最初的诊断性活检可能无法提供足够的标本来鉴别肿瘤的混合组织学。由于ALK-TKIs对NSCLC部分的抑制作用,SCLC部分才得以鉴别。然而,如果患者在诊断时存在SCLC成分,有效的TKI治疗可能会抑制对TKI敏感的NSCLC成分,而对TKI耐药的SCLC成分则会迅速增殖。在短期内,疾病可能会发生进展。这与本文患者病程不符。另一种理论认为,转化的SCLC和预转化的NSCLC起源于同一个前体细胞。Tatematsu等人也报道了携带EGFR敏感突变的肿瘤细胞的原始细胞具有分化为神经内分泌肿瘤细胞的潜力。据报道,在使用第二代ALK-TKIs治疗后,从NSCLC向SCLC的转化似乎更容易发生。这一现象可以归因于在第二代TKIs治疗过程中,肿瘤细胞经历了更高的暴露压力,迫使肿瘤细胞发生生物学变化或组织学转化。另一种理论认为,转化性SCLC可能代表第二种原发肿瘤。然而,在本文病例中,研究人员从转化的SCLC中发现EML4-ALK融合(V3变异),这与初始诊断一致。这一结果表明,本文患者的转化性SCLC可能不是一个独立于原发NSCLC的第二原发肿瘤。
在分子水平上,对EGFR突变相关的转化SCLC有大量的研究,RB1缺失是预转化NSCLC中常见的现象。其它研究也表明,存在RB1和TP53缺失的患者有转化为SCLC的趋势。在有RB1和TP53缺失的EGFR突变肺腺癌中,SCLC转化的风险比没有RB1和TP53缺失的患者高 43 倍。同样,在多个伴有ALK融合的SCLC转化病例中也观察到RB1和TP53缺失。在本文病例中,在发生转化前观察到KRAS G12D、TP53、RB1和PIK3CA突变,而在转化后仅发现TP53和RB1突变。NSCLC中TP53和RB1突变作为SCLC转化的驱动因素的含义及其作为预测生物标志物的潜在用途有待进一步验证。
转化性SCLC通常表现为快速的疾病进展,并对临床治疗提出了挑战。目前,目前尚无针对ALK融合相关SCLC转化的标准治疗策略。化疗是最常见的治疗选择,依托泊苷联合含铂化疗是SCLC的一线治疗方法,广泛应用于转化性SCLC。此外,考虑到转化性SCLC中先前存在的突变,TKIs经常与化疗联合使用或作为化疗后的维持治疗。TKI的选择包括继续使用在发生SCLC转化之前使用的TKI,以及使用新的TKI。然而,目前还缺乏关于在转化性SCLC的背景下,继续使用原TKI治疗与改用另一种TKI治疗的疗效的研究。在本例中,患者对第二代TKI阿来替尼治疗产生耐药性后,发生了SCLC转化,并且仍能检测到ALK融合以及V1180L突变。尽管接受了针对SCLC的EP化疗,但疗效不佳,且有显著的不良反应。随后口服洛拉替尼显著减少了肺部和颅内病变,且耐受性良好,明显改善了患者的生活质量。这种反应可能归因于小细胞肺癌在这一点上仍然携带驱动基因突变:先前的研究表明,V1180L突变是一种常见的耐药机制,而洛拉替尼对ALK融合伴V1180L突变有效。这表明,对于具有复杂耐药机制的患者,如并发SCLC转化和继发性ALK突变,不仅要考虑SCLC转化的可能性,还应及时重新活检以明确分子特征。在制定治疗决策时应同时考虑组织学亚型和分子特征,以有效延长患者的生存期。
值得注意的是,在这种情况下,小细胞肺癌的诊断是基于支气管镜引导下的活检和免疫组化结果。活检样本并不一定能反映整个肿瘤的组织学特征。EML4-ALK融合相关的SCLC患者的特征有待进一步研究。此外,由于该患者的颅内病变缺乏病理检测,因此不确定颅内病变是否也会转化为SCLC。因此,颅内病变的消退可能是由于洛拉替尼对NSCLC肿瘤细胞的抑制作用所致。
转化性SCLC是肿瘤适应和耐药的一种机制。本研究强调了需要进一步研究具有神经内分泌分化的NSCLC的治疗策略,以及向小细胞癌转化的机制和治疗方法的必要性。在表观遗传水平上,转化性SCLC是更类似于原先的NSCLC还是典型的SCLC还需要进一步的探索。这将有助于更好地理解EML4-ALK重排SCLC转化患者的特征,并指导治疗决策。
结 论
本研究报告了首次使用洛拉替尼成功治疗伴ALK融合和V1180L突变的转化性小细胞肺癌耐药患者。这一发现影响了临床实践,强调了重新评估ALK TKI耐药后患者的基因突变的重要性。研究结果表明,如果在ALK TKI耐药后经历SCLC转化的患者中发现了驱动突变,那么靶向治疗可能仍然有效,强调了对这类患者行进一步的基因检测和个体化治疗策略的必要性。
参考文献:
Lingling X, Maoxi C, Wei Y, Jieting Z, Yuanyuan Y, Ning X. Transformation of NSCLC to SCLC harboring EML4-ALK fusion with V1180L mutation after alectinib resistance and response to lorlatinib: A case report and literature review. Lung Cancer. 2023 Oct 28;186:107415. doi: 10.1016/j.lungcan.2023.107415. Epub ahead of print. PMID: 37907052.



