Autophagy:中山大学肖非等团队揭示TMX2通过促进自噬和线粒体自噬来增强肝癌细胞的活力
时间:2024-06-03 19:00:42 热度:37.1℃ 作者:网络
在肝细胞癌(HCC)的发生和进展中,膜蛋白表达的失调被认为起着重要作用。
2024年5月26日,中山大学肖非,单鸿,庞鹏飞及Zhiju Zhao共同通讯在Autophagy 在线发表题为“TMX2 potentiates cell viability of hepatocellular carcinoma by promoting autophagy and mitophagy”的研究论文。该研究进行了一个CRISPR激活筛选,针对编码与膜相关的人类基因,揭示了TMX2作为HCC细胞存活的潜在驱动因子。增益和丧失功能实验表明,TMX2促进了HCC的生长和肿瘤发生。临床上,TMX2是HCC患者的独立预后因子。在HCC组织中,TMX2显著上调,并与HCC患者的不良预后相关。
从机制上讲,TMX2被证明通过促进KPNB1的核外转运和TFEB的核内转运来促进自噬。此外,TMX2与VDAC2和VDAC3相互作用,协助PRKN在氧化应激期间缺陷的线粒体上的招募,促进细胞保护性线粒体自噬。最有趣的是,HCC细胞通过上调TMX2表达和细胞自噬来应对氧化应激。TMX2的敲除增强了lenvatinib的抗肿瘤效果。总之,该研究强调了TMX2在驱动HCC细胞存活中的关键作用,因为它促进了自噬和线粒体自噬。这些结果表明,TMX2可能作为HCC治疗的预后标志和有前景的治疗靶点。

原发性肝癌是第六种最常见的癌症类型,也是癌症相关死亡的第三大主要原因。作为原发性肝癌的主要组织学类型,肝细胞癌(HCC)占据了大多数肝癌诊断和死亡的比例。尽管进行了大量的努力,但对于晚期HCC的治疗选择仍然有限,五年生存率仍然非常低。因此,识别和理解导致肿瘤发生和进展的遗传因素是研究人员的主要目标。
近年来,基于CRISPR系统的前向遗传筛选使得研究人员能够识别参与表型变化的遗传特征。几个团队已经利用CRISPR筛选系统识别了参与HCC增殖、耐药和肝癌干细胞扩展的基因。膜蛋白与各种肿瘤的进展相关联,包括HCC。MUC13和MUC15已被证明调节HCC的进展,但尚未系统探索调节HCC进展的膜蛋白。为了解决这个问题,作者进行了CRISPR激活筛选,以识别调节HCC细胞存活的关键膜相关蛋白。
通过这种方式,作者发现了一组显著与HCC细胞存活相关的候选基因,包括TMX2(硫氧还蛋白相关跨膜蛋白2)。TMX2是蛋白二硫键异构酶家族的一种膜蛋白,其主要功能据报道是调节半胱氨酸残基之间的形成、异构化和解离共价键。TMX2位于内质网的不同亚区,如核包裹膜和线粒体相关膜。TMX2在氧化应激时上调,但在低氧、热休克或内质网应激时不上调,这与其启动子区域内缺乏ERSE基序是一致的。虽然研究报告了TMX2在维持氧化还原平衡和调节钙通量中的重要性,但关于TMX2在HCC中的生理功能仍然知之甚少。
自噬是一种涉及损伤或不必要的细胞成分降解和回收的细胞过程。它在维持细胞内稳态中发挥关键作用,并参与各种生理和病理条件,包括癌症。例如,自噬已被报道在某些条件下促进肿瘤的生长和存活,通过在营养匮乏时提供营养和能量,使它们适应恶劣的肿瘤微环境。此外,自噬提高了癌细胞对抗癌治疗的抵抗力,使其成为治疗干预的吸引人的靶点。自噬可以通过细胞内和细胞外的应激信号来启动,响应多种压力,包括缺氧、营养不足、氧化应激和各种治疗。然而,HCC中自噬的失调机制仍然没有完全理解。癌细胞的一个重要特征是产生活性氧化物质(ROS)。虽然大量ROS生成已被显示会引起细胞损伤和细胞死亡,但适度增加的ROS可能作为足够的“信号”来激活自噬和其他细胞存活机制。尽管ROS与自噬之间的联系已经得到充分记录,但ROS促进增加自噬的具体机制仍不清楚。
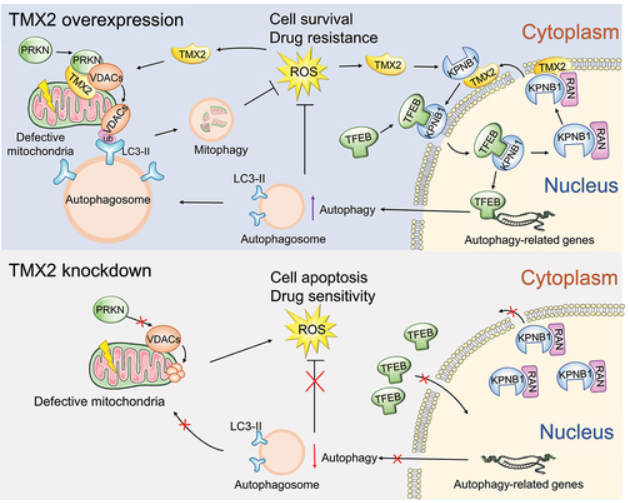
模式机理图(图片源自Autophagy )
该研究确定了TMX2作为控制肝细胞癌(HCC)细胞存活的关键因子。作者揭示了TMX2在ROS诱导的自噬和线粒体自噬中的关键作用,并突出了其在HCC中的临床相关性和治疗意义。这样的知识将为开发针对HCC细胞的治疗策略提供启示。
原文链接:
https://doi.org/10.1080/15548627.2024.2358732


