Apoptosis:唐诗聪/郭瑢/陈凯/杨日荣/单细胞分辨率下的乳腺癌代谢异质性和潜在的免疫治疗反应研究
时间:2024-07-07 06:00:54 热度:37.1℃ 作者:网络
肿瘤内异质性被认为等同于肿瘤微环境(Tumor Microenvironment,TME)异质性,该环境主要由基质细胞和免疫细胞构成,研究表明,肿瘤相关成纤维细胞 (carcinoma associated fibroblast,CAF)、肿瘤内皮细胞(tumor endothelial cell,TEC)及肿瘤浸润免疫细胞等微环境组分与肿瘤生长、血管形成及肿瘤免疫调节等生物过程息息相关,因此,详细描绘肿瘤微环境对于寻找治疗靶点和预后标志物至关重要。
单细胞测序技术已能在单个细胞水平上揭示不同细胞间的遗传变异异质性,成为研究肿瘤微环境的关键方法。然而,利用单细胞视角探索肿瘤内异质性与免疫治疗的代谢反应之间的关联,以指导临床实践,目前仍属空白。
2024年3月2日,昆明医科大学第三附属医院(云南省肿瘤医院)唐诗聪、郭瑢,昆明理工大学陈凯及广西医科大学杨日荣共同通讯在Apoptosis在线发表题为“Metabolic Heterogeneity and Potential Immunotherapeutic Responses Revealed by Single‑Cell Transcriptomics of Breast Cancer”的研究论文。该研究基于单细胞和临床水平,探索了乳腺癌的代谢异质性和潜在免疫治疗反应,为乳腺癌的异质性提供了全面理解,深入分析了癌症代谢与化疗耐药的相关性,且为基于T细胞异质性的免疫治疗反应预测奠定了基础。

乳腺癌(Breast cancer,BC)具有显著的异质性。肿瘤内部异质性促使不同生态系统的形成,并导致对化疗、靶向治疗乃至免疫治疗的反应各异。此外,对免疫微环境的异质性研究亦能区分出多种代谢亚型。尽管越来越多的研究通过单细胞转录组测序技术探索乳腺癌的基因异质性,仍存在疑问,例如异质性是否与同一患者不同细胞群集的不同临床结果相关,以及是否导致对化疗或免疫治疗的不同代谢反应,从而影响治疗策略的选择。
该研究对135511个细胞进行分类和功能富集,分为52个簇,并提取其中的上皮细胞分为了23个聚类。使用interCNV算法研究拷贝数变异(Copy number variations,CNVs)并构建乳腺癌的肿瘤进化树。结果表明,乳腺肿瘤细胞具有高度的异质性。
接下来,研究着重于上皮细胞的代谢异质性及其对化疗的不同反应。通过对上皮细胞重新聚类,发现不同簇中的代谢途径激活情况各异。此外,对TCA循环、糖酵解、糖异生和脂肪酸生物合成等代谢途径在单细胞水平上进行了分析,发现BC在不同簇中展示出代谢异质性。研究还使用非负矩阵分解(Non-negative matrix factorization,NMF)将肿瘤上皮细胞分为7个模块,分别代表抗原加工和呈递、代谢、癌症中的蛋白聚糖、氧化磷酸化、细胞周期、细胞因子产生的正向调节以及对未折叠蛋白的反应,进一步研究了乳腺癌的生态系统。
此外,通过CellphoneDB分析免疫微环境中的细胞间相互作用,发现细胞间的相互作用比预期更为强烈,且与其他细胞类型相比,CAF和巨噬细胞表现出更广泛的交互。
作者对CAF进行单独分析,通过重新聚类分为了5个簇,其中簇0高表达CXCL14,发现亚型间分布的差异暗示了表达CXCL14的成纤维细胞在BC进展和结局中发挥着潜在影响。随后,作者在TCGA BC队列中研究了CXCL14水平与患者预后的相关性,结果显示,CXCL14高表达患者的总生存期优于CXCL14低表达患者。此外,在预后较差的Luminal B型BC中,表达CXCL14的簇0成纤维细胞更为普遍,这表明该成纤维细胞亚群具有潜在的保护作用。
作者还进一步分析了T细胞和NK细胞,将其重新聚类为11个簇。在TNBC中,发现耗竭T细胞是一个潜在的免疫检查点抑制剂靶点。作者回顾了一位真实TNBC患者在几轮化疗后的情况,并在免疫检查点抑制剂中确定了一个潜在的治疗靶点。结果表明,该患者表达了PDL1和HAVCR2免疫检查点,并从免疫治疗中获益,从而初步验证了假设。
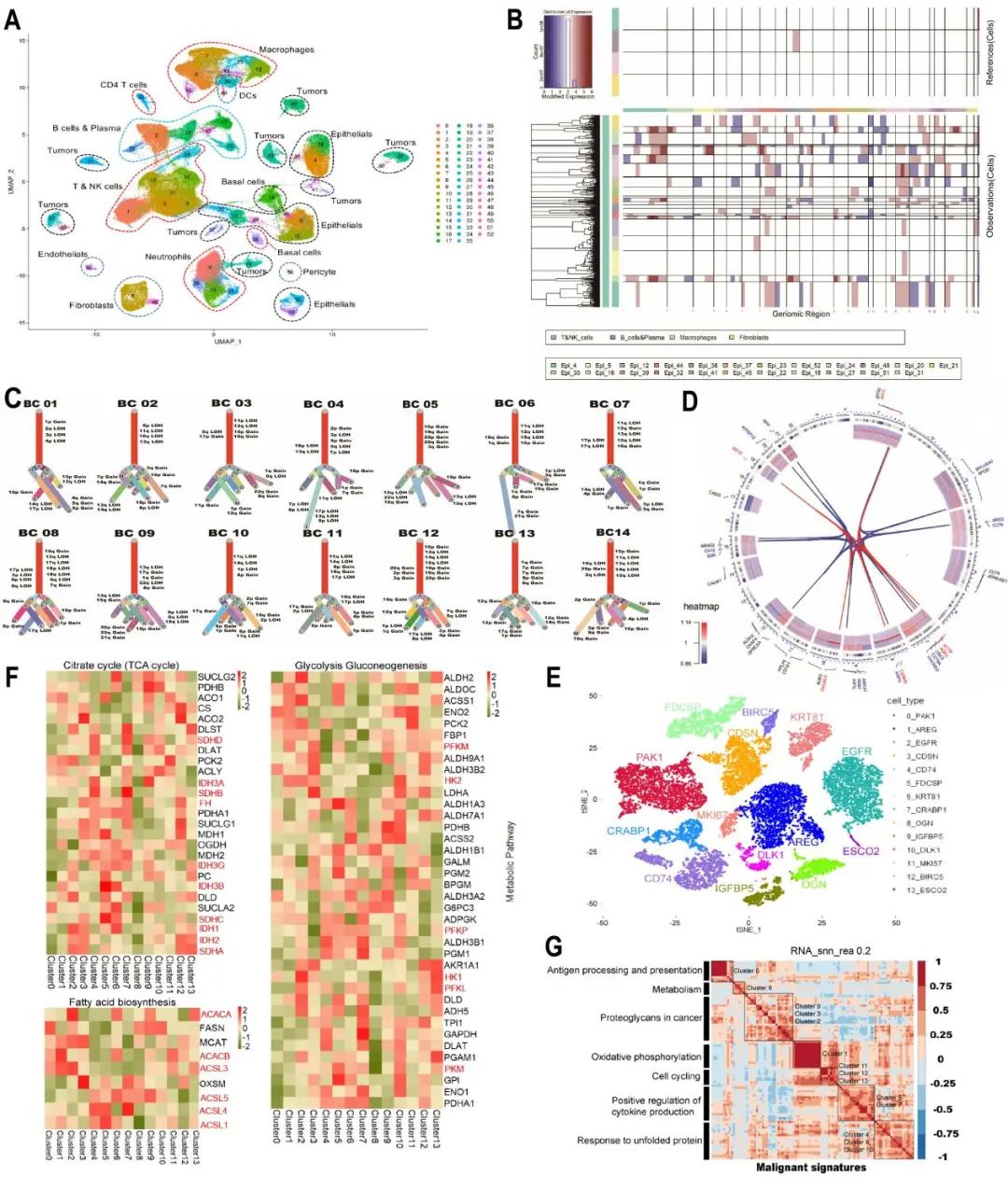
该研究基于单细胞转录组测序分析证明了乳腺癌的代谢异质性,并通过单独分析TME中的各类细胞证明了成纤维细胞亚群具有潜在的保护作用,且T细胞作为免疫治疗预测的靶点的可行性。
昆明医科大学第三附属医院(云南省肿瘤医院)唐诗聪教授、郭瑢教授,昆明理工大学陈凯教授及广西医科大学杨日荣教授是该论文的共同通讯,昆明医科大学第三附属医院(云南省肿瘤医院)硕士研究生王青、宋颖以及昆明理工大学博士研究生孙珂是论文的共同第一作者。
原文链接:
https://doi.org/10.1007/s10495-024-01952-7


