【Blood】How I Treat:分化综合征的诊断和治疗
时间:2024-07-18 16:01:18 热度:37.1℃ 作者:网络
在近10年中, 急性髓性白血病(AML)的靶向药物越来越多开发出来,其能够恢复正常分化中异常和白血病性“阻断”。全反式维甲酸(ATRA)和三氧化二砷(ATO)是治疗急性早幼粒细胞白血病(APL)的分化剂(differentiating agents)的经典案例,通过分化发挥作用的新疗法还包括IDH-1和IDH-2抑制剂、FLT3抑制剂和menin抑制剂。
然而,通过分化剂治疗白血病原始细胞的终末分化可导致一系列体征和症状,最初称为ATRA综合征或“维甲酸综合征”,现在称为“分化综合征”(differentiation syndrome,DS),主要表现为呼吸困难、肺浸润、胸膜和心包积液、不明原因发热、低血压、水肿和肾功能不全等系统性炎症反应系统(SIRS)样特征。新诊断APL患者的DS通常很容易识别,但诊断多次复发的AML患者的DS可能更具挑战性,因为非特异性体征和症状可能错误地归因于感染性病因或难治性白血病本身。及时考虑DS、迅速开始全身性皮质类固醇治疗并在伴有白细胞增多症的情况下早期减瘤,是最佳治疗的必要条件。
《Blood》杂志近日发表综述,通过两个案例分析了分化综合征的机制、诊断和治疗。
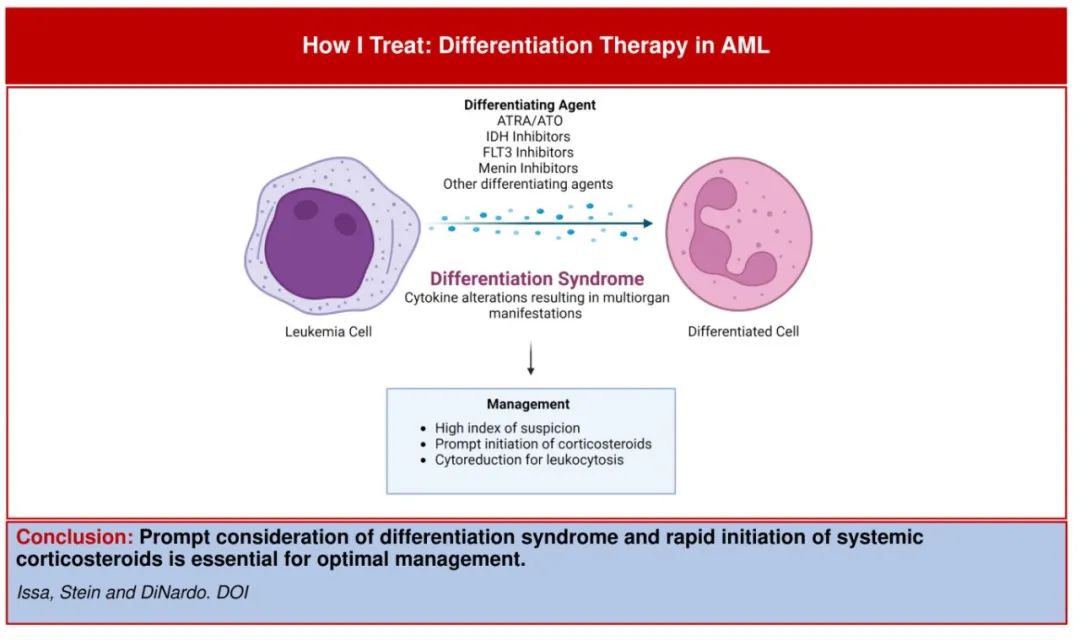
引言
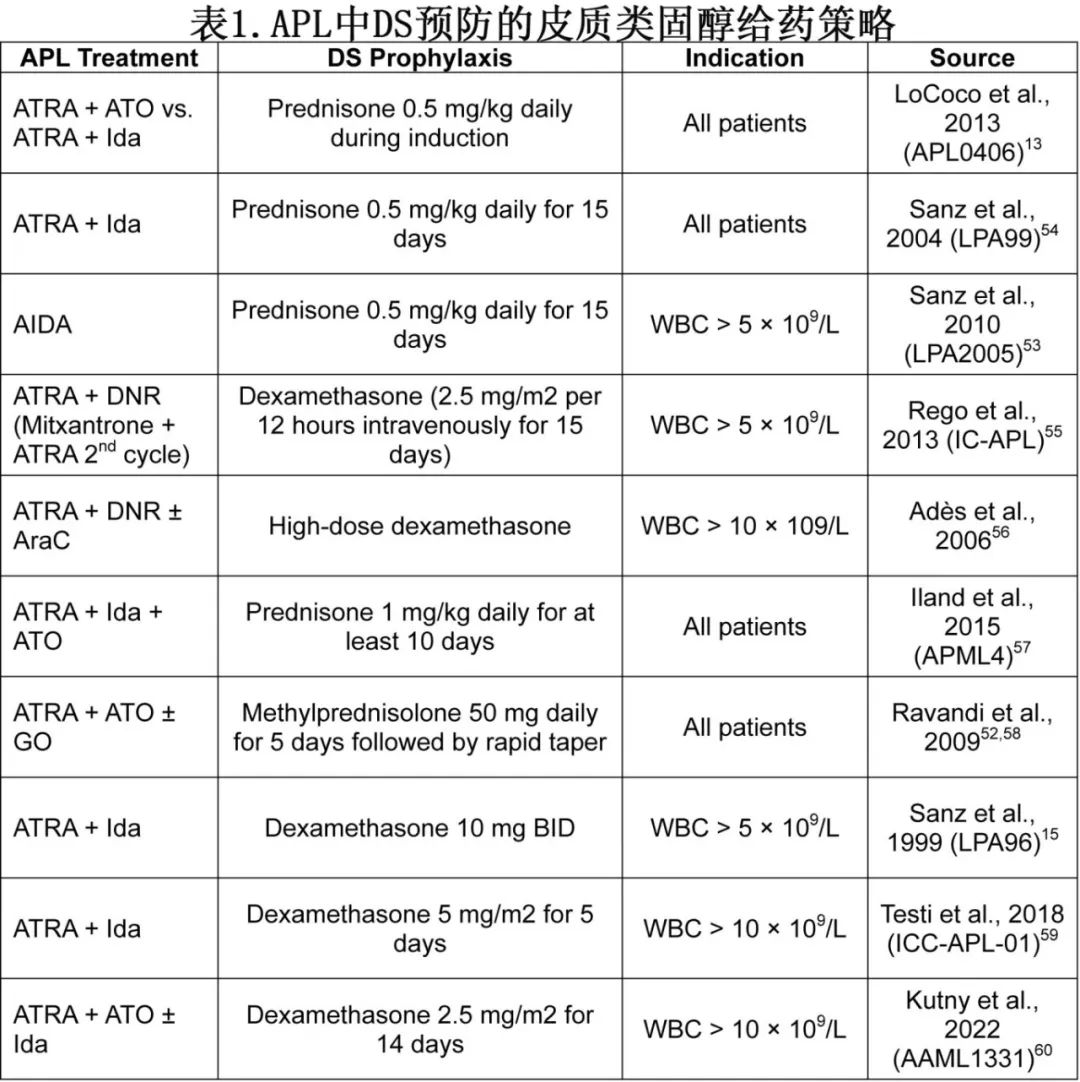
分化综合征通常发生于ATRA和/或ATO治疗后1-2周,发病率为3-37%。发病率的广泛差异源于不一致的诊断标准和非特异性的体征和症状,以及细胞毒性化疗和预防性皮质类固醇的合并使用存在差异(可能有助于降低DS的发病率和严重程度)(表1)。
病例1
患者为50岁西班牙裔女性,无明显既往病史,因严重阴道出血就诊急诊科。患者胳膊和腿上有淤青,疲劳呈进行性加重。白细胞计数1.6×109/L,原细胞85%,血红蛋白11.4 g/dL,血小板计数23×109/L。纤维蛋白原水平135mg/dL,根据弥散性血管内凝血 (DIC) 的证据和根据存在 Auer 杆的原始细胞形态审查外周涂片后,怀疑诊断为APL。启动ATRA治疗,荧光原位杂交(FISH)证实存在PML::RARA重排。患者参加临床试验(NCT01409161)并开始ATRA和ATO联合治疗低危APL。为预防分化综合征,给予甲基强的松龙50mg静脉滴注,连续5天,从第6天开始逐渐减少剂量。在该周期的第二周,患者的周围水肿和呼吸困难恶化,白细胞增加至15×109/L。诊断为分化综合征,患者接受地塞米松10mg IV BID和一剂gemtuzumab ozogamicin,剂量为6mg/m2,并配合支持措施,在2-3天内DS的症状和体征得到缓解,随后类固醇剂量逐渐减少。
机制
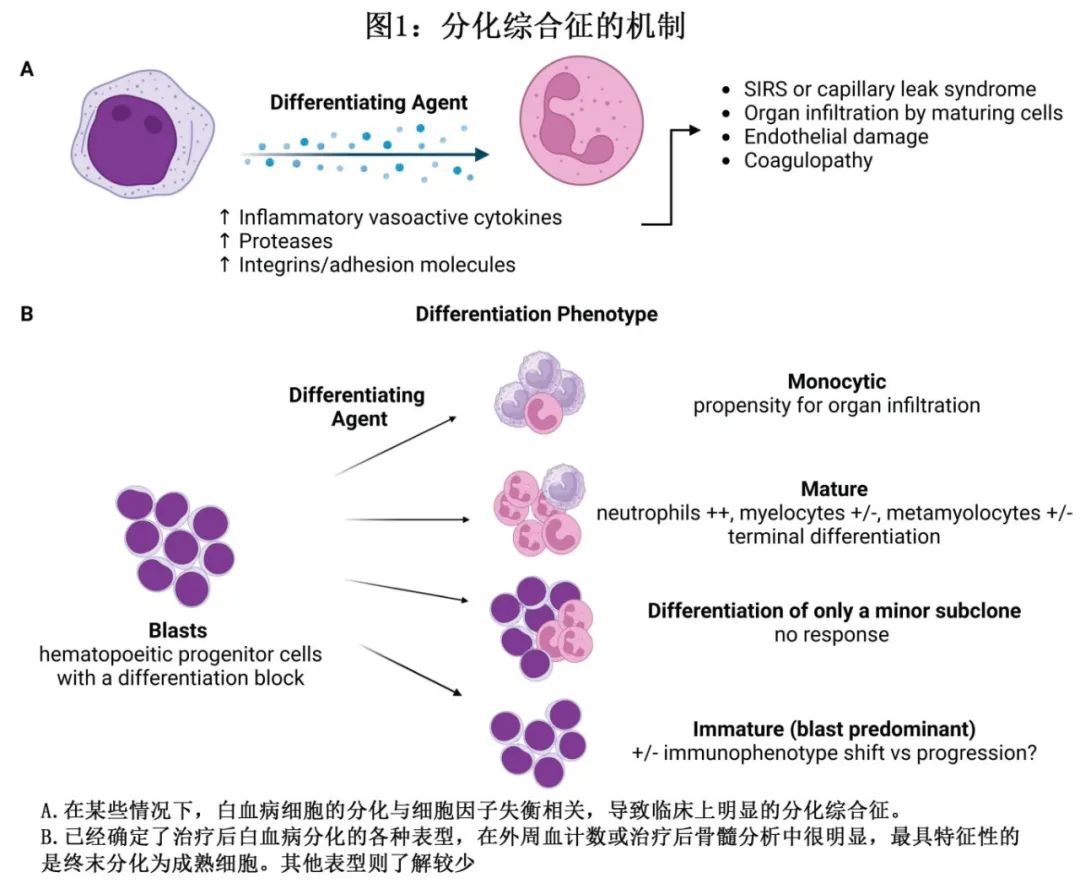
DS 的发病机制尚不完全明确,但认为其源于白血病细胞分化和成熟过程中大量细胞因子的产生,导致类似于全身炎症反应系统 (SIRS) 的高炎症状态,与血管毛细血管渗漏相关,并通过成熟细胞增加器官浸润(图1A)。目前对 DS 机制的大部分认识来自 ATRA 和/或 ATO 治疗 APL 的研究。涉及的炎性细胞因子包括白细胞介素 (IL)-1、IL-6、IL-8、肿瘤坏死因子α和 CCL2 或血清蛋白酶组织蛋白酶 G 的释放。β-2整合素的表达增加也与 DS 的病理生理学有关,导致白血病原始细胞与内皮和内皮下基质的粘附增加,并促进随后迁移和外渗到各种组织中。DS 患者肺组织切片证实存在间质浸润伴成熟粒细胞、小血管炎症和弥漫性肺泡损伤伴肺泡内出血。
诊断
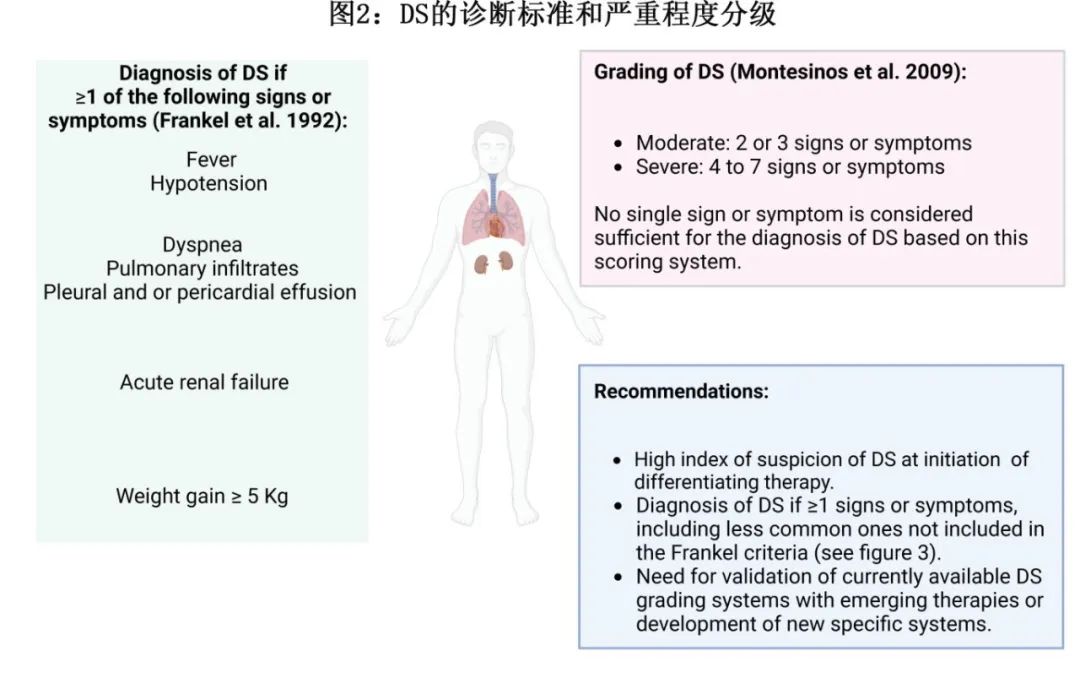
DS 的准确诊断仍极为困难,因其体征和症状非特异性;最常见的表现包括肺部表现(呼吸困难、缺氧、肺浸润和胸膜和/或心包积液)、体重增加、病原体培养阴性发热、低血压和肾功能不全,由 Frankel 等首次描述(图2)。
虽然基于描述 APL 中 DS 的多篇报道,这些表现最容易识别,但也报道了 DS 的其他不太常见的表现,并且迄今为止尚未完全阐明与最新型的分化剂(如 menin 抑制剂)相关的 DS 表征(图3A)。实验室检查结果包括白细胞增多,通常伴中性粒细胞计数升高和原始细胞百分比降低,但并不总是可见(图1B),因此,根据大多数标准,白细胞增多并非 DS 的诊断性特征。在一些与 IDH 或 menin 抑制剂相关的 DS 病例中,白细胞增多可能主要是单核细胞增多,使得区分 DS 与白血病进展更具挑战性(图1B)。影像学表现同样无特异性,胸部 X 线片表现为多数患者积液和浸润(图3B)。
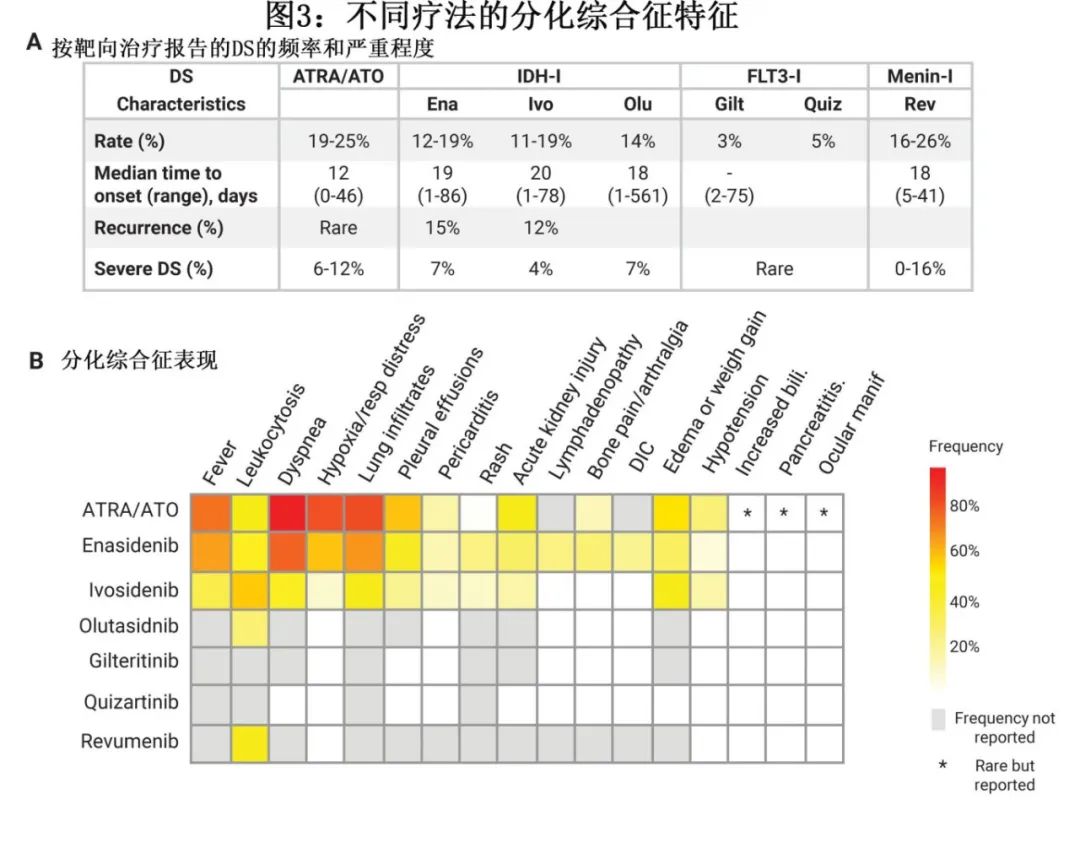
当新诊断的 APL 患者接受 ATRA 和 ATO 治疗10天后出现上述体征和症状时,DS的准确诊断相对简单(如病例1所示),根据 APL 诊断和分化药物治疗开始的时间线,可以准确识别非特异性体征和症状群为DS。然而,当这些表现出现于接受 IDH1 或 FLT3 靶向药物治疗的多重难治性 AML 挽救治疗第6周后时,通常会被错误地认为是未确诊的感染或持续性/进展性疾病,两者是同样合理的病因(甚至可能同时发生)(见下文病例2)。因此,当观察到这些非特异性结果时,精准诊断需要对 DS 的认识和高度怀疑。真正的 DS 确诊只能通过回顾来确定:在使用皮质类固醇治疗和支持治疗观察到体征和症状快速消退后,从而强调了需要关注对于其他基础病因的诊断和治疗,如隐匿性感染或充血性心力衰竭加重(尤其常见于白血病患者,原因包括年龄、心脏合并症、营养不良和频繁输血导致液体转移的频率),这一问题尤其必要。
DS 最被认可和使用的诊断原则包括 Montesinos 等基于 ATRA 和蒽环类药物治疗 APL 的 PETHEMA 研究提出的分级系统(图2)。在该评分系统中,具有≥4种 DS 体征或症状(呼吸困难、不明原因发热、体重增加>5 kg、不明原因低血压、急性肾衰竭和胸部 X 线检查伴肺浸润或胸膜心包积液)的患者视为重度DS,≤3种为中度DS。虽然该原则尚未在AML 其他靶向治疗相关的 DS 进行正式验证,但使用该分级系统以确保队列和试验之间的一致性是合理的。未来研究可集中于建立专门针对最新的分化剂且具有严重程度评分系统的诊断标准。
病例2
患者为72岁白人男性,既往有高血压和糖尿病病史,在阿扎胞苷和维奈克拉治疗后出现 AML 进展,遂接受 AML 评估。骨髓活检显示 AML 伴骨髓增生异常相关变化,原始细胞为50%,DNMT3A、IDH1和 KRAS 突变。WBC 为1.6x109/L,外周原始细胞为15%,血红蛋白为6.8 g/dL,血小板计数为43x109/L。开始接受艾伏尼布治疗,剂量为500mg每日一次。艾伏尼布治疗后3周因呼吸短促和胸膜炎性胸痛于急诊科就诊。实验室检查显示 WBC 为11.2x109/L,外周原始细胞为47%,单核细胞为35%,淋巴细胞为9%,中性粒细胞为3%,血小板计数为25x109/L /L。脉搏血氧饱和度为88%,需要使用鼻导管补氧。胸部 CT 显示弥漫性双侧毛玻璃样气腔阴影,主要位于肺的坠积(dependent)部分,伴少量右侧胸腔积液。患者入院,接受红细胞输注并开始经验性抗生素治疗肺炎,利尿剂和地塞米松 10 mg IV 每日两次用于治疗疑似分化综合征。暂停艾伏尼布给药,随后几天呼吸和氧合改善,患者出院,逐渐减少类固醇剂量,继续艾伏尼布500mg 每日一次给药。周期结束骨髓活检显示原始细胞减少至23%,但主要为单核细胞,血小板计数改善至56x109/L,WBC为3.4x109/L,血红蛋白为9.1g/dL。患者继续接受艾伏尼布治疗。
IDH抑制剂相关DS
艾伏尼布、olutasidenib或enasidenib治疗的IDH1或IDH2突变患者中有12-19%发生DS,大多数病例严重程度为中等,对皮质类固醇、羟基脲和支持治疗有反应(图3A)。但这三种抑制剂都有致死性DS的病例报道,并且由于DS风险,都带有FDA的黑框警告。
与APL相比,IDH抑制剂相关的DS发生的中位时间更长,至发生DS的中位时间为17-20天,也有报道称部分病例在使用enasidenib治疗后晚至150天,使用olutasidenib治疗后晚至561天(图3A)。特别值得注意的是,如病例2所示,发生DS与对IDH抑制剂的临床反应并不明显相关,这有点出人意料。DS与临床获益之间缺乏相关性可能是由于复发时存在多个白血病克隆,而非分化/无反应克隆阻止反应,或者可能是不成功的终端分化过程导致更多单核细胞但仍功能失调的白血病克隆(图1B)。
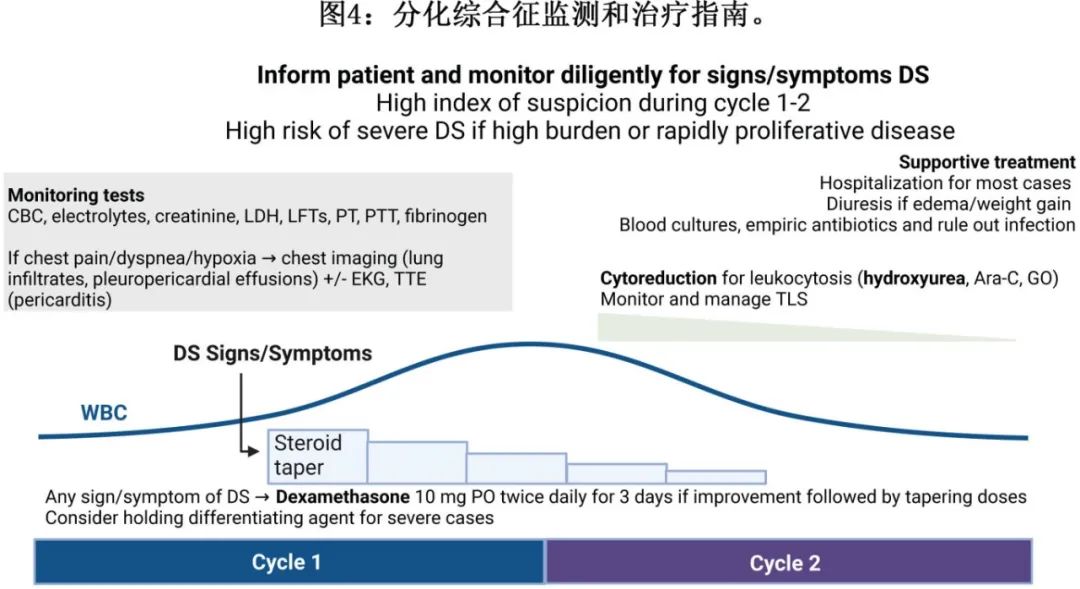
IDH 抑制剂的半衰期较长;艾伏尼布、olutasidenib和 enasidenib 的半衰期分别为4天、2.8天和8天。因此,虽然建议在重度 DS 病例中停止治疗,但尤其重要的是应认识到,IDH治疗的洗脱时间线需要数天,且皮质类固醇仍是立即治疗的主要药物(图4)。
FLT3抑制剂相关DS
FLT3抑制剂的 DS 发生率低于 ATRA 或 IDH 抑制剂,在各种 FDA 批准的 FLT3 抑制剂中估计为1-5%。在使用 FLT3 抑制剂的情况下发生的 DS 病例也可能更容易出现皮疹,且文献中有关于 Sweet 综合征(中性粒细胞性皮肤病)的报告。与 IDH-DS 相似,与 FLT3 抑制剂相关的 DS 症状发作通常为治疗开始后数周至数月(图3A)。尚无midostaurin发生 DS 的报告病例,可能与midostaurin联合强化疗使用相关,其中 DS 风险最小。与吉瑞替尼和quizartinib相关的 DS 报告病例相对较少,在单药治疗复发性或难治性疾病的患者中约有3-5%(图3A)。对吉瑞替尼临床研究中发生 DS 的11例患者进行审查,至 DS 发作时间为2-75天,9例患者痊愈;在关键性 ADMIRAL 研究中报告了1例吉瑞替尼相关致死性 DS 发作,故 FDA 发出黑框警告(图3A)。
值得关注的是,对接受quizartinib单药治疗的患者进行分析,通过细胞毒性或分化发现了两个明显不同的反应类别,并且吉瑞替尼组也发现了相似的二分反应模式;分化反应更常见于 NPM1 和/或 DNMT3A 共突变的患者。
Menin抑制剂相关DS
menin和赖氨酸甲基转移酶2A (KMT2A)之间蛋白-蛋白相互作用的小分子抑制剂可诱导依赖于该相互作用的急性白血病的髓系分化,最初的临床前和临床开发重点为携带KMT2A重排(KMT2Ar)或NPM1突变的AML。这类新小分子药物最早可能在2024年秋季获批用于治疗复发和难治性KMT2Ar急性白血病。与IDH和FLT3抑制剂一样,在接受menin抑制剂治疗的患者中,促进髓系分化可导致分化综合征。在脑膜蛋白抑制剂revumenib (SNDX-5613)的关键2期研究中,所有级别的DS为28%,≥3级的DS为16%;无5级DS事件记录。Ziftomenib (KO-539)和JNJ-75276617的1期研究中,所有级别DS的发生率分别为12%和20%。值得注意的是,ziftomenib和JNJ-75276617均报道了1例5级DS事件。由于交叉试验对比存在困难,特别是在1期研究中,尚不清楚临床试验中各种menin抑制剂之间DS的真实发生率和严重程度是否不同。同样,使用menin抑制剂的患者的DS严重程度是否会在联合治疗中减轻,以及其严重程度是否与其他分化剂不同,或者是否可通过靶向白血病基因型来减轻,这些问题也仍然未知。需要进一步的研究来更好地了解和预测使用menin抑制剂治疗后的反应和分化模式,以准确区分反应与分化、残留疾病和白血病进展(图1B)。
其他
临床开发中的许多其他小分子和靶向治疗涉及包括白血病原始细胞分化在内的作用机制,预期也会发生DS。其中一种药物FHD-286为染色质修饰剂,也是同类BRG1/BRM抑制剂的第一种,据报道其DS发病率为15%,值得注意的是,由于报告的DS致命病例,FDA于2022年将其全面临床搁置。有了足够的安全性和监测计划,FHD-286联合去甲基化药物治疗的临床试验重新开始。第二种药物为iaddemstat (ORY-1001),一种处于临床开发阶段的LSD1抑制剂,也与DS相关,27例接受治疗的患者中有1例出现致死性DS。
去甲基化药物(即阿扎胞苷和地西他滨)本身会导致DS。有趣的是,在阿扎胞苷和艾伏尼布联合与阿扎胞苷和安慰剂联合的随机AGILE研究中,阿扎胞苷和安慰剂组报告的DS发生率为8%(而联合组为15%)。
治疗
对于DS的主要和最有效的治疗为全身性皮质类固醇(图4)。对于任何疑似DS,建议立即开始静脉注射或口服地塞米松,剂量为10mg BID,持续至少3天,然后在症状缓解后逐渐减少。虽然不经治疗时DS可迅速致死,但立即开始使用皮质类固醇有效,死亡率<1%。
白细胞增多症在DS患者中很常见,发生率大于50%,皮质类固醇可进一步提高白细胞计数。强烈建议在白细胞计数>25×109/L(或急性早幼粒细胞白血病>10×109/L)时,同时使用羟基脲、gemtuzumab ozogamicin和/或阿糖胞苷进行减细胞治疗,以尽量减少包括DIC在内的其他白细胞淤滞并发症。虽然在这种情况下,在APL中通常优先使用gemtuzumab ozogamicin,但gemtuzumab ozogamicin在使用新型靶向药物后发生DS伴白细胞减少中的作用和有效性尚未得到很好表征。
建议重度 DS 患者停止靶向治疗(即住院、需要辅助供氧、血流动力学不稳定或白细胞增多> 50.0×109/L),直至 DS 症状消退。另外也要认识到,许多靶向治疗的半衰期较长,尤其是艾伏尼布、吉瑞替尼和 enasidenib 分别为4、5和8天,因此预计中止治疗不会导致及时的临床改善,此时必须再次强调一线皮质类固醇的重要性。
一旦 DS 改善,通常可以以初始剂量重新开始 DS 相关靶向治疗。这与 APL 中的文献一致,表明一旦患者获得完全缓解则DS风险消失,但在接受靶向抑制剂单药治疗的各种白血病克隆的复发患者中,这一情况可能更复杂,因为部分克隆可能比其他更耐药的亚克隆分化和反应更快或更成功。事实上,在少数发生 IDH-DS 的患者中报告了 IDH 突变患者的 DS 复发,初次和二次发作之间的中位时间约为3周,表明类固醇减量较慢可能对持续或重度症状患者有益(图3A)。
此外,同时治疗可能或疑似的并发疾病(如感染或充血性心力衰竭恶化)也至关重要,因为许多复发性或难治性 AML 患者的临床表现可能有多种竞争性病因。
DS的预防
在 APL 治疗方案中通常使用皮质类固醇预防性给药以预防或尽量减少DS,因为回顾性分析显示 DS 相关发生率、严重程度和并发症有所减少,但对 DS 相关死亡率无明确影响。是否在前1-2周或整个第一个月给予预防性皮质类固醇,以及是否仅为发生白细胞增多的患者保留预防性类固醇或给予所有 APL 患者,这些问题仍存在争议。目前 APL 管理的专家意见建议,DS 高危患者使用预防性皮质类固醇(泼尼松0.5-1 mg/kg每日或地塞米松10 mg BID),高危患者定义为白细胞计数高于5-10×109/L或肌酐升高/肾功能不全 (>1.4mg/dL)(表1)。
由于接受靶向治疗的复发性白血病患者中发生DS的时间线较长(即数月,而非数天/数周),以及中性粒细胞减少症的既往持续时间延长和真菌和其他感染的风险增加,目前不建议在 APL 以外使用预防性皮质类固醇。但考虑到 DS 与疾病负荷的相关性,建议在开始IDH、FLT3、menin抑制剂或其他分化靶向药物治疗前,对白细胞增多进行减细胞治疗,将 DS 和白细胞淤滞并发症(包括DIC)的发生率和严重程度降至最低,因为DS与肿瘤负荷具有相关性。
总之,预期和早期识别与 AML 靶向治疗相关的 DS 对于成功给药至关重要。DS 预防还应包括告知患者 DS 的可能表现,在不同药物治疗的前两个月内提高意识,以及早期开始皮质类固醇治疗 DS 相关体征和症状。需要精心设计的临床和转化研究来更好地阐明 DS 的潜在机制,并确定未来进一步降低 DS 相关发病率和死亡率的最佳诊断和治疗策略。
参考文献
Issa GC,et al.How I Treat: Differentiation Therapy in Acute Myeloid Leukemia.Blood . 2024 Jul 8:blood.2024024008. doi: 10.1182/blood.2024024008.


