上海交通大学口腔医学院张雷课题组AHM:DNA四面体递送miR-21-5p协同调控成骨/成血管生成促进衰老骨缺损修复
时间:2024-07-21 06:01:04 热度:37.1℃ 作者:网络
随着社会老龄化进程的深入,由肿瘤切除、创伤和药物滥用等各种内源性或外源性病因引起的老年人骨缺损修复,仍是临床实践中不可避免的挑战。虽然自体骨移植是骨修复的金标准,但供区骨量不足,存在第二术区损伤等问题依然难以解决。近年来,组织工程和再生医学的快速发展为解决衰老骨缺损修复这一难题提供了新的思路。成骨和成血管能力的下降是衰老细胞的重要特征,也是导致骨修复失败或预后不良的重要原因。基因治疗已成为骨组织修复和再生的一种有前景的治疗策略,miRNA是一类非编码RNA,通过靶向mRNA的3'UTR端,在调节细胞增殖、成骨和成血管中发挥重要作用。然而,miRNA因其不稳定,易被不同生物酶降解的缺陷,限制了其在临床上的广泛应用。因此,迫切需求选择合适的miRNA递送系统,安全高效的递送miRNA,从而提高衰老骨修复的治疗效率。近日,上海交通大学医学院附属第九人民医院/上海交通大学口腔医学院张雷教授,沈国芳教授团队首先分离提取了衰老骨髓间充质干细胞(O-BMSCs)和衰老内皮祖细胞(O-EPCs),并发现与年轻细胞相比,衰老细胞的成骨和成血管能力显著下降。以此为切入点,结合转录组测序选取miR-21-5p为靶点,基于DNA四面体,构建了一种兼具成骨成血管适配衰老骨缺损修复的TDN-miR-21-5p基因递送纳米复合物。TDN-miR-21-5p在促进体内外成骨,成血管,降低衰老相关表型方面展现出显著的优势。这种低成本、高效的基因递送系统为临床治疗衰老骨缺损提供了一种潜在新方案,同时也拓宽了基于TDN的基因治疗的临床应用。

方案1展示了DNA四面体通过自组装的形式设计和制备了TDN-miR-21-5p纳米复合物。TDN-miR-21-5p通过GelMA水凝胶的递送可用于衰老大鼠颅骨临界缺损的修复,并伴有成骨和成血管相关指标的上升。TDN-miR-21-5p可通过激活AKT和Erk信号通路直接促进O-BMSCs的成骨,减少衰老相关表型;亦可通过刺激O-EPCs分泌促血管生成因子间接介导O-BMSCs的成骨和衰老。研究者相信,TDN-miR-21-5p的开发可为衰老骨组织修复提供一种新的策略,展现出潜在的临床应用前景。
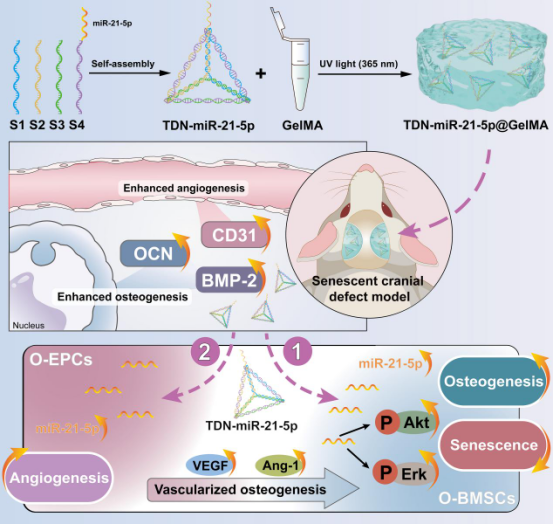
方案1. TDN-miR-21-5p纳米复合物模式图,以及其在体外和体内对衰老骨修复成骨和血管生成的影响。
图1展示了基于DNA四面体的TDN-miR-21-5p纳米复合物的自组装过程,并通过琼脂糖凝胶电泳、TEM、AFM等方法进行TDN 和 TDN-miR-21-5p的鉴定。孵育 12 小时后, O-BMSCs和 O-EPCs中细胞摄取 ssDNA、TDN 和 TDN-miR-21-5p 的荧光图像。
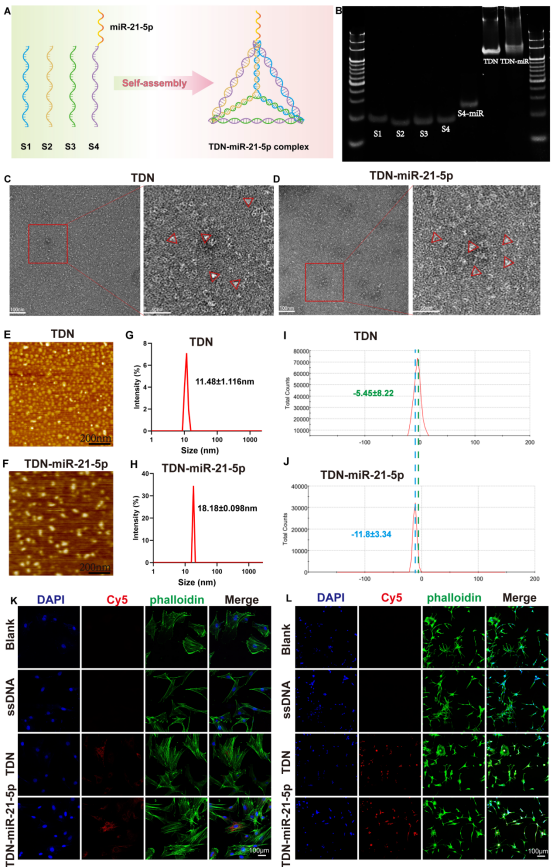
图1. TDN-miR-21-5p纳米复合物的合成和表征。
图2展示了TDN-miR-21-5p 促进 O-BMSCs 成骨的能力。将O-BMSCs与TDN 和 TDN-miR-21-5p共培养发现TDN-miR-21-5p具有促进O-BMSCs成骨分化,降低其衰老相关表型的能力。此外,qRT-PCR检测O-BMSCs成骨分化及衰老基因水平的变化。成骨相关基因ALP、BMP-2、Col-1、OPN及衰老相关基因SATB2在TDN-miR-21-5p处理后均明显升高,且TDN组也有一定程度的升高;而衰老相关基因p53、p16在TDN-miR-21-5p组均明显低于TDN组及con组。Western blot结果显示TDN-miR-21-5p诱导O-BMSCs成骨分化更明显,BMP-2及Runx2的蛋白表达明显增加。免疫荧光染色也表明,与 TDN-miR-21-5p 共培养后,BMP-2 和 Col-1 成骨相关蛋白显著增加。上述实验表明,TDN-miR-21-5p能有效促进成骨分化,缓解衰老相关表型,而TDN在一定程度上也发挥积极作用。
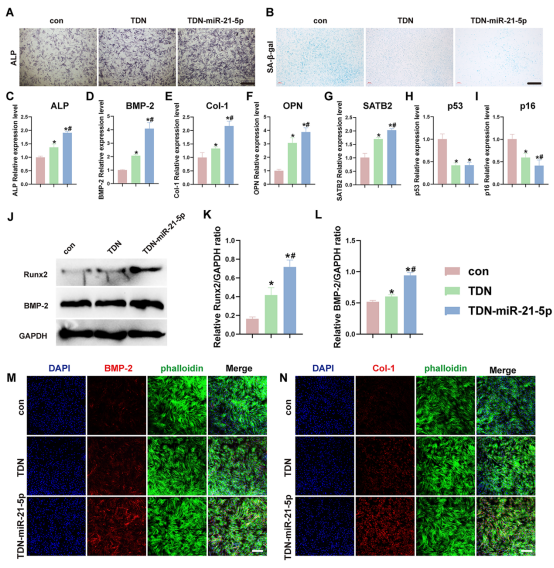
图2. TDN-miR-21-5p 促进 O-BMSCs 成骨,降低衰老相关表型。
图3通过生物信息学分析预测了TDN-miR-21-5p介导O-BMSCs成骨和血管生成密切相关的潜在信号通路。从KEGG的气泡图来看,MAPK和AKT信号通路与本研究中的生物学功能密切相关。该部分展示了TDN-miR-21-5p和TDN刺激后,p-p38和p-JNK的表达保持不变,p-AKT和p-Erk显著增加。这提示AKT和Erk信号通路可能与TDN-miR-21-5p介导的O-BMSCs成骨及衰老有关。
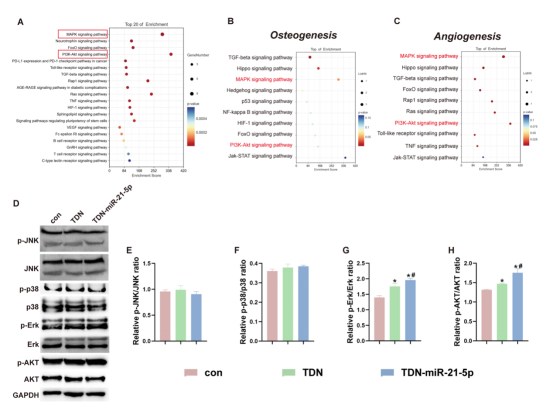
图3. TDN-miR-21-5p对潜在信号通路的预测和激活。
图4通过信号通路抑制实验进一步验证AKT和Erk信号通路参与TDN-miR-21-5p介导的成骨和衰老。结果显示,两种通路的抑制剂LY294002和SCH772984分别可以显著抑制AKT和Erk通路的激活,并在一定程度上抑制了成骨分化的增强。相反,SA-β-Gal染色显示加入两种通路抑制剂可以增加阳性染色细胞。此外,两种抑制剂可以抑制成骨相关基因的表达上调并恢复衰老相关基因的的表达下调。蛋白印迹实验和免疫荧光染色从蛋白层面得到同样的结果。总之,这些结果表明TDN-miR-21-5p可以通过直接激活AKT和Erk信号通路来介导衰老成骨和衰老,这为后续治疗衰老骨修复的研究提供了新的方向。
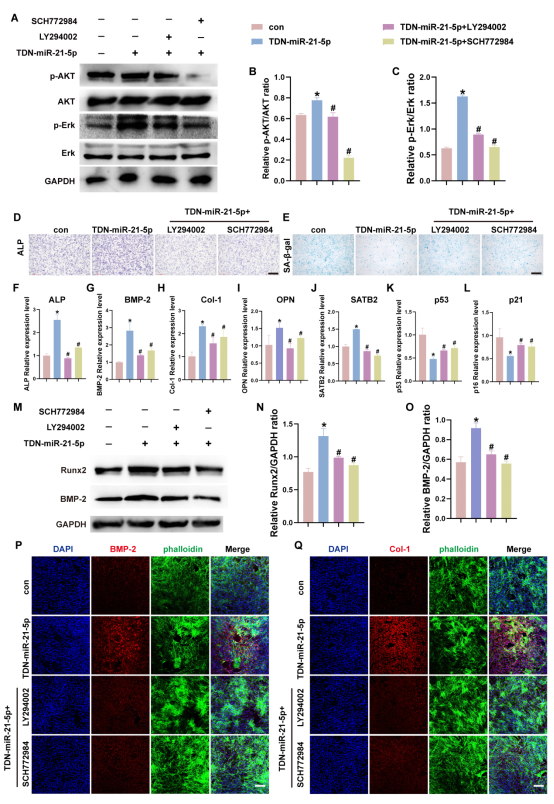
图4. TDN-miR-21-5p 通过 AKT 和 Erk 通路直接介导 O-BMSCs 的成骨和衰老。
图5展示TDN-miR-21-5p可促进O-EPCs血管生成。qRT-PCR结果表明,与TDN组和con组相比,TDN-miR-21-5p可上调Ang-1、bFGF和VEGF等促血管生成基因的显著上调,同时TDN也在一定程度上诱导了促血管生成基因的增加。此外,通过划痕实验和Transwell表明TDN-miR-21-5p可促进O-EPCs细胞迁移。成管实验展示了TDN-miR-21-5p显着增强了O-EPCs的管形成能力。
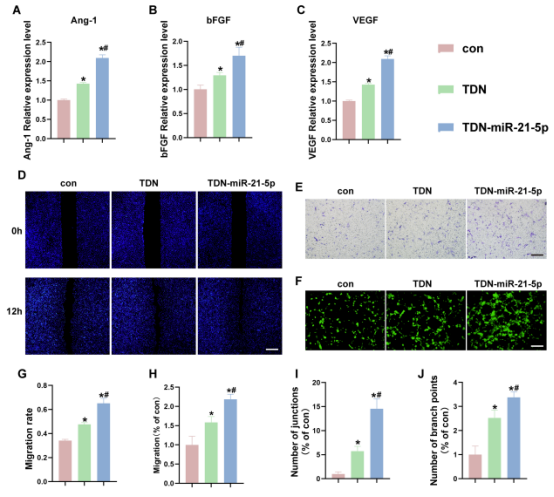
图5.TDN-miR-21-5p 促进 O-EPCs 的血管生成。
血管生成是骨骼发育和修复最重要的调节因素之一,已被广泛认为是成骨的前提。因此,图6分离TDN-miR-21-5p刺激的O-EPCs条件培养基,探索O-EPCs对O-BMSCs成骨和衰老的影响。ALP染色表明加入TDN-miR-21-5p条件培养基后,O-BMSCs的成骨分化显著改善。相反,SA-β-Gal染色显示TDN-miR-21-5p组衰老阳性染色细胞减少。此外,经TDN-miR-21-5p条件培养基处理后,O-BMSCs中成骨相关基因和衰老相关基因的表达水平也显著改变。同样,蛋白印迹和免疫荧光染色也显示TDN-miR-21-5p条件培养基处理后,O-BMSCs的成骨相关表达显著上调。因此,以上证据表明,TDN-miR-21-5p不仅可以直接改善O-BMSCs和O-EPCs的功能,还可以通过间接刺激O-EPCs分泌促血管生成因子来恢复O-BMSCs的成骨分化,降低其衰老相关表型。
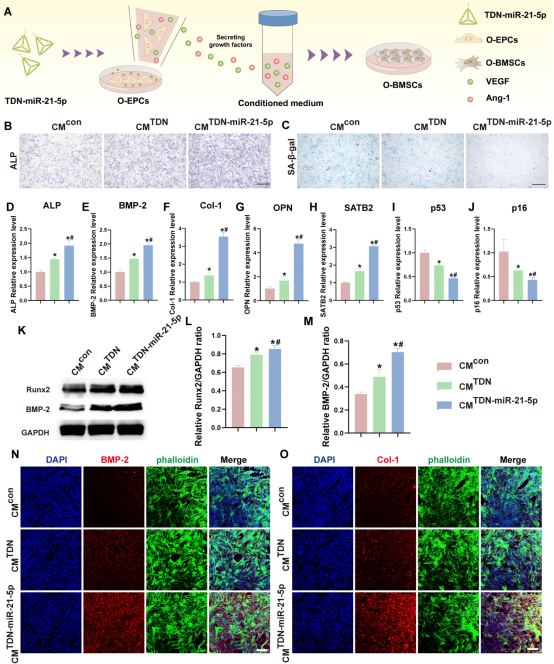
图6.TDN-miR-21-5p通过间接刺激O-EPCs分泌的生长因子介导O-BMSCs的成骨和衰老
修复骨缺损时,生物材料支架是递送TDN或TDN-miR-21-5p的必需品。明胶-甲基丙烯酰(GelMA)水凝胶具有良好的可塑性,被认为是骨组织工程中有前途的递送载体。图7选择GelMA水凝胶来封装和递送TDN或TDN-miR-21-5p以进行体内应用。将TDN-miR-21-5p@GelMA支架植入颅骨缺损,12周后micro-CT结果显示TDN-miR-21-5p@GelMA组的骨再生效果优于其他组。组织学染色也表明TDN-miR-21-5p@GelMA组在缺损处间隙中可观察到大量新骨形成,而TDN@GelMA组和GelMA组在缺损处的边缘区域观察到少量新骨,而空白组缺损处观察到大量纤维。
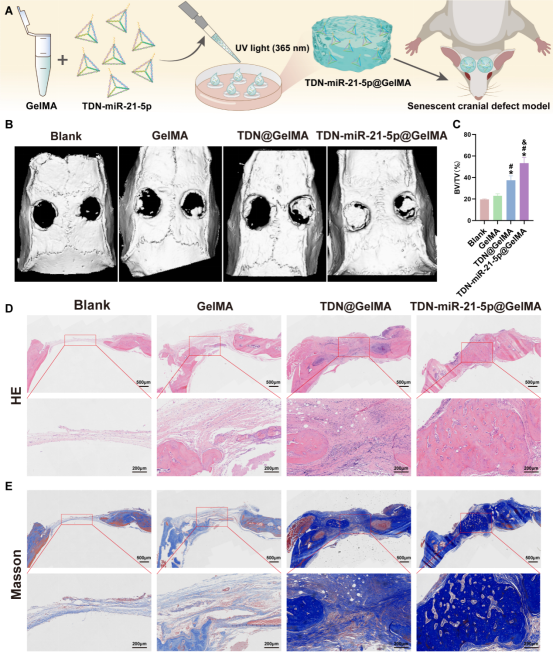
图7. TDN-miR-21-5p@GelMA 促进衰老缺损修复
图8通过免疫组织化学分析各组体内血管生成和成骨作用。TDN-miR-21-5p@GelMA组的CD31表达水平明显高于其他组,并且成骨标志物OCN和BMP-2在TDN-miR-21-5p@GelMA组中呈高阳性表达,TDN@GelMA和GelMA组也有一些阳性染色的细胞,而空白组阳性染色的细胞很少。综上,研究结果表明从GelMA支架中释放的TDN-miR-21-5p可以促进原位血管化骨再生,从而完成衰老骨缺损中的新骨形成。
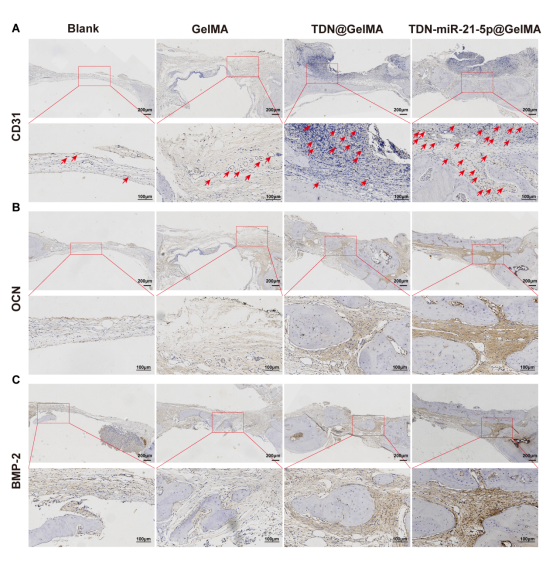
图8. TDN-miR-21-5p@GelMA促进衰老骨缺损中成骨成血管指标的表达
综上,TDN-miR-21-5p的合成可促进O-BMSCs的成骨分化,缓解衰老相关表型,同时改善O-EPCs的血管生成。值得注意的是,TDN-miR-21-5p可以直接激活AKT和Erk信号通路促进O-BMSCs成骨,减缓其衰老;也可以通过刺激O-EPCs分泌促血管生成生长因子介导和O-BMSCs成骨衰老。此外,TDN-miR-21-5p@GelMA支架能有效修复衰老大鼠临界颅骨缺损,并显著增加成骨和成血管相关标志物的表达。总的来说,TDN-miR-21-5p被证实是递送miR-21-5p的良好纳米载体,这提供了一种新的衰老骨修复候选策略。此外,此研究也提示了基于TDN的纳米载体能够更加有效的扩展到其他衰老的临床情景之中,进一步拓宽了TDN的临床应用。
相关工作以题为“DNA tetrahedron delivering miR-21-5p with synergistic regulation of osteogenesis and angiogenesis for promoting senescent bone defects repair”的论文发表在《Advanced Healthcare Materials》上。上海交通大学医学院附属第九人民医院张雷教授,沈国芳教授,蒋伟东博士为通讯作者,祁磊博士,洪社斌博士,赵桐博士为第一作者。
原文链接:
https://pubmed.ncbi.nlm.nih.gov/38979868/


