【衡道丨干货】2024 非小细胞肺癌的分子病理新进展
时间:2024-07-28 17:00:43 热度:37.1℃ 作者:网络
肺癌在组织学上主要分为腺癌、鳞状细胞癌、大细胞癌和高级别神经内分泌肿瘤,高级别神经内分泌肿瘤包括小细胞癌和大细胞神经内分泌癌。每种肺癌类型都表现出独特的临床病理特征。随着测序技术的大量应用,研究者揭示了每种肺癌类型的分子特征。根据这些测序研究,可以开发靶向治疗药物。免疫治疗,特别是使用免疫检查点抑制剂(ICI),抑制PD-1或PD-L1的治疗方法,已成为非小细胞肺癌(NSCLC)的一种主要治疗方法。在联合免疫治疗和化疗的情况下,患者的预后显著改善。这些治疗方法,需对应不同的肺癌分子改变。
2024年1月,日本东京国立癌症中心的Yasushi Yatabe为通讯作者,在病理学知名期刊《Histopathology》上发表题为“Molecular pathology of non-small cell carcinoma”的综述性文章,详尽阐述了非小细胞肺癌的分子病理特点及研究进展。

本期甘肃省人民医院病理科陈旭医生结合新版2024年CSCO非小细胞肺癌指南,将这篇综述要点编译如下,供相关医师参考。
针对驱动基因突变的分子靶向药物
肺癌的许多基因改变,是治疗干预的潜在靶点。常见的为EGFR、ALK、ROS1、BRAF、HER2、MET和RET的改变,相关的激酶抑制剂作为分子靶向药物已广泛应用于临床。驱动突变在肿瘤早期阶段获得,激活信号驱动肿瘤形成,如果没有驱动突变,肿瘤就不会持续存在。非小细胞肺癌对驱动突变抑制剂的反应显著,明显高于普通化疗。具有驱动突变的非小细胞肺癌,好发于二手烟吸入者及较低突变负荷的患者中。虽然这些驱动改变特征是共同的,但个体改变表现出不同的特征。
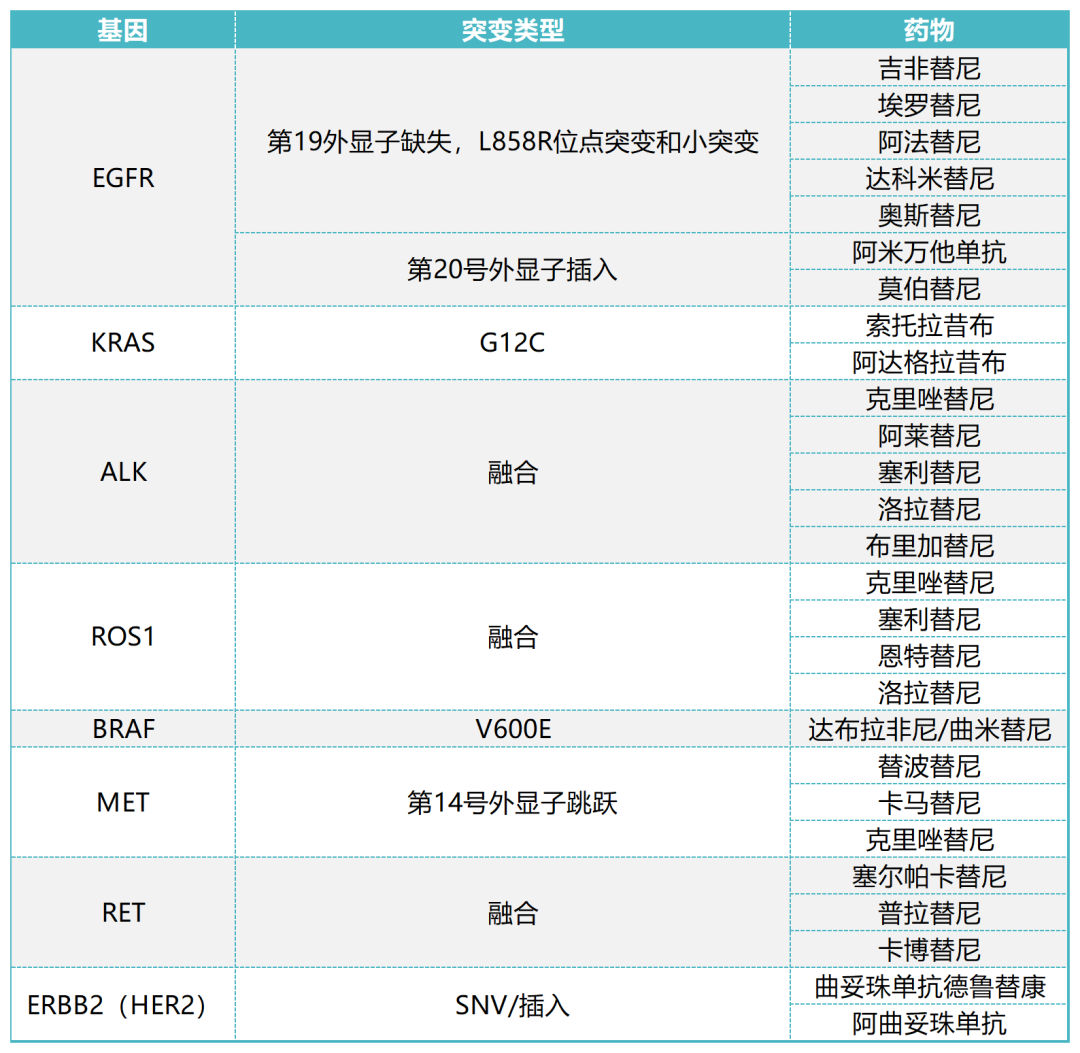
表1.已批准的分子靶向药物汇总表
EGFR突变
吉非替尼是首个EGFR酪氨酸激酶抑制剂,在2002年获得批准应用。仅有少部分患者对吉非替尼的治疗具有高反应性,这常见于女性、不吸烟患者,以及腺癌患者及亚洲患者。2004年的研究发现,EGFR激酶结构域的点突变和插入突变是主要的改变,可以导致下游信号通路的结构性激活。第21外显子的p.L858R位点突变,和第19外显子的框内缺失,是EGFR基因的两个热点突变,超过90%,其他突变,包括G719密码子和第20外显子的框内插入突变。EGFR突变与其他驱动基因的改变,如KRAS、ALK、ROS1、BRAF、RET和ERBB2,相互排斥。EGFR突变的肿瘤,通常表现为腺癌形态,以及贴壁生长型和乳头状亚型。携带p.R776G, p.R776H, p.T790M, p.V843I和p.P848L突变的患者,其肺腺癌发生的风险较高。临床上,EGFR突变,与EGFR酪氨酸激酶抑制剂治疗应答反应,以及患者预后相关。
在2024版CSCO非小细胞肺癌指南中
针对EGFR敏感突变治疗,指南新增内容如下:
①新增“贝福替尼治疗”为I级推荐
-
贝福替尼于2023年10月12日获国家药品监督管理局(NMPA)批准用于EGFR外显子19缺失或外显子21 L858R位点置换突变的局部晚期或转移性NSCLC成人患者的一线治疗。
②新增“奥希替尼联合化疗”为II级推荐
-
奥希替尼联合铂类化疗于2024年2月16日获美国食品药品监督管理局(FDA)批准用于EGFR外显子19缺失或外显子21 L858R置换突变的局部晚期或转移性NSCLC患者的一线治疗。
针对EGFR 20号外显子插入突变治疗,指南新增内容如下:
①新增“Amivantamab联合含铂双药化疗”为Ⅲ级推荐
-
Amivantamab联合卡铂和培美曲塞于2024年3月1日获FDA批准用于一线治疗EGFR exon20ins局部晚期或转移性NSCLC,成为EGFR ex20ins突变晚期NSCLC的首个一线靶向治疗方案。
②新增“舒沃替尼治疗”为I级推荐
-
舒沃替尼于2023年8月23日获NMPA批准,用于既往经含铂化疗出现疾病进展,或不耐受含铂化疗,且经检测确认存在EGFR ex20ins局部晚期或转移性NSCLC患者。
KRAS突变
KRAS是西方患者中最常见的突变致癌基因,约占肺腺癌的30%。KRAS及其同源物NRAS,和HRAS,属于RAS GTPase蛋白家族,在各种细胞表面受体的信号转导中(EGFR、ALK和HER2/ERBB2)作为分子开关。KRAS G12密码子的单核苷酸替换最为常见(> 80%),其中G12C是最常见的改变(约40%),其次是G12V和G12D(分别约为20%和15%)。与EGFR突变相似,KRAS突变具有种族差异,这与吸烟文化相关联。组织学上,大多数KRAS突变患者(约90%)表现为腺癌。特别是,浸润性黏液腺癌与高频率的KRAS突变相关(约为60%)。最近,研究者已经开发出了针对KRAS G12C突变的药物。
ALK融合
目前,ALK融合参与肺、甲状腺、鼻咽、软组织、肾脏、结肠直肠和膀胱肿瘤的发生。EML4::ALK融合最常见(>90%),几乎只发生于肺癌。在NSCLC中,ALK融合常见于年轻患者。组织学上,ALK融合最常见于腺癌,常为腺泡和实体亚型,以及筛状或印戒细胞亚型。ALK融合可预测患者对ALK抑制剂的反应,但对预后没有影响。
在2024版CSCO非小细胞肺癌指南中
针对ALK融合阳性治疗,指南更新内容如下:
①新增“阿来替尼”“布格替尼”“洛拉替尼治疗”作为I级推荐的优先推荐。
②新增“伊鲁阿克治疗”为I级推荐,同时新增“伊鲁阿克”为克唑替尼耐药后I级推荐。
伊鲁阿克于2024年1月16日获NMPA批准用于ALK融合阳性局部晚期或转移性NSCLC的一线治疗。
BRAF突变
在NSCLC中,超过50%的BRAF突变为非V600E型,在黑色素瘤、结直肠癌和甲状腺乳头状癌中,以BRAF V600E突变为主。在NSCLC中,与BRAF 非V600E相比,BRAF V600E与低肿瘤突变负荷(TMB)、高PD-L1表达、远处转移率、胸膜浸润率相关。此外,BRAF突变的患者对ICI治疗的临床反应较低。
在2024年CSCO非小细胞肺癌指南中
针对BRAF突变,指南新增“Encorafenib+Binimetinib”为III级推荐。Encorafenib联合Binimetinib于2023年10月11日获FDA批准用于治疗BRAF V600E突变转移性NSCLC患者。
ROS1融合
与ALK类似,ROS1激酶结构域(外显子36-41)总是保留在融合产物中,融合导致下游靶点激活,如PI3K-AKT通路。ROS1融合主要见于NSCLC,腺癌常见,但在胶质母细胞瘤、胆管癌和炎性肌纤维母细胞瘤中也有报道。ROS1融合与血栓栓塞相关。
在2024年非小细胞肺癌CSCO指南中
针对ROS1融合,指南新增“Repotrectinib”为III级推荐。Repotrectinib于2023年5月10日被CDE纳入优先审评审批,并于2023年11月15日获FDA批准用于治疗ROS1融合阳性的局部晚期或转移性NSCLC成人患者。
RET融合
RET突变、融合和扩增在各种类型的癌症中被检测到。1-2%的NSCLC中可以检测到RET融合,对于融合的患者,NCCN指南建议使用塞珀卡替尼或普赛替尼治疗。在肺癌中,KIF5B::RET占RET融合的70%,RET融合主要发生在年轻女性,不吸烟者和腺癌患者。
在2024年非小细胞癌CSCO指南中
针对RET融合,指南更新内容如下:
①“塞普替尼”的I级推荐的证据类型由3类改为1类。塞普替尼于2022年9月30日获NMPA附条件批准用于治疗RET融合阳性NSCLC患者;
②上调“普拉替尼”为I级推荐。普拉替尼于2023年8月9日获FDA常规批准,于2023年6月26日获NMPA批准用于RET融合阳性NSCLC成人患者的一线治疗。
HER2突变
HER2通过三种主要改变(扩增、过表达和HER2突变)参与致癌作用,所有改变都导致受体酪氨酸激酶激活。最近,一些针对HER2改变的药物已经被开发出来,并且HER2突变首次被批准作为肺部的靶点。20号外显子插入是最常见的突变(约70%),特别是A775_G776insYVMA。然而,不能通过免疫组化对HER2突变进行筛选。HER2突变的肿瘤,在女性患者、从不吸烟或轻度吸烟患者,以及腺癌患者中普遍存在。与其他改变相比,微乳头状腺癌中HER2突变比例更高。中枢神经系统转移,在有HER2突变的肺癌中,比没有HER2突变的肺癌更常见。
在2024年非小细胞肺癌CSCO指南
针对HER2突变,指南上调“德曲妥珠单抗”为II级推荐。德曲妥珠单抗于2022年8月11日获FDA加速批准用于治疗既往接受过全身治疗的不可切除或转移性HER2突变NSCLC,于2024年1月3日获CDE授予突破性治疗药物认定。
MET14号外显子跳跃突变
MET在癌症中可以扩增、突变和融合。在NSCLC中,剪接位点周围的无义突变和插入突变,导致第14外显子跳跃,导致MET蛋白降解受损。MET抑制剂,替波替尼和卡马替尼,已被批准用于MET第14号外显子跳跃突变的靶向治疗。临床病理上,腺癌是最常见的MET14号外显子跳跃突变的组织学类型,但鳞状细胞癌和其他类型的非小细胞肺癌也可以存在这种改变,尤其在肉瘤样癌中。
在2024年非小细胞肺癌CSCO指南中
针对MET14号外显子跳跃突变,指南更新如下:
①上调“特泊替尼”为I级推荐。特泊替尼于2021年2月3日获FDA加速批准,2023年12月5日获得NMPA批准用于治疗MET 14外显子跳跃突变晚期或转移性NSCLC。
②新增“谷美替尼”为I级推荐。谷美替尼于2023年3月8日获NMPA附条件批准用于MET 14外显子跳跃突变的局部晚期或转移性NSCLC的治疗。
③新增“伯瑞替尼”为I级推荐。伯瑞替尼于2023年11月16日获得NMPA附条件批准用于MET 14外显子跳跃突变局部晚期或转移性NSCLC的治疗。
驱动基因改变特点
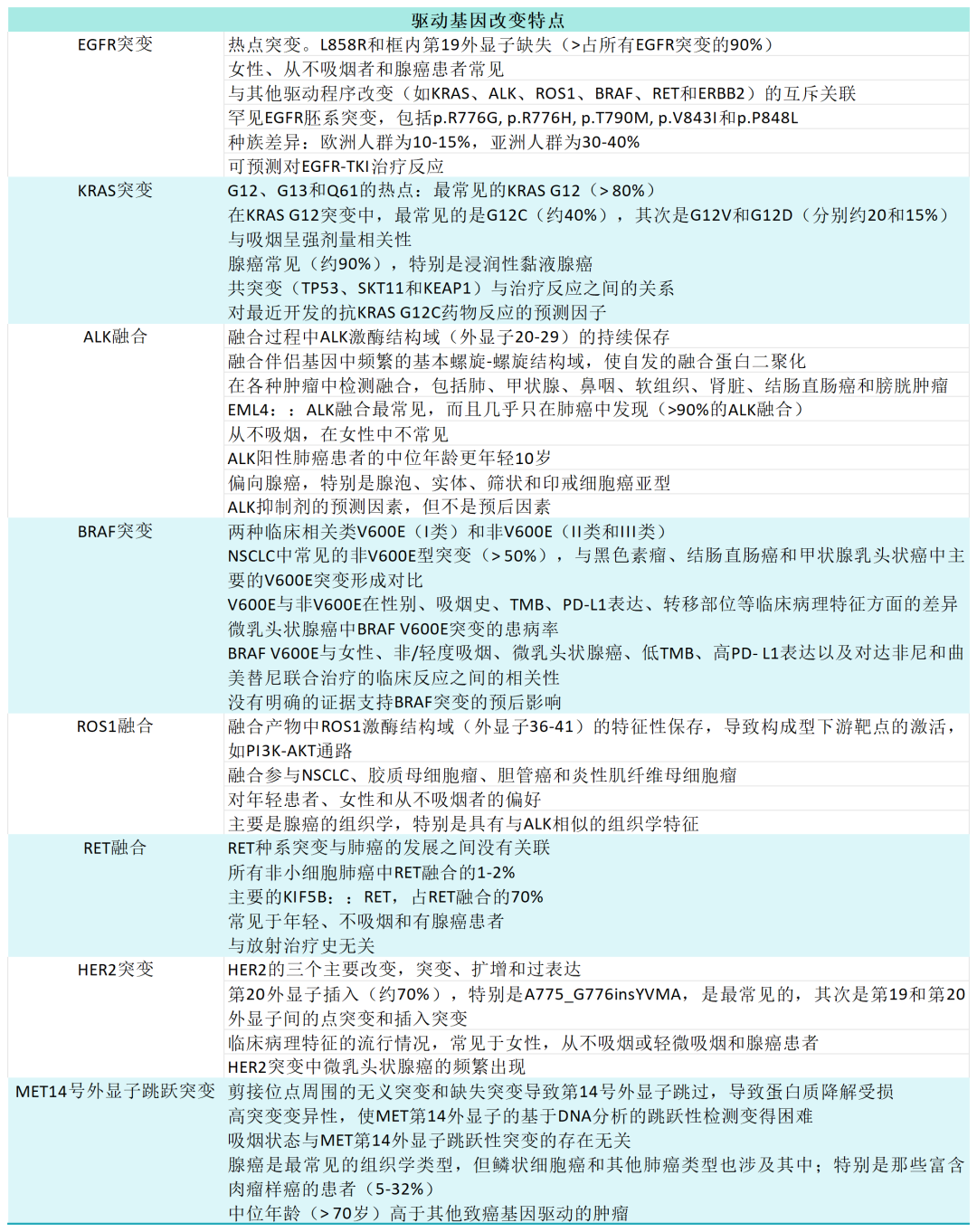
表2.驱动基因改变特点
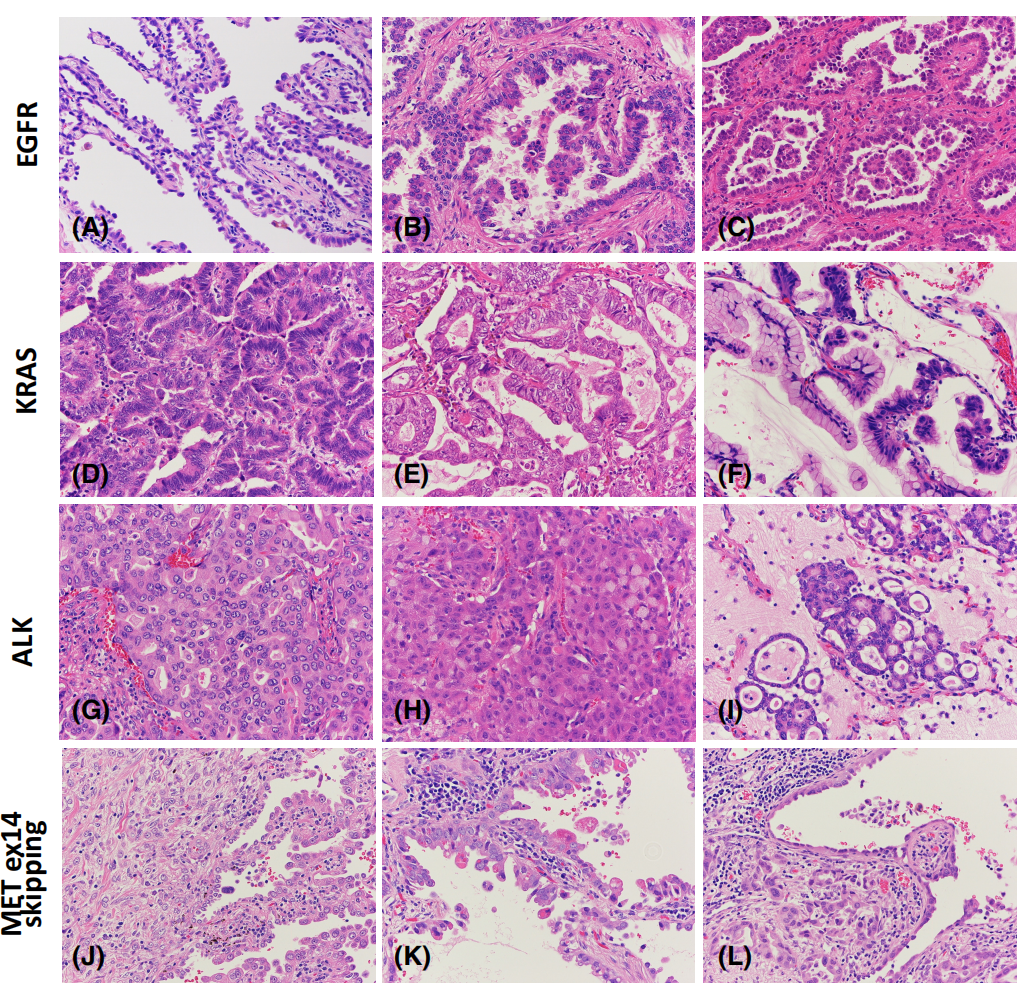
图1.具有EGFR、KRAS、ALK和MET第14外显子跳跃突变的腺癌的形态学变化。EGFR突变更常出现在腺癌(A-C)的贴壁、乳头状和微乳头状亚型。除浸润性黏液腺癌(F)外,具有KRAS突变的腺癌倾向于表现出更高的核级别(D,E)。在伴有ALK融合的腺癌中,筛状(G)、印戒细胞特征(H)或实体生长模式更为常见。由于丰富的粘蛋白,ALK阳性腺癌可能模仿浸润性黏液腺癌,尽管细胞极性仍然不同;ALK阳性肿瘤常表现为向肺泡腔方向的闭合腺体(I)。MET第14外显子跳跃在多形性癌(J)中富集,除了传统的腺癌形态具有高级别核特征(K)和从贴壁到其他高级别成分陡然转变(L)。在MET第14外显子跳跃性阳性肿瘤(K)中也描述了细胞质透明球。所有的图像都来自每个肿瘤的带有标记的驱动突变的代表性区域。
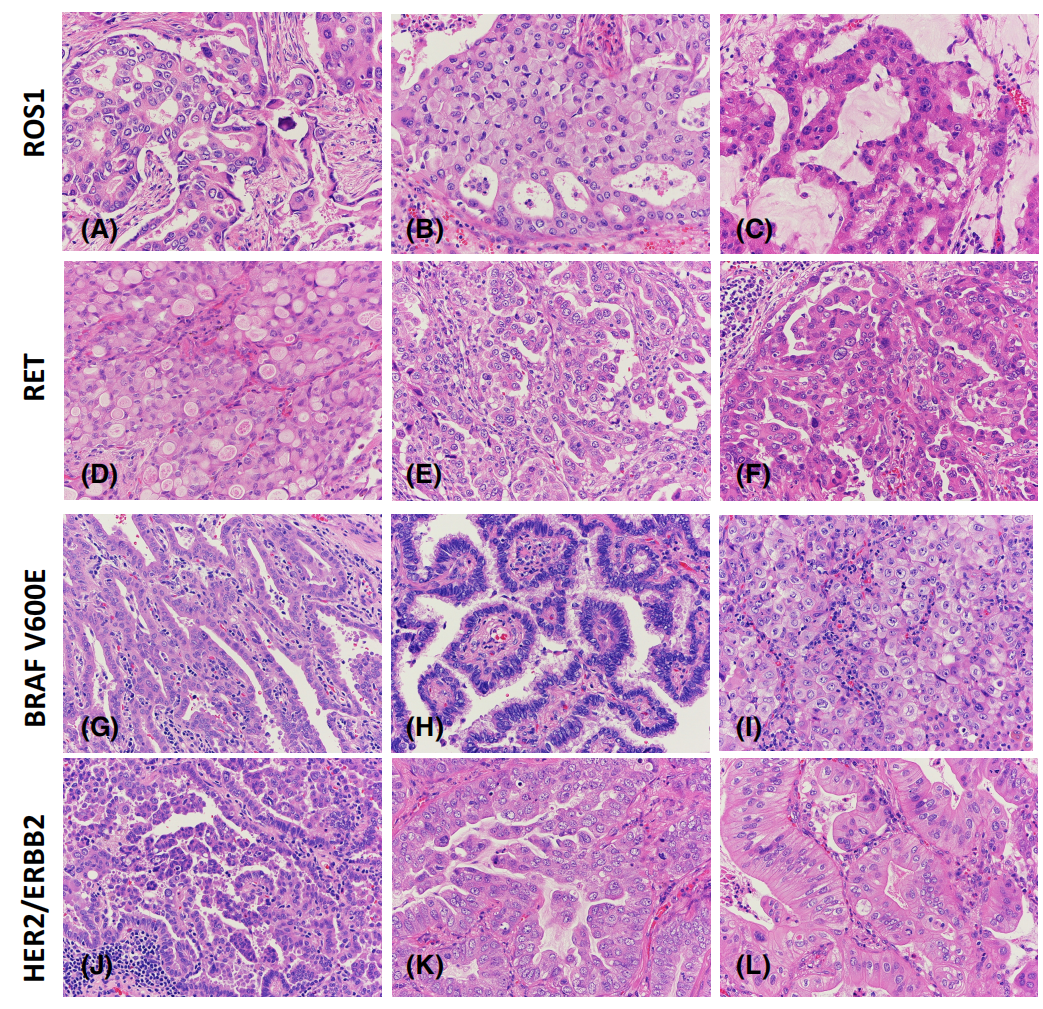
图2.具有ROS1、RET、BRAF V600E和HER2/ERBB2驱动因素改变的腺癌的形态学变化。ROS1融合阳性肿瘤的形态学特征与ALK融合阳性肿瘤相似,包括筛状(A)或实体生长模式(B)和印戒细胞(B)或粘液特征(C)。砂砾体沉积也被报道(A)。在RET融合阳性肿瘤中,除了传统的乳头状和实体生长模式外(E,F),胞质粘蛋白也是特征(D)。BRAF V600E突变的腺癌可以显示出所有的生长模式,包括贴壁、乳头状、腺泡、微乳头状和实体型(G-I),没有确定的形态学特征。在HER2/ERBB2第20号外显子插入的情况下,常见为微乳头状生长模式(J)。此外,腺泡和浸润性黏液腺癌可能存在HER2/ERBB2突变(K,L)。
免疫检查点抑制剂
免疫检查点抑制剂已成为NSCLC临床治疗中重要方式。然而,每一种PD-L1免疫组化检测,是针对少数ICI药物开发的。目前,四种不同的PD-L1 I亚型,与特定的ICI药物有关。此外,采用三种评分系统(肿瘤比例评分、肿瘤细胞/免疫细胞百分比评分,以及联合比例评分),进行不同的PD-L1表达评估。
除了PD-L1检测,TMB也是另一种预测标志物。体细胞突变在突变位点产生新的氨基酸序列,表现为新抗原。小细胞癌和鳞状细胞癌表现出高TMB状态,,而肺腺癌的TMB状态,受分期、吸烟史、组织学亚型和驱动突变的影响。在肺腺癌中,浸润性腺癌的TMB状态,高于原位腺癌和微浸润性腺癌,腺泡亚型、微乳头状亚型和实体亚型,显示出较高的TMB。此外,EGFR阳性腺癌中的TMB普遍较低,而在KRAS突变的腺癌中的TMB普遍较高。
免疫检查点抑制剂和癌基因驱动的NSCLC
一般来说,PD-L1阳性和高TMB的肿瘤,对ICI治疗有反应,而那些PD-L1阴性和低TMB的肿瘤,对治疗的反应较差。EGFR突变的肿瘤,更常见PD-L1阴性表达。虽然在ALK融合的肿瘤中没有观察到PD-L1的表达的趋势,但除KRAS突变的肿瘤外,EGFR、ALK、ROS1、BRAF V600E、HER2和RET突变肿瘤中,TMB和PD-L1表达较低。多项临床试验表明,EGFR突变的肿瘤对ICIs反应较差。据报道,ALK的改变,也导致对检查点抑制剂的反应较差。
相反,ICI治疗中的KRAS突变,是其他驱动突变的一个例外。具有KRAS突变的非小细胞肺癌,通常发生在吸烟者中,而KRAS突变的发生率与吸烟剂量相关。与吸烟状态相一致,PD-L1的表达和TMB状态,均高于具有其他驱动突变的非小细胞肺癌。
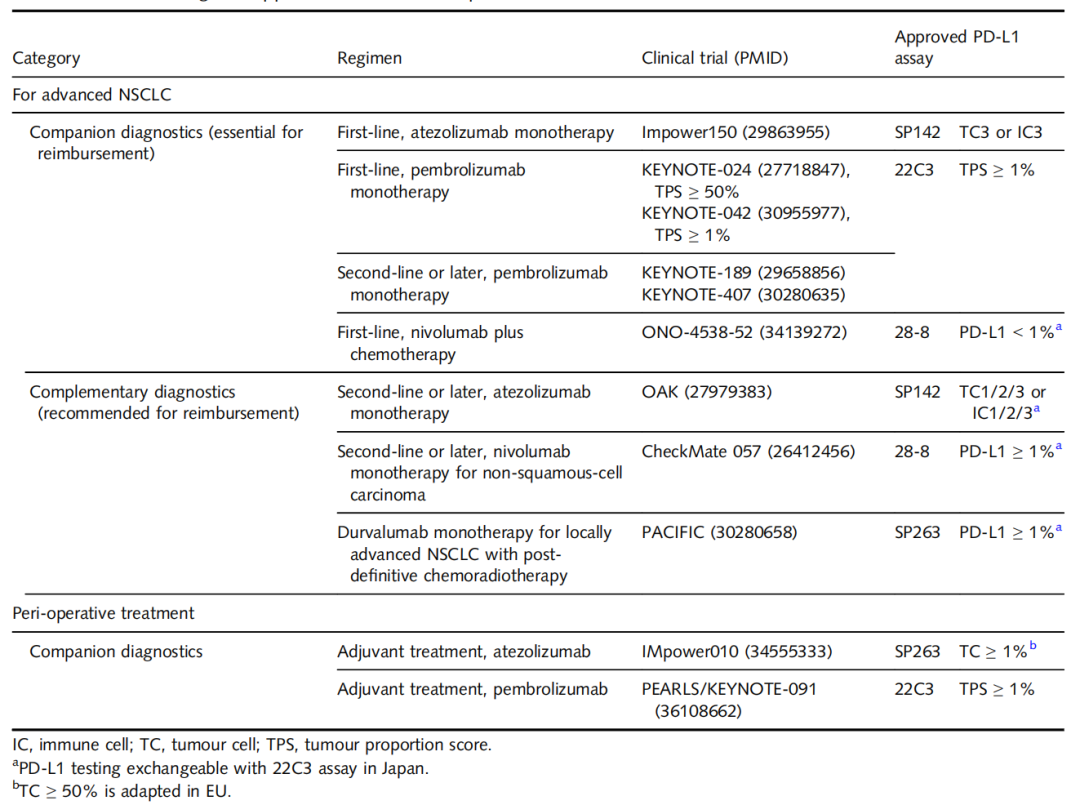
表3.PD-L1检测和已批准的免疫检查点抑制剂
进展与转化
肺癌的发展被认为是逐步发展的,其中浸润性鳞状细胞癌通过鳞状细胞原位癌发展而来。浸润性腺癌的进展也类似:非典型腺瘤发展为原位腺癌,然后是浸润性腺癌。驱动基因的改变,主要存在于腺癌中。尽管肿瘤转化存在潜在的差异,但驱动基因改变频率在进展中平均分布。一旦获得驱动改变,肿瘤进展与拷贝数增加或基因扩增有关。EGFR突变的肿瘤,经常显示不均匀分布的EGFR扩增,侵袭性或高级别区域分布富集,提示扩增与肿瘤进展为浸润性腺癌之间存在关联。晚期或转移进展与TTF-1扩增相关。不仅是特定的基因,而且是全面的基因组分析,也表明拷贝数畸变是肿瘤进展过程的特征。
与肿瘤进展相反,由于治疗选择压力而导致的转化,以TKI治疗后的SCLC转化为典型案例。大多数TKIs治疗都是高效的,这表明TKIs对肿瘤细胞产生了很高的选择压力。疗效越高,选择压力越高,逃避压力的变化就越剧烈。在阿利替尼相关治疗中,常见ALK阳性肿瘤的SCLC转化。作为一种耐药性机制,鳞状细胞癌的转化和上皮-间充质转化(EMT)也有报道。EGFR-TKIs倾向于发生SCLC转化,而EMT在ALK抑制剂中更为普遍。SCLC转化是从TP53和RB失活的腺癌发展而来的。
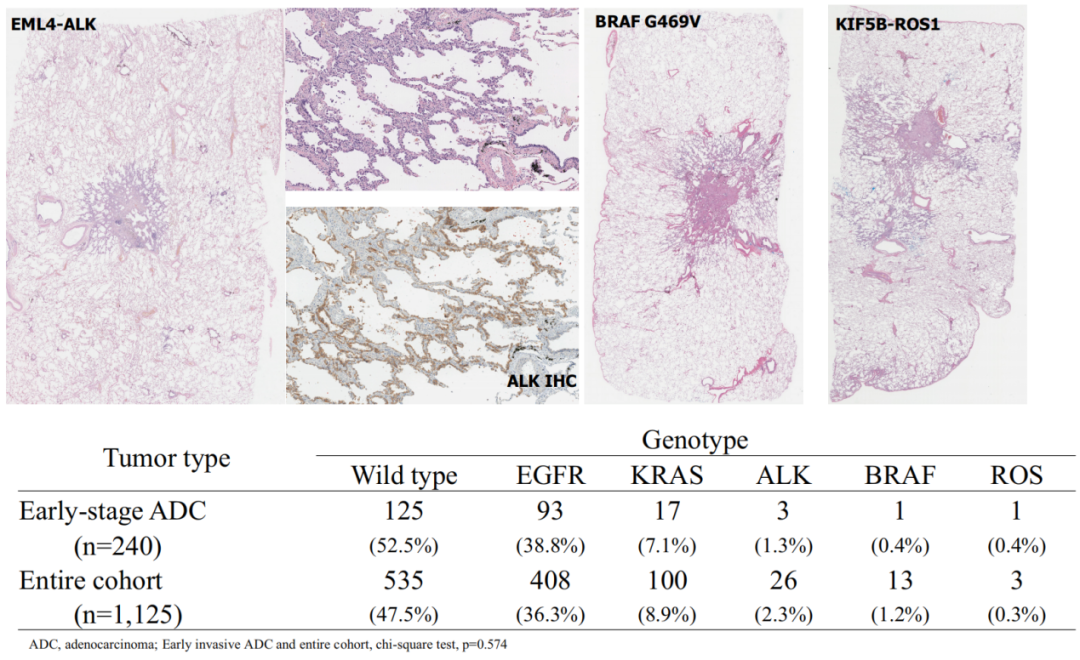
图4. 早期癌(浸润成分<1cm)与1125例肺癌队列中驱动因素改变的频率差异。EGFR、KRAS ALK、BRAF和ROS1驱动改变频率几乎相等,提示早期驱动改变参与了肺癌。
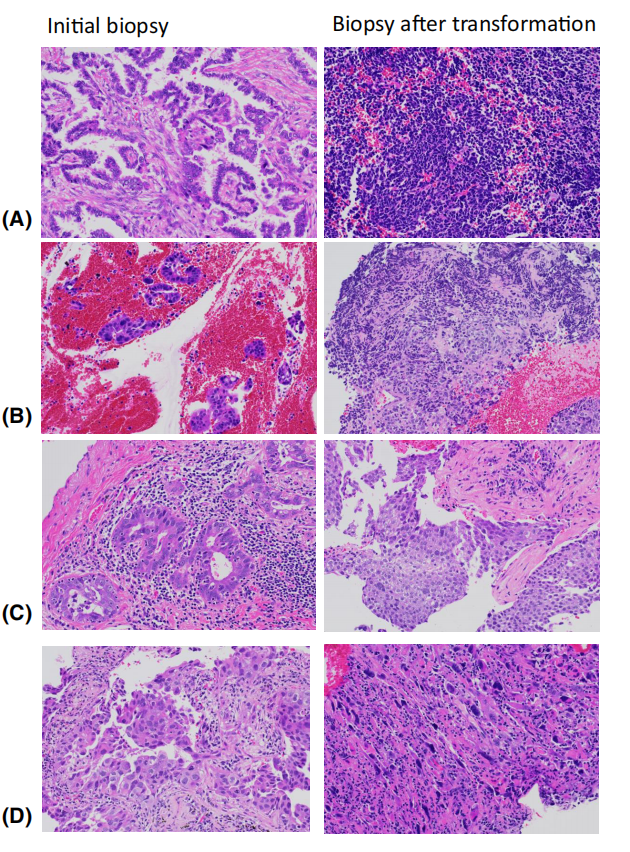
图5.TKI治疗后的组织学转化的例子。EGFR-TKI治疗后的小细胞癌转化(A,B)。腺癌转化为典型的小细胞癌形态(A),但转化肿瘤偶尔表现出与典型的小细胞癌形态不完全相同,如尽管核染色质呈细颗粒(B),但存在细胞质。奥司美替尼治疗(C).后的鳞状细胞癌转化。如果没有TKI治疗的临床病史,鳞状细胞癌的典型形态可能需要对继发性肿瘤进行鉴别诊断。阿利替尼治疗后肉瘤样癌转化(D)。除ALK融合外,还检测到ALK扩增。
总结
目前,肺癌的治疗是所有实体癌类型中最多的。除了传统的放化疗外,分子靶向治疗和免疫检查点抑制剂(ICI)的治疗也成为主要治疗选择。烟草烟雾暴露,可能导致在空气传导系统的肿瘤中积累的基因改变和免疫监视的逃避。相比之下,腺癌主要由癌基因激活驱动,但没有显著的基因改变积累,其发生途径通常涉及终末呼吸单位。在组织学上,NSCLC和鳞状细胞癌是不同的,但在生物学上,终末呼吸单位腺癌与导气管系统肿瘤之间的差异可能更为显著。
参考文献及书籍:
1.Yatabe Y. Molecular pathology of non-small cell carcinoma. Histopathology. 2024 Jan;84(1):50-66. doi: 10.1111/his.15080. Epub 2023 Nov 7. PMID: 37936491.
2.中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)非小细胞肺癌诊疗指南 2024[M]. 北京 :人民卫生出版社, 2024.

