Nat Commun:EGFR和TP53基因共突变肺癌患者易出现基因组加倍现象,可导致靶向治疗耐药性
时间:2024-07-31 18:00:35 热度:37.1℃ 作者:网络
导读
肺腺癌(LUAD)是非小细胞肺癌(NSCLC)最常见的组织学亚型,约占肺部恶性肿瘤的40%。在所有罹患LUAD的从不吸烟者中,高达50%的患者肿瘤携带表皮生长因子受体(EGFR)突变,这使其成为最佳治疗靶点,但仅有少数患者能获得超两年以上的持久治疗益处。目前,以奥希替尼为代表的第三代EGFR酪氨酸激酶抑制剂(TKI)为EGFR突变阳性NSCLC患者带来了显著临床获益,但接受该治疗的大多数患者最终会出现原发性耐药和获得性耐药,常见的耐药机制包括EGFR继发性改变、替代信号通路和体细胞拷贝数改变(SCNA)。
混合治疗反应(也称为异质性反应)是指同一患者体内不同病灶对治疗的反应不一致,迄今还未有研究探索在此情况下获得性耐药的潜在机制。TP53是肿瘤患者中最常见的突变基因,通常与疾病进展、治疗反应差及预后不佳有关,约40%NSCLC患者中存在该突变。TP53基因功能丧失可导致染色体不稳定(CIN),并在全基因组加倍(WGD)肿瘤中富集;WGD则是一种常见的遗传事件,可导致CIN的快速传播和SCNAs的获得。最近有研究表明,TP53基因突变可能与其他遗传事件(如WGD)共同促进了肿瘤细胞的EGFR TKI耐药性。
近日,英国伦敦大学学院癌症研究所的科研人员在Nature Communications发表了题为“Mixed responses to targeted therapy driven by chromosomal instability through p53 dysfunction and genome doubling”的文章。研究团队分析了携带EGFR和TP53共突变的LUAD患者与单一EGFR突变患者对EGFR TKI治疗反应的差异,发现共突变患者更可能出现异质性肿瘤反应;WGD和TP53共突变的联合存在会导致与EGFR TKI耐药性相关基因的基因组不稳定、基因组拷贝数异常增加。通过小鼠模型和体外同源tp53突变模型系统,该研究证实WGD通过增加拷贝数增加或缺失的概率,为耐药性提供了多样化途径。综上,该研究为探究个体患者对靶向治疗的肿瘤混合反应提供了分子基础,对开发新的治疗策略具有重要意义。

文章发表在Nature Communications
在EGFR突变LUAD患者中,TKI治疗的混合临床反应普遍存在
有关NSCLC靶向治疗和细胞毒性化疗的混合反应信息有限,大多数研究仅报告了满足RECISTv1.1反应标准所需的数据。该研究中,研究人员使用了Reiter等人定义的新反应参数,以区分人类和小鼠数据中的同质和混合肿瘤反应。
研究团队重新分析了欧洲肿瘤研究与治疗组织(EORTC)RECIST数据库中的数据(图1),共包括来自8,365名肺癌患者(NSCLC和 SCLC)的反应数据。在接受厄洛替尼治疗的患者中,31%的患者至少有一个应答靶病灶缩小30%以上,其中34%的患者出现混合反应。在接受细胞毒性化疗的患者中,64%的患者至少有一个应答靶病灶缩小30%以上,其中24%的患者出现混合反应。上述结果表明,在接受TKI 治疗和化疗的NSCLC患者中,混合反应普遍存在。
TP53通路紊乱是混合反应的关键
为了解EGFR突变肺癌混合反应的分子基础,研究团队使用现有基因组注释临床队列。在临床LUAD队列中,TP53功能丧失与无进展生存期(PFS)和总生存期(OS)降低相关。
研究团队还分析了三个地理位置不同的LUAD队列中EGFR和TP53基因改变的发生率,发现TP53通路破坏的发生率分别为52%(英国)、72%(美国)和47%(东亚);EGFR阳性患者中TP53共突变比例较高。接下来,研究团队分析了AURA2和AURA3临床试验以及AURA试验II期扩展队列的数据,探究了TP53通路中断对靶向治疗反应和TKI耐药的影响。
结果显示,仅存在EGFR突变的患者中,所有肿瘤在接受奥希替尼治疗后都有所缩小;同时携带EGFR和TP53基因突变(EP)患者的PFS显著缩短,其在接受治疗后更容易出现混合反应和早期耐药。此外,EP患者在转移病灶反应之间表现出显著更高的变异性,并且更容易观察到新转移病灶。上述结果表明,TP53通路紊乱与EGFR TKI治疗后混合反应和PFS缩短之间存在关联,这凸显了TP53突变在肺癌治疗耐药性中的潜在作用,并可能为未来的治疗策略提供新的视角。
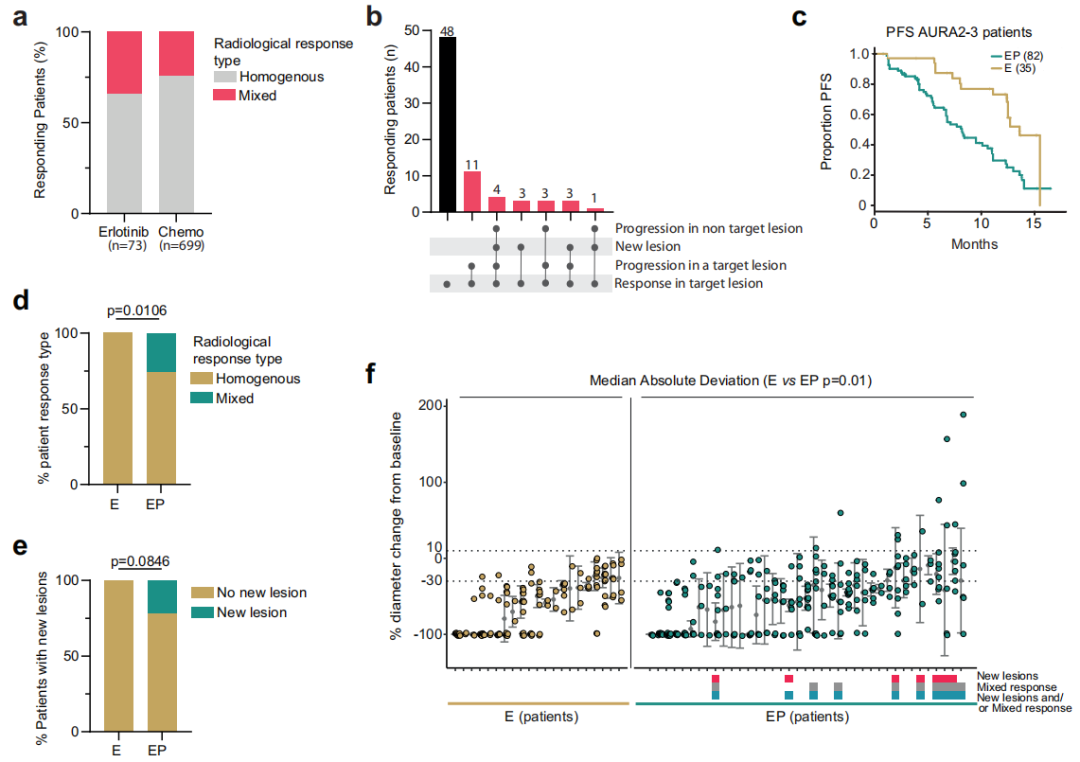
图1.TP53通路中断与较短PFS和对TKI治疗的混合临床反应有关
Trp53缺失与更快的治疗耐药性和获得对TKI治疗耐药性的替代机制相关
为在治疗混合反应背景下模拟克隆性TP53破坏对EGFR突变LUAD的影响,研究团队使用EGFRL858R(E)和EGFRL858RTrp53fl/fl(EP)基因工程小鼠模型(GEMM),并通过显微ct扫描监测肿瘤的发展(图2)。结果显示,相较于E小鼠,EP小鼠的肿瘤起始更早、肿瘤结节更多、肿瘤增殖指数增加和肿瘤级别更高,其总存活率显著降低。特别地,EP小鼠癌细胞的基因组加倍现象更为显著,这种基因组加倍可能与耐药性的发展有关。
研究团队通过生成未经治疗的小鼠和人类肿瘤的联合同源染色体SCNA图谱,评估了GEMM模型系统的适用性。结果显示,GEMM能够很好地模拟EGFR突变的人类肺癌中基因组的改变,特别是在拷贝数变异方面。进一步,研究团队对E、EP小鼠进行厄洛替尼治疗,发现EP小鼠的OS显著降低;在给予靶向药5周内,EP小鼠中有更高比例细胞发展成为耐药细胞。这表明TP53基因的突变状态可能与癌细胞对治疗药物的敏感性降低和耐药性的增加有关,而基因组加倍可能是这一过程的一个关键机制。
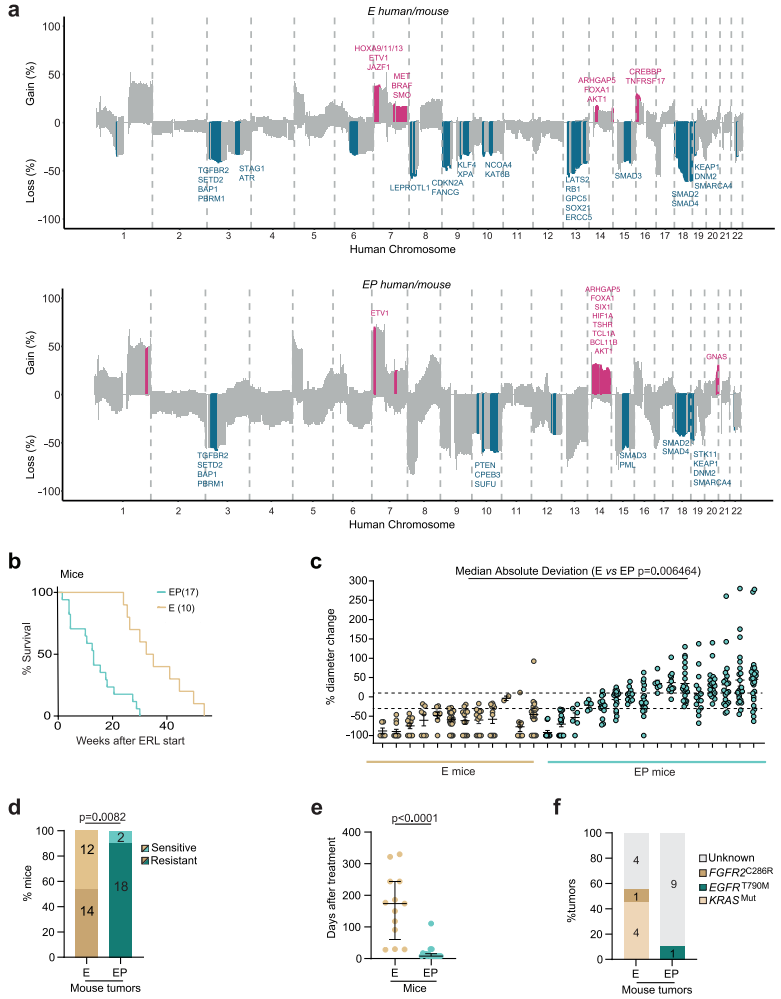
图2.NSCLC小鼠模型中Trp53缺失导致混合反应和治疗耐药性
TP53功能障碍导致与TKI抗性相关基因的SCNAs升高和细胞间多样性增加
为研究TP53功能丧失导致的非单核苷酸变异(SNV)相关的替代耐药机制,研究团队对未经治疗和耐药的E和EP小鼠细胞中不同倍性组的FACS分选细胞核进行单细胞全基因组测序(scWGS),利用MEDICC分析了拷贝数变化(包括基因组加倍)的演化时间。
结果显示,无论在未经治疗和耐药情况下,与E肿瘤(仅EGFR突变)相比,EP肿瘤(EGFR突变+TP53功能丧失)均表现出更高的基因组复杂性和更高的染色体不稳定性。此外,EP肿瘤在治疗耐药状态下具有更高的基因拷贝数增加频率,这与EGFR TKI耐药相关。这些结果表明,EP肿瘤的抗药性发展往往与染色体不稳定性增加和基因拷贝数增加有关,而E肿瘤的抗药性发展则主要由点突变驱动。
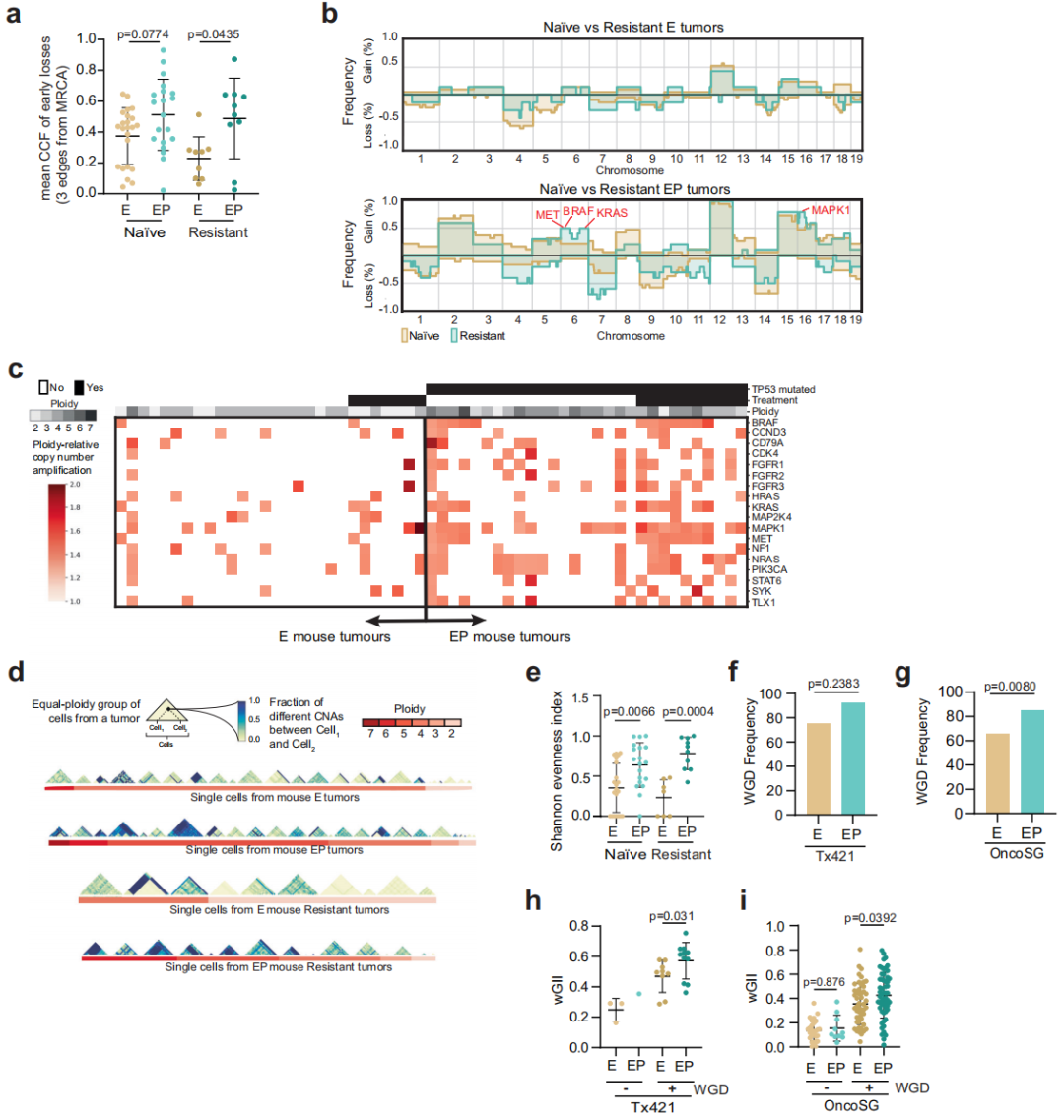
图3.Trp53和WGD一起导致与CIN和细胞间变异性增加相关的治疗耐药性
WGD和TP53功能障碍共同促进了对EGFR TKI的遗传抗性
基于上述研究数据,研究团队假设WGD与TP53功能障碍一起,加速了SCNAs获取过程中的细胞间变异,产生了可供选择作用的多样性。在EGFR TKI治疗的背景下,与TP53功能正常E肿瘤相比,这种基因组多样性可能促进更快耐药性获得和混合反应。
为解析WGD在TP53功能障碍背景下对获得性耐药的贡献,研究团队对一个同源克隆EGFR/TP53突变的人类NSCLC PC9细胞模型系统进行分析(图4)。结果显示,在WGD和TP53功能障碍的背景下,PC9细胞对EGFR TKI治疗产生了更高的耐药性,并且这种耐药性主要通过SCNA机制实现。此外,在EP小鼠肿瘤模型中,WGD与TP53功能障碍也显著增加了SCNA的频率。上述结果表明,TP53功能障碍伴WGD可能会扩大克隆进化过程中治疗耐药性的潜在途径,导致早期治疗失败,这可能表现为个体患者对治疗出现混合反应。
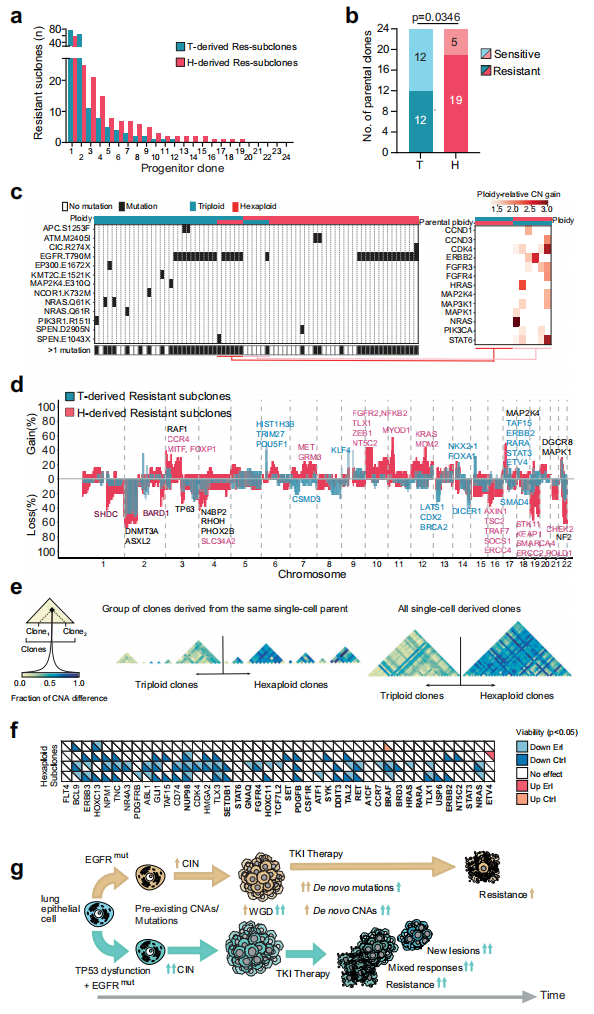
图4. WGD和p53功能障碍的情况下可促进多种途径治疗耐药性
综上所述,研究团队深入剖析了接受化疗或EGFR TKI治疗的NSCLC患者群体,揭示了混合反应的普遍性,其可能与临床获益的减少存在密切联系。该研究发现,EGFR激活、TP53通路失活和WGD一起重塑了拷贝数景观,并创造了一个有利环境允许对TKI疗法产生多样化的耐药机制,从而导致了患者体内出现混合反应动态。这项研究表明,评估TP53状态可能有助于更精准地预测EGFR TKI治疗的成功率,并强调了频繁疾病监测在临床实践中的潜在益处。
参考文献:
Hobor S, Al Bakir M, Hiley CT, et al. Mixed responses to targeted therapy driven by chromosomal instability through p53 dysfunction and genome doubling. Nat Commun. 2024;15(1):4871. Published 2024 Jun 13. doi:10.1038/s41467-024-47606-9


