探索与实践 | 肝内胆管癌的外科综合治疗进展
时间:2024-08-15 18:00:29 热度:37.1℃ 作者:网络
肝内胆管癌(ICC)是指肝内二级胆管至肝内最小胆管分支的衬覆上皮及其胆管周围腺体发生的恶性肿瘤,并表达胆管细胞标志物。约20%-30%的ICC可行手术切除,这被认为是唯一的根治性策略,患者的5年总生存(OS)率约为20%-40%。近期,海军军医大学第三附属医院东方肝胆外科医院王葵教授分享了“肝内胆管癌的外科综合治疗”。肝胆相照平台特将精华整理成文,以飨读者。
一、概述
世界范围内,胆管癌(CCA)发病率最高的是泰国东北部、中国和其他东南亚地区,西方国家发病率较低。ICC约占胆管癌类型的20%,发病率仅次于肝细胞癌,约占原发性肝癌的10%~15%[1]。上海地区为ICC的高发区,发病率约7.55/10万人。手术切除是其主要的治疗选择,但是患者即使在根治性(R0)切除术后,5年生存率也仅在20%-40%之间,且术后复发率较高(56.5%-88.4%)。
ICC精确诊断依赖于影像和病理。ICC的影像表现为平扫时低于肝实质的不均匀低密度肿块,边界模糊。增强CT时,动脉期常见肿瘤周围环状或边缘样不完全轻度强化、低密度灶内见稍高密度区;门静脉期可见逐渐增加的造影剂摄取;延迟期突出表现为向心性渐进性强化(图1)。当影像学表现为乏血供的肝实质性肿瘤时,除考虑ICC外,也要与乙状结肠癌肝转移、肝神经内分泌瘤相鉴别。
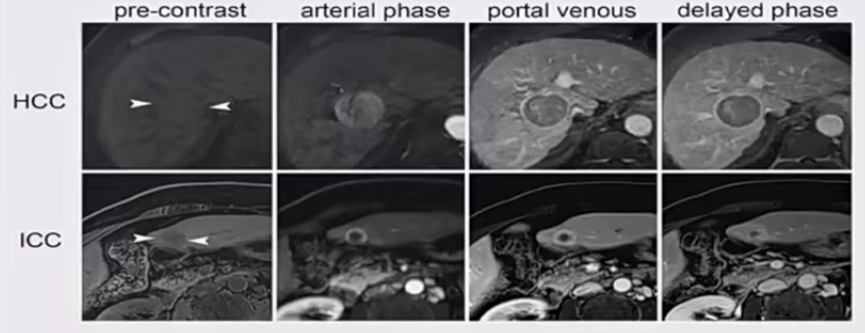
图1. HCC和ICC的影像对比
肝内胆管依其管径由小到大可分为小胆管群和大胆管群,由此构成了小胆管型和大胆管型ICC组织学分型的解剖学基础。ICC的病理组织学分型分为大胆管型ICC和小胆管型ICC[2](表1)。不同组织学亚型的ICC在细胞起源、组织结构、免疫表型和分子变异等方面具有高度异质性。小胆管型ICC预后相对较好。

表1. ICC组织学亚型病理特点
肝内胆管癌诊疗专家共识包括《肝内胆管癌外科治疗中国专家共识(2020版)》和《原发性肝癌诊疗指南之肝内胆管癌专家共识(2020版)》。共识提出肝切除术是较早期肝内胆管癌的有效治疗方法[3,4];术前需准确评估肝切除术的有效性和安全性;有效性评估以达到肿瘤R0切除和保留足够功能性剩余肝脏体积为原则;经严格手术安全性评估后,建议根治性ICC切除术的切缘宽度≥10mm;目前多数研究倾向于对术前或术中诊断或怀疑为ICC的病人行淋巴结清扫。ICC在过去是肝移植的相对禁忌证,目前研究发现,小的ICC和局部进展的ICC患者在新辅助治疗后,6个月获得较好的效果且疾病稳定的状态下进行肝移植,其五年生存率与HCC患者肝移植的五年生存率相似。
二、治疗进展
1. ICC的分子靶向精准治疗
ICC的临床靶向和免疫治疗研究进展迅速,ICC靶向与免疫治疗生物标志物如表2所示。对于ICC的靶向治疗,目前存在的问题主要有两方面,一是即使有这些靶点阳性的患者在应用靶向药物几个月后也可能会产生耐药,二是药物治疗时机的选择目前尚无定论,是一线使用,还是化疗进展后二线使用。
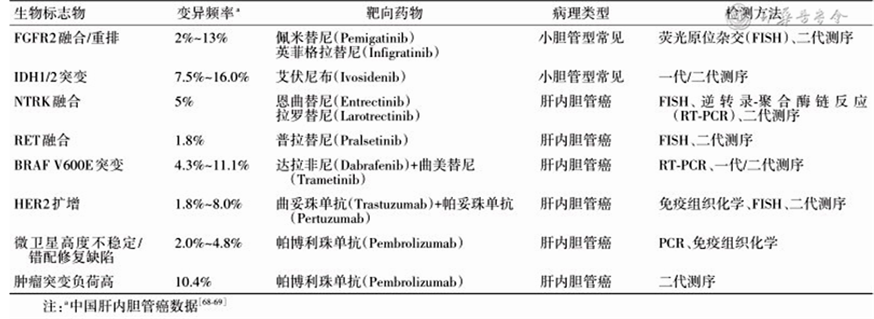
表2. ICC靶向与免疫治疗生物标志物
2. 晚期胆管癌一线化疗:以吉西他滨为基础的化疗方案
III期ABC-02研究[5]奠定了吉西他滨联合顺铂(GC)化疗方案长达12年作为一线首选方案的地位。研究结果显示,与单药吉西他滨相比,GC方案将PFS延长至8.0个月,OS延长至11.7个月,肿瘤控制率提高至81.4%(vs.71.8%,P=0.049)。除了GC组中性粒细胞减少症的发生率高以外,两组的不良事件(AE)相似。
3. 化疗联合靶向
一项开放式、单臂、单中心、前瞻性II期研究评估了仑伐替尼联合GEMOX(吉西他滨联合奥沙利铂)一线治疗晚期ICC患者的疗效。截止2021年2月10日,30例患者的中位随访时间为6.8个月,客观缓解率(ORR)为30%,疾病控制率(DCR)为86.7%,中位PFS、中位OS和中位持续缓解时间(DOR)未达到,6个月OS率为92.6%。1例局部晚期患者实现降期,并接受了切除术,该患者在最后一次随访结束时保持无病生存,未观察到5级AE,40.0%(12/30)的患者经历3级或更高级别的AEs,5例患者因AE停止治疗。
4. 靶向联合免疫
LEAP-005研究[6]的其中一部分是评估仑伐替尼联合帕博利珠单抗二线治疗胆道癌患者的多中心、单臂、II期研究。研究共入组31例患者,中位年龄63岁,其中PD-L1阳性联合分数(CPS,即样本组织中全部符合要求的阳性染色细胞占比分数)≥1的患者占55%(17/31),既往接受过一次化疗的占90%(28/31),第一次用药至数据截止时间的中位时间为9.5个月(3.1-11.9)。结果显示,ORR为10%,DCR为68%,达到客观缓解的患者PD-L1 CPS评分均≥1,中位缓解持续时间为5.3个月。中位PFS为6.1个月,中位OS为8.6个月。
5. 化疗联合靶向以及免疫
中山医院的一项II期研究评估[7]了特瑞普利单抗、仑伐替尼联合GEMOX化疗治疗不可切除晚期肝内胆管癌的疗效。研究结果显示,联合方案ORR为80%(24/30;95% CI:61.4%-92.3%),DCR为93.3%(28/30;95% CI:77.9%-99.2%),中位PFS为10个月,中位DOR为9.8个月,中位OS尚未达到,12个月OS率为73.3%(95%CI:57.5%-89.2%)。
6. 化疗联合双免
IMMUCHEC研究[8]是评估度伐利尤单抗(D)和曲美木单抗(T)联合吉西他滨(Gem)或吉西他滨和顺铂(Cis)对比吉西他滨和顺铂在初治胆管癌和胆囊癌患者中的治疗效果的随机II期试验。关键纳入标准为既往未经治疗的晚期、不可切除和/或转移性胆管癌和胆囊癌;有可测量的病灶,ECOG评分0-1。试验包括5个组,试验治疗方案如下:
A组:D 1.5g Q3W+4xT 75mg Q3W+Gem 1000 mg/m2(D+4T+G);
B组:D 1.5g Q3W+4xT 75mg Q3W+Gem 1000 mg/m2+Cis 25mg/m2(D+4T+GC);
C组:(对照组)Gem+Cis(GC);
D组:D 1.5g Q3W + 1xT 300mg+Gem+Cis(D+1T+GC);
E组:D 1.5g Q3W + Gem + Cis(D+GC)。
研究结果如表3所示,联合度伐利尤单抗和/或曲美木单抗一线治疗胆管癌和胆囊癌未达到改善ORR的主要终点。但是GC联合度伐利尤单抗和单剂量曲美木单抗治疗中位OS有延长趋势。
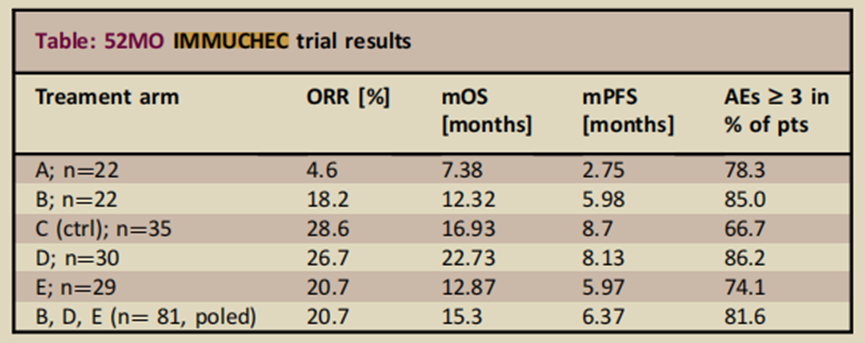
表3. IMMUCHEC研究结果
7. 肝动脉灌注化疗联合靶免
北大肿瘤医院牵头的一项II期临床试验评估了肝动脉灌注化疗(HAIC)联合贝伐珠单抗与特瑞普利单抗治疗晚期胆管癌的疗效。至数据截止日期(2022年7月26日),中位随访时间为14.9个月,ORR为84.3%(27/32),1例CR,26例PR,DCR为96.9%(31/32)。6个月PFS和OS率分别为80.7%和90.6%,1年PFS和OS率分别为53.8%和80.4%。
8. 化疗联合免疫进入晚期ICC的一线方案
TOPAZ-1研究评估了度伐利尤单抗联合吉西他滨和顺铂(GC)治疗晚期胆道癌的疗效。截止至2022年2月25日,OS事件发生率为76.9%。试验组mOS(95%CI)为12.9(11.6-14.1)个月,对照组为11.3(10.1-12.5)个月。
9. 其他
目前还有很多研究对晚期胆管癌通过联合其它治疗手段能否增效进行了探索。如VEGF阻断联合细胞毒性化疗(如吉西他滨)可通过互补机制促进胆管癌中免疫许可的肿瘤微环境,增强PD-L1抑制应答等。
三、综合治疗
1、可R0切除的ICC外科治疗策略-解剖性或宽切缘肝切除及淋巴结清扫
如何达到R0切除是目前ICC手术切除的关键。研究显示,切缘阴性直接关系到患者的生存率,R0切除能有效提高患者长期生存率。与HCC相比,ICC的浸润性及侵袭性更强,无完整包膜、血管浸润较常发生。因而ICC的R0切除要更加精细地个体化判断,不能解剖性切除的患者可以行宽切缘肝切除(切缘宽度≥10mm),并进行淋巴结清扫。
2.不能R0切除ICC外科治疗策略-个体化的MDT治疗
70-80%的ICC患者不能R0切除,要对患者进行个体化的MDT治疗。
1)临近肝门部的ICC
图2所示(病例1)为一例病史15余年,三个抗体阳性,TB139,CA199>1000的患者。经过内引流-GC化疗-靶向-靶向+免疫-靶向的治疗后,OS达到47个月。
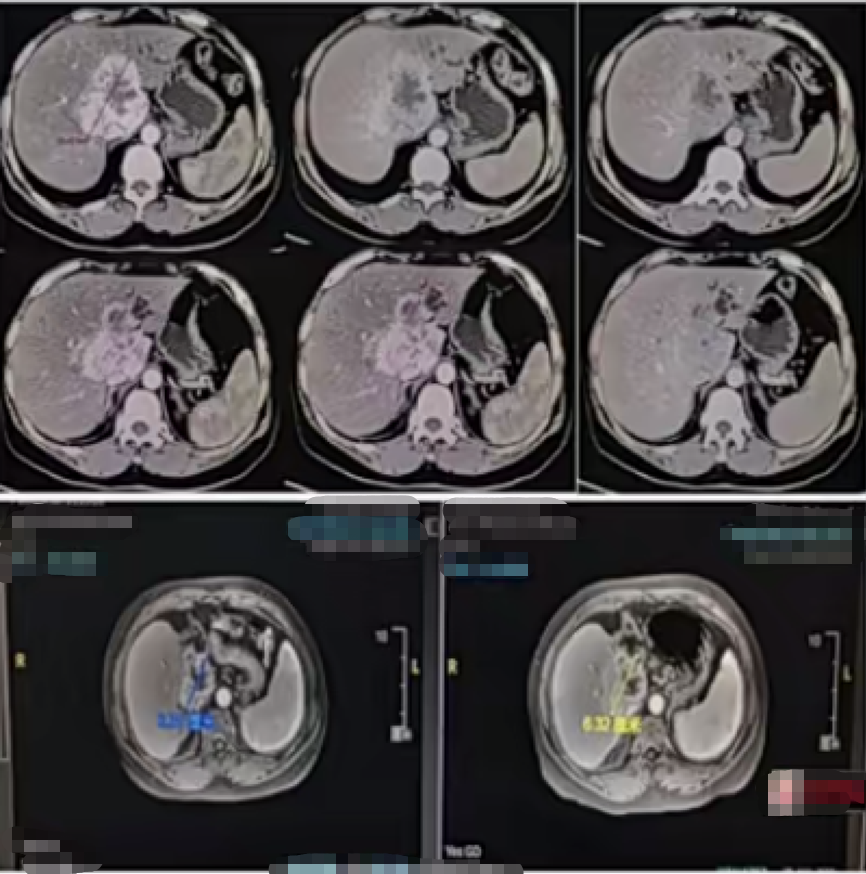
图2. 临近肝门部的ICC病例1
图3所示(病例2)为一例中肝叶至左外叶占位的ICC患者,大小约9.6X6.5cm。经过TACE-GC化疗-口服替吉奥的治疗后,目前已停药一年,OS为47个月。
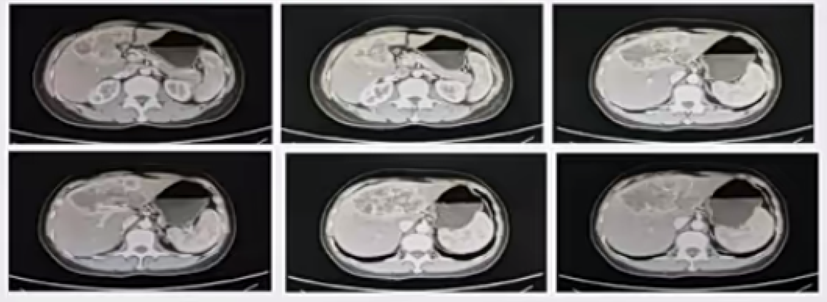
图3. 临近肝门部的ICC病例2
2)ICC降期手术
图4所示(病例3)为一例CEA>1000mg/dl,CA199为237U/ml的ICC患者。经靶免治疗-联合GC化疗后实现降期,后经手术切除,术后停药。目前已停药10月,OS 36个月。
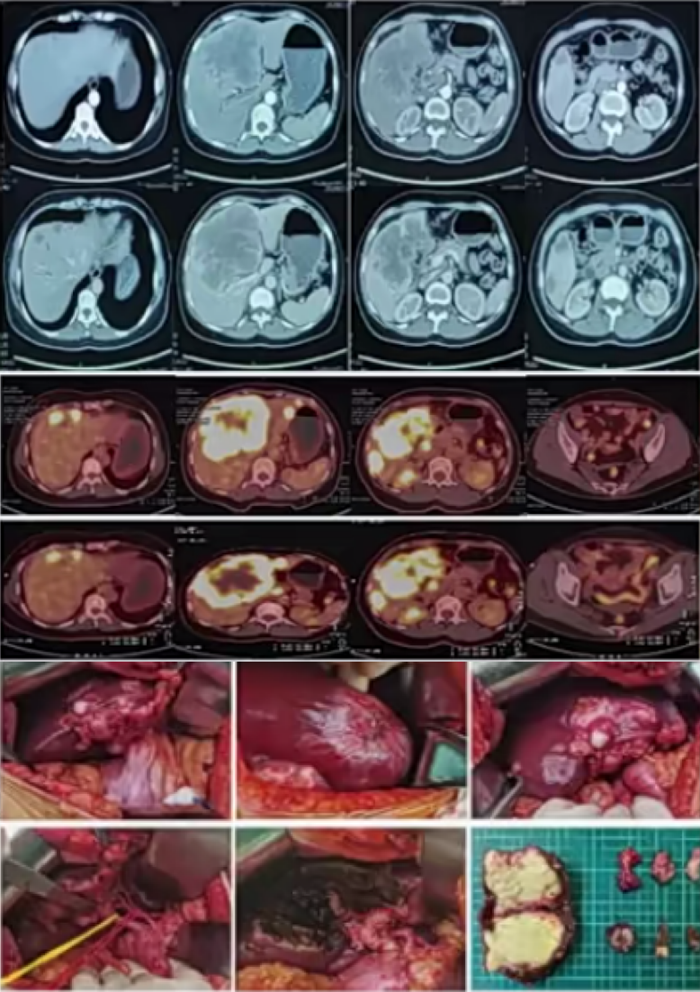
图4. ICC降期手术病例3
四、总结
免疫联合治疗带来晚期一线方案更新。精准的个体化序贯治疗是探索的方向。围术期诊疗方案选择及效果不断验证。转化切除需要筛选合适的病人和时机。
参考文献
[1] Kelley R K, Bridgewater J, Gores G J, et al. Systemic therapies for intrahepatic cholangiocarcinoma[J]. J Hepatol, 2020, 72(2): 353-363.
[2] J Chen. 2022, 51(9): 819-827.
陈骏等. 肝内胆管癌病理诊断专家共识(2022版)[J]. 中华病理学杂志, 2022, 51(9): 819-827.
[3] J E Zhuan. 2021, (1): 1-15.
专家组科技部传染病防治重大专项课题病毒性肝炎相关肝癌外科综合治疗的个体化和新策略研究. 《肝内胆管癌外科治疗中国专家共识(2020版)》[J]. 中华病理学杂志, 2021, (1): 1-15.
[4] G Zhong. 2022, 21(10): 1269-1301.
中国抗癌协会肝癌专业委员会胆管癌协作组. 原发性肝癌诊疗指南之肝内胆管癌诊疗中国专家共识(2022版)[J]. 中华消化外科杂志, 2022, 21(10): 1269-1301.
[5] Valle J, Wasan H, Palmer D H, et al. Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer[J]. N Engl J Med, 2010, 362(14): 1273-1281.
[6] ASCO-GI abstract 4060[Z]. 2021.
[7] ASCO-GI abstract 4094[Z]. 2021.
[8] ESMO abstract[Z]. 2022.


