中科大段亚君教授团队《自然·通讯》:揭示肠道Nogo-B影响GLP1分泌的亚细胞调节过程
时间:2024-08-15 19:00:32 热度:37.1℃ 作者:网络
2型糖尿病(T2DM)是一种全球数亿人所面临的慢性疾病,其主要特征是在相对胰岛素抵抗的背景下,胰岛素分泌出现进行性缺陷。胰高血糖素样肽1(GLP1)作为一种重要的肠促胰岛素激素,在摄入营养时释放并增强葡萄糖诱导的胰岛素反应1。T2DM患者饮食刺激下的GLP1分泌水平显著降低,但其效果能够相对保留。因此,许多治疗T2DM的药物都集中在开发GLP1受体激动剂上。鉴于与GLP1受体激动剂相关的胃肠副作用和高停药率,设计能够提高内源性GLP1水平的药物干预措施变得势在必行2。目前提高GLP1内源性水平的药物研究主要集中在通过抑制DPP4酶来减少GLP1的清除,阐明GLP1分泌/合成的新机制对于开发更为有效的治疗策略具有极其重要的意义。

2024年8月10日,中国科学技术大学第一附属医院,安徽省省立医院心内科段亚君教授团队在Nature Communications杂志上在线发表了一篇题为“Intestinal Nogo-B reduces GLP1 levels by binding to proglucagon on the endoplasmic reticulum to inhibit PCSK1 cleavage”的研究论文。这项研究揭示了GLP1合成过程中的一个关键环节,即网状蛋白4B(Nogo-B)的亚细胞调节作用,为GLP1合成的生物学提供了重大补充。
GPL1是通过其前体蛋白胰高血糖素原(proGCG)在不同组织中特异性加工产生的,proGCG在胰腺a细胞中被PCSK2切割合成胰高血糖素,而在肠内分泌细胞中被PCSK1切割合成GLP13。网状蛋白4,也称为Nogo,具有三种亚型:Nogo-A、Nogo-B和Nogo-C。其中Nogo-B在机体中广泛表达,并被多项研究中证实在代谢性疾病中扮演关键角色,包括酒精性肝病、胆汁淤积、肥胖以及NAFLD相关的肝癌等。值得一提的是,段亚君教授团队2020年在Journal of Hepatology上发表了关于肝脏Nogo-B参与由ChREBP介导的糖脂代谢过程的研究。该研究的一项结果表明,在正常饮食的小鼠中,Nogo-B的全身敲除显著激活了肝脏INSR-IRS-AKT通路,但并未阐明其具体机制4。
在本研究中,研究人员首先确定了全身性敲低/敲除Nogo-B能够激活胰岛素信号通路,同时促进胰岛素、GLP1的分泌,并降低胰高血糖素的水平。鉴于Nogo-B定位于内质网和质膜上,研究人员猜测Nogo-B是否通过影响这些激素的产生,或与这些激素的受体竞争性结合来调节激素水平。通过序列同源性分析、co-IP-MS技术,研究人员发现Nogo-B可能与proGCG之间存在相互作用,这种相互作用可能对GLP1或胰高血糖素的合成或分泌过程具有重要影响。随后,研究人员通过一系列co-IP实验,揭示了Nogo-B与proGCG的MPGF片段的IP2区域存在特异性相互作用,而MPGF正是GLP1剪切过程中的关键肽段(图1)。基于上述实验结果,研究人员明确了Nogo-B通过与proGCG的IP2区域相互作用,影响GLP1的合成过程。
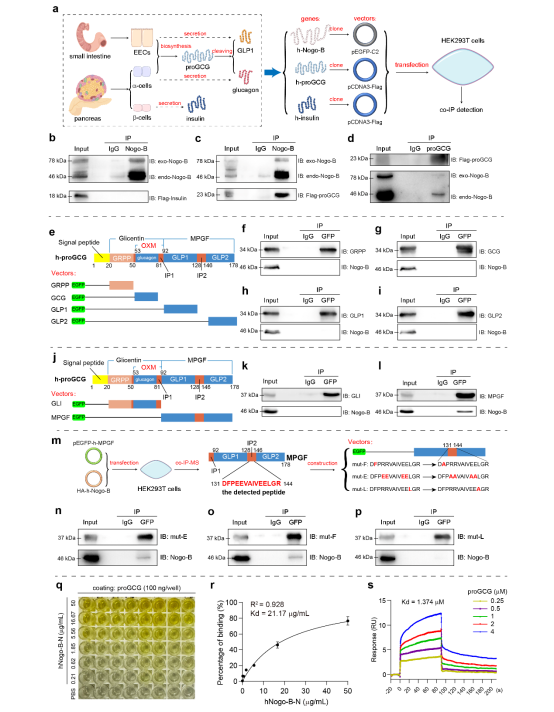
图1. Nogo-B与proGCG的MPGF区域相互作用
GLP1作为一种分泌蛋白,其前体蛋白proGCG在内质网内经过加工和折叠后,需要转运至高尔基体,经PCSK1剪切后合成活性GLP1。研究人员发现,Nogo-B过表达导致proGCG在内质网驻留,阻碍了其向高尔基体的运输。同时抑制了PCSK1切割proGCG,从而减少了GLP1的产生。而在肠内分泌细胞STC-1细胞中,Nogo-B敲低促进了proGCG与PCSK1的共定位,同时增加了GPL1的水平(图2)。这些结果表明,STC-1细胞的Nogo-B水平能够调节PCSK1对proGCG的切割,从而影响了GLP1的产生。过量的Nogo-B会抑制PCSK1裂解proGCG,导致GLP1水平降低。随后,研究人员构建了肠道Nogo-B特异性敲除小鼠,进一步确认了肠道Nogo-B敲除能够促进小鼠的GLP1水平,从而刺激了胰岛素分泌。同时,研究人员也发现肠道Nogo-B敲除可改善STZ诱导的T2DM特征性表现。
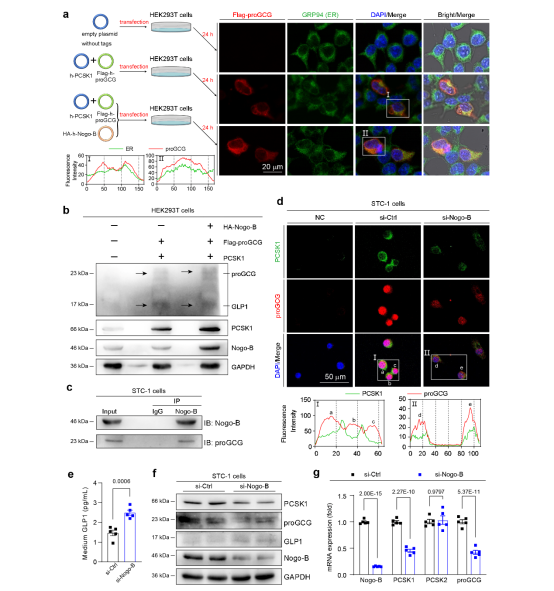
图2. Nogo-B抑制PCSK1介导的STC-1细胞中proGCG裂解
综上所述,本研究揭示了T2DM小鼠和人类患者的肠道Nogo-B水平增加,而肠道Nogo-B通过与proGCG的MPGF片段的相互作用,调控GLP1的生物合成。这种相互作用导致proGCG在内质网中的异常滞留,从而阻碍了其向高尔基体的正常转运,进而抑制了在高尔基体中由PCSK1介导的proGCG的剪切(图3)。此外,本研究表明肠道Nogo-B的敲除显著提高了GLP1水平,促进了胰岛素的分泌,并改善了T2DM小鼠代谢紊乱的症状。这些结果不仅为糖尿病治疗领域提供了新的见解,而且为将Nogo-B作为潜在的治疗靶点提供了有力的科学依据。
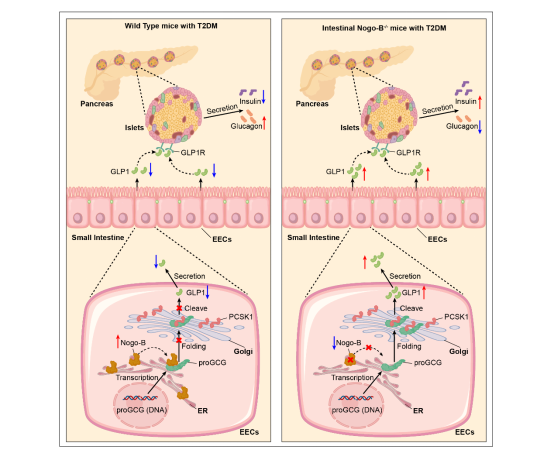
图3. Nogo-B调节GLP1合成的模式图
中国科学技术大学第一附属医院,安徽省省立医院心血管内科段亚君教授为该论文的通讯作者,龚克博士、薛超博士为本论文的共同第一作者。本研究受到国家自然科学基金等项目资助。
参考文献:
1、Holst, J. J. Glucagon-like peptide-1: are its roles as endogenous hormone and therapeutic wizard ongruent? J. Intern. Med. 291, 557–573 (2022).
2、Smits, M. M. & Holst, J. J. Endogenous glucagon-like peptide (GLP)-1 as alternative for GLP-1 receptor agonists: Could this work and how? Diab. Metab. Res. Rev. 39, e3699 (2023).
3、Sandoval, D. A. & D’Alessio, D. A. Physiology of proglucagon peptides: role of glucagon and GLP-1 in health and disease. Physiol. Rev. 95, 513–548 (2015).
4、Zhang, S. et al. Reduced Nogo expression inhibits diet-induced metabolic disorders by regulating ChREBP and insulin activity. J. Hepatol. 73, 1482–1495 (2020).
原文链接:
https://www.nature.com/articles/s41467-024-51352-3


