中药连翘中神秘成分连翘苷,直击发热根源:GAPDH、MDH2、IDH2三靶点深度解析,让你重新认识中医智慧!
时间:2024-09-02 17:00:35 热度:37.1℃ 作者:网络
发热是一种与感染和创伤相关的病理生理现象,其特征为体温超出正常范围。作为疾病急性期主要的病理生理反应之一,例如在急性肺炎中,发热能够提升免疫因子和细胞的活性。适度的体温升高对于恢复因创伤和感染而受损的体内平衡具有积极作用。然而,体温过高可能引发多种不良后果,包括脑组织损伤、免疫反应异常和代谢紊乱等。因此,合理调控发热并保持体温在适宜范围内,对于维护机体正常的生理功能至关重要。
连翘,具有清热解毒之功效。在临床实践中,该药材长期被用于缓解因感冒或流感导致的发热症状,其药理作用亦十分广泛,涵盖了抗炎、抗病毒、抗氧化以及对心血管系统的保护。连翘的主要活性成分连翘苷(Phr)在体内可转化为连翘苷元(Phg)、Phg-磺酸盐(Phg-S)以及Phg-葡萄糖醛酸(Phg-G)。我国研发的Phr胶囊(KD-1胶囊)已进入治疗急性流感发热症状的第二阶段临床试验,然而,其确切的退热机制尚待进一步阐明。
日前,一篇名为“Phillyrin and its metabolites exert antipyretic effects by targeting the NAD+ binding domain of GAPDH, MDH2 and IDH2”的研究探讨了Phr及其代谢产物发挥解热作用的机制。

图1 论文首页
Phr对肺炎发热小鼠模型具有抗炎、解热作用
研究通过鼻内滴注脂多糖(LPS)诱导的小鼠肺炎发热模型验证Phr的退热效应。结果显示,相较于对照组,LPS诱导的小鼠体温显著上升,而阿司匹林(100 mg/kg)和Phr(6.5和13 mg/kg)均能有效抑制由LPS引起的体温升高(图2A)。同时,研究采用针对肝脏的线粒体温敏探针(荧光强度与温度呈反比关系)来评估发热模型小鼠的肝脏温度。与对照组相比,发热小鼠模型中线粒体温敏探针显示的肝脏荧光强度较弱,这表明模型小鼠的肝脏温度高于对照组(图2B)。然阿司匹林(100 mg/kg)和Phr(6.5和13 mg/kg)显著增强了发热小鼠肝脏温敏探针的荧光强度,表明阿司匹林和Phr减少了发热状态下的肝脏产热。因此,可以推测Phr的退热作用可能与抑制肝脏代谢有关。
此外,Phr和阿司匹林在LPS诱导的肺炎发热模型中展现了显著的抗炎效果。肺组织病理HE染色显示,对照组小鼠的肺上皮细胞形态正常,无明显病理变化。而模型组小鼠的肺泡间隔显著增厚,间质可见大量炎性细胞浸润,而Phr和阿司匹林减少了间质中的炎症细胞浸润(图2C)。阿司匹林(100 mg/kg)和Phr(6.5和13 mg/kg)组的肺损伤评分显著低于模型组(图2D)。Phr的抗炎作用还体现在降低LPS诱导的小鼠肺系数和肺W/D重量比的增加(图2E、F)。这些结果表明,Phr在体内具有显著的退热和抗炎作用。
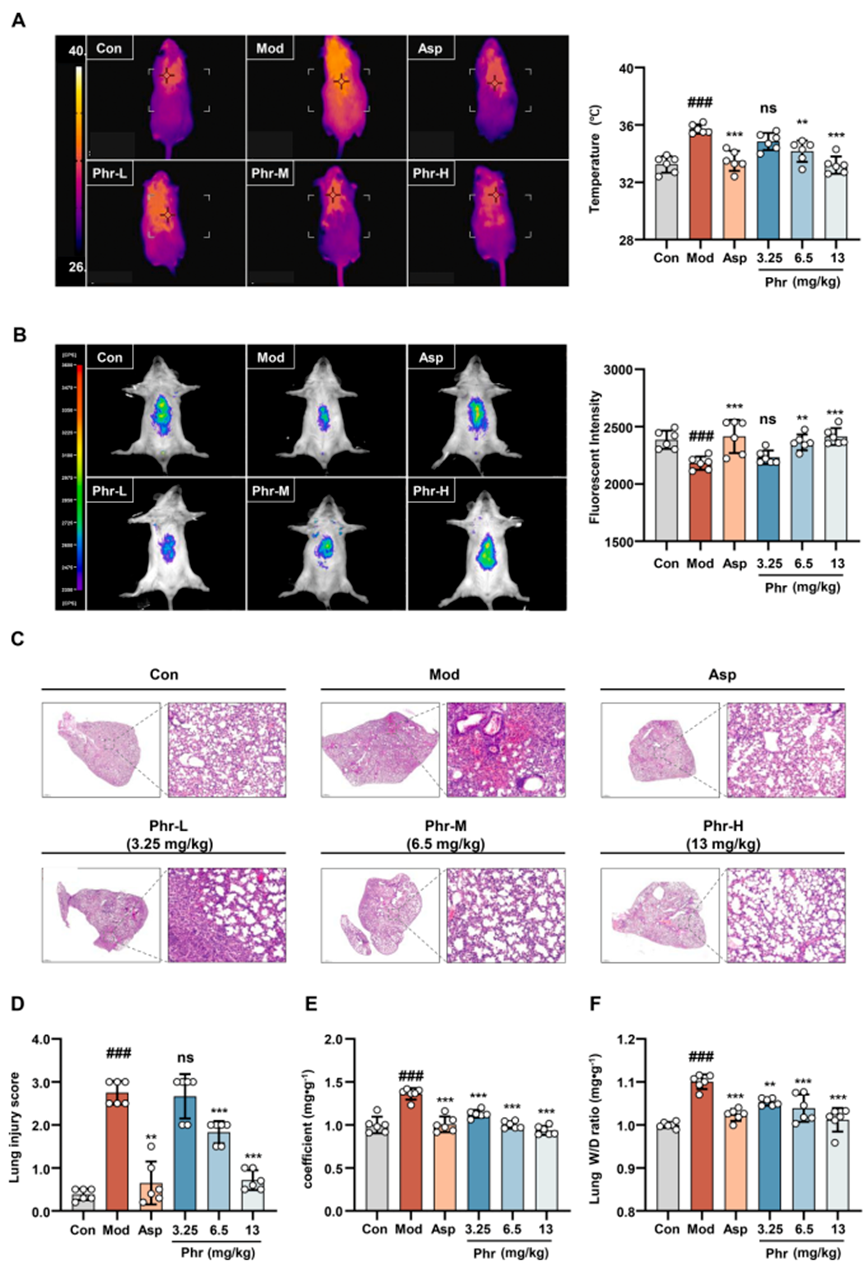
图2 解热、抗炎作用的药效学评价
Phg通过靶向GAPDH、MDH2和IDH2影响细胞能量代谢
该研究进一步探讨了Phg对GAPDH、MDH2和IDH2等酶在细胞水平上活性的作用。机械酶活性检测显示Phg能够抑制这三种酶在细胞内的活性(图3A)。GAPDH、MDH2和IDH2参与了细胞能量代谢途径中的EMT和TCA过程。因此,研究采用细胞非靶向代谢组学技术,验证了Phg对GAPDH、MDH2和IDH2靶向作用对EMT和TCA代谢的影响。结果显示,Phg处理组中,与EMT相关的代谢物受到了显著影响,GAPDH蛋白上游的代谢物,如果糖1,6-二磷酸(FBP)、磷酸二羟丙酮(DHAP)和甘油醛-3-磷酸(G3P)显著增加,而下游代谢物如甘油-3-磷酸(3PG)、甘油-2-磷酸(2PG)和丙酮酸盐显著减少(图3B)。在三羧酸循环中产生的柠檬酸和异柠檬酸水平也显著降低。
NADH在GAPDH、MDH2和IDH2的催化作用下,作为电子供体进入电子传递链(ETC),产生膜电位(ΔΨ)。随后,ΔΨ被ATP合酶(AS)利用以合成ATP,同时被解偶联蛋白(UCP)利用以产生热量,从而维持体温(图3C)。接下来,研究探讨了Phg对OXPHOS的影响。线粒体应激实验结果表明,Phg有效地降低了细胞的呼吸功能,主要通过抑制基础呼吸、最大呼吸、ATP生成和质子泄漏(图3D)。综合以上结果,研究证实了Phg通过靶向GAPDH、MDH2和IDH2,抑制了TEM、TCA和OXPHOS过程,从而减少了线粒体的能量产生和产热。
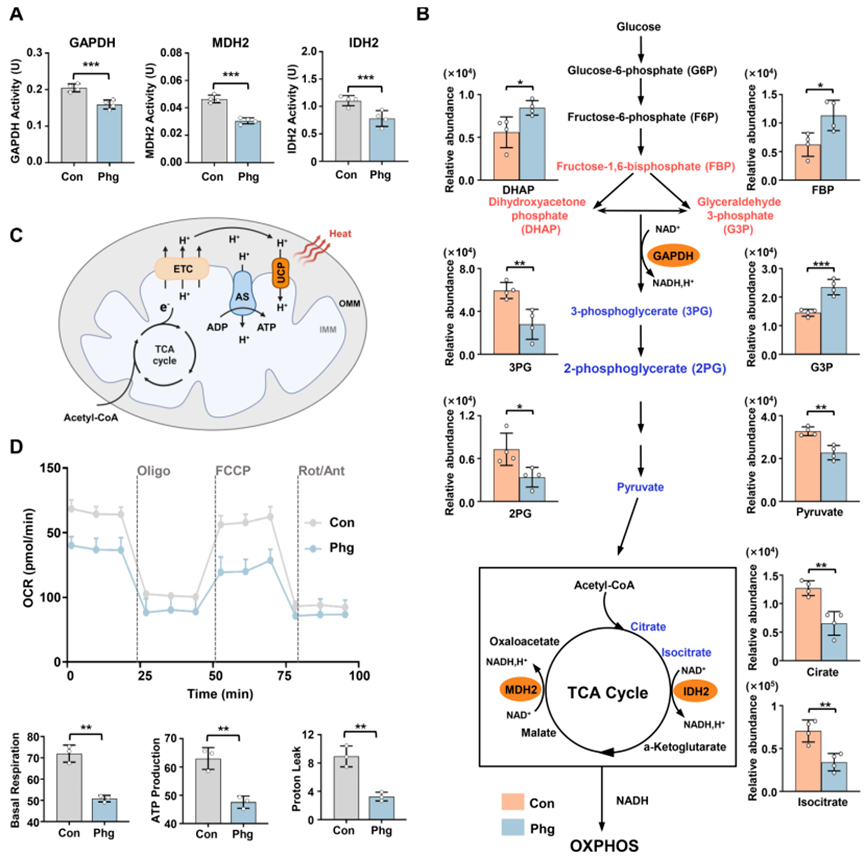
图3 Phg靶向GAPDH、MDH2和IDH2影响细胞能量代谢
Phr通过作用于GAPDH、MDH2和IDH2发挥体内解热和抗炎作用
为深入探究Phr在体内发挥解热抗炎作用的机制是否与GAPDH、MDH2、IDH2的靶向作用相关联,该研究进行了酶活性检测。结果显示,在肺炎发热模型小鼠的血清中,GAPDH、MDH2和IDH2的酶活性显著上升,而Phr则显著抑制了这些蛋白酶活性的增加(图4A-C)。此外,与对照组相比,模型小鼠血清中由这三种蛋白调节的NAD+/NADH比率显著下降,而ATP含量显著上升;Phr则有效地逆转了这些指标的变化(图4D、E)。表明Phr对肺炎发热模型小鼠的体内解热作用与其主要代谢产物Phg密切相关,Phg通过靶向作用于GAPDH、MDH2和IDH2,进而影响能量代谢通路。
研究还进一步阐释了Phr在肺炎发热小鼠模型中的抗炎机制。免疫荧光定位分析揭示,aPhg特异性地靶向了肺炎热小鼠肺组织中的肺巨噬细胞(图4G),这表明巨噬细胞可能是Phr在体内发挥抗炎作用的靶细胞。除了参与能量代谢途径外,GAPDH还可通过多种途径直接或间接影响TNF-α、IL-1β、IL-6等炎症因子的产生,并与其酶活性呈正相关(图4H)。此外,研究还探讨了Phr对LPS诱导的巨噬细胞炎症因子产生的影响。结果显示,LPS诱导的巨噬细胞中TNF-α、IL-1β和IL-6的含量显著增加,而Phg与GAPDH抑制剂DF一样,显著降低了这些炎症因子的含量(图4I-K),这提示Phr在肺炎小鼠体内的抗炎作用可能与其代谢产物Phg特异性靶向肺巨噬细胞中GAPDH,抑制其酶活性,从而抑制相关炎症因子的产生有关。
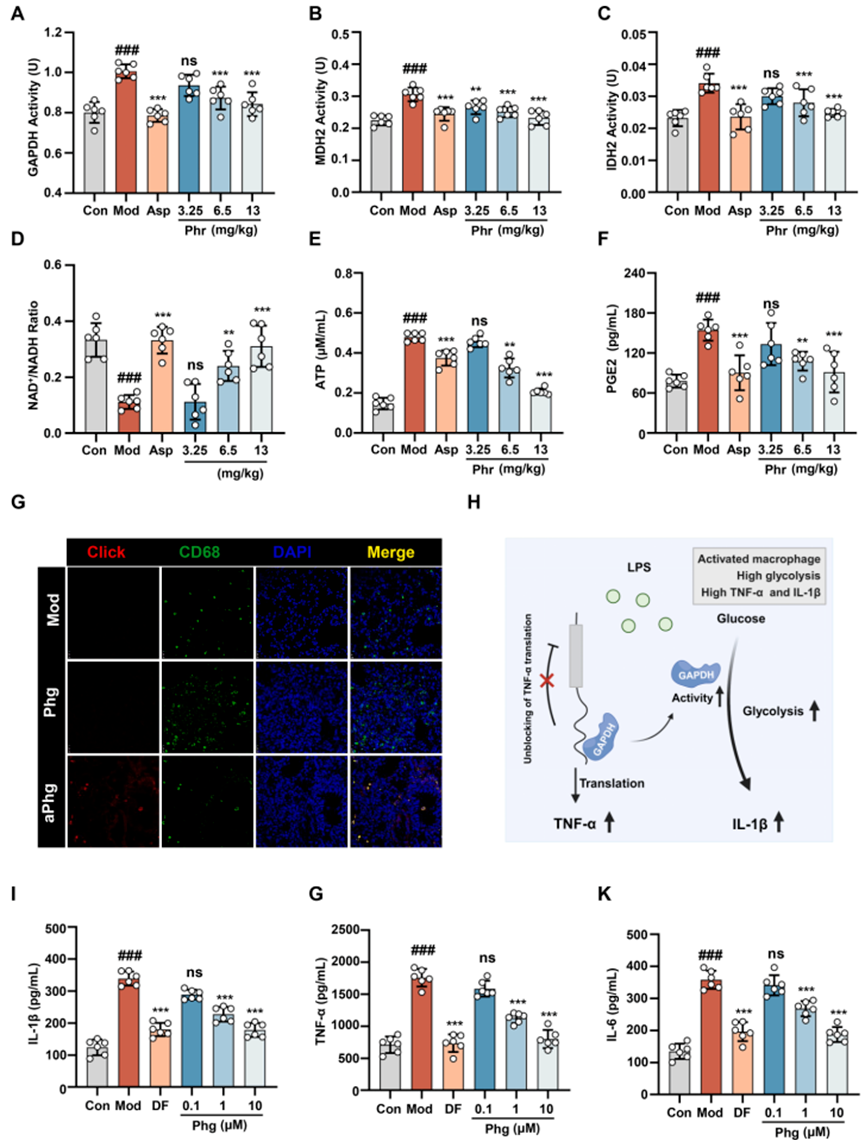
图4 Phg靶向GAPDH、MDH2、IDH2发挥解热、抗炎作用
Phg和Phg-S是Phr的主要活性形式
鉴于Phg-S和Phg-G作为Phr在生物体内主要的代谢产物,研究者进一步通过体外蛋白-分子相互作用实验来验证它们是否同样能够针对GAPDH、MDH2和IDH2进行靶向。表面等离子体共振(SPR)分析揭示了Phr及其代谢物与上述三种蛋白的结合亲和力顺序为Phg>Phg-S>Phr,而Phg-G则不与这三种蛋白中的任何一种发生结合(图5A)。
傅里叶变换红外光谱(FTS)测定结果显示,Phr及其代谢产物提升了GAPDH、MDH2和IDH2的热稳定性,其中Phg和Phg-S的作用较Phr和Phg-G更为显著(图5B-D)。体外酶活性检测表明,Phg和Phg-S显著抑制了GAPDH、MDH2和IDH2的酶活性,而Phr和Phg-G则未显示出对这三种蛋白活性的抑制作用(图5E-G)。据此可以推断,Phg和Phg-S可能是Phr在体内靶向GAPDH、MDH2和IDH2的主要活性形式。
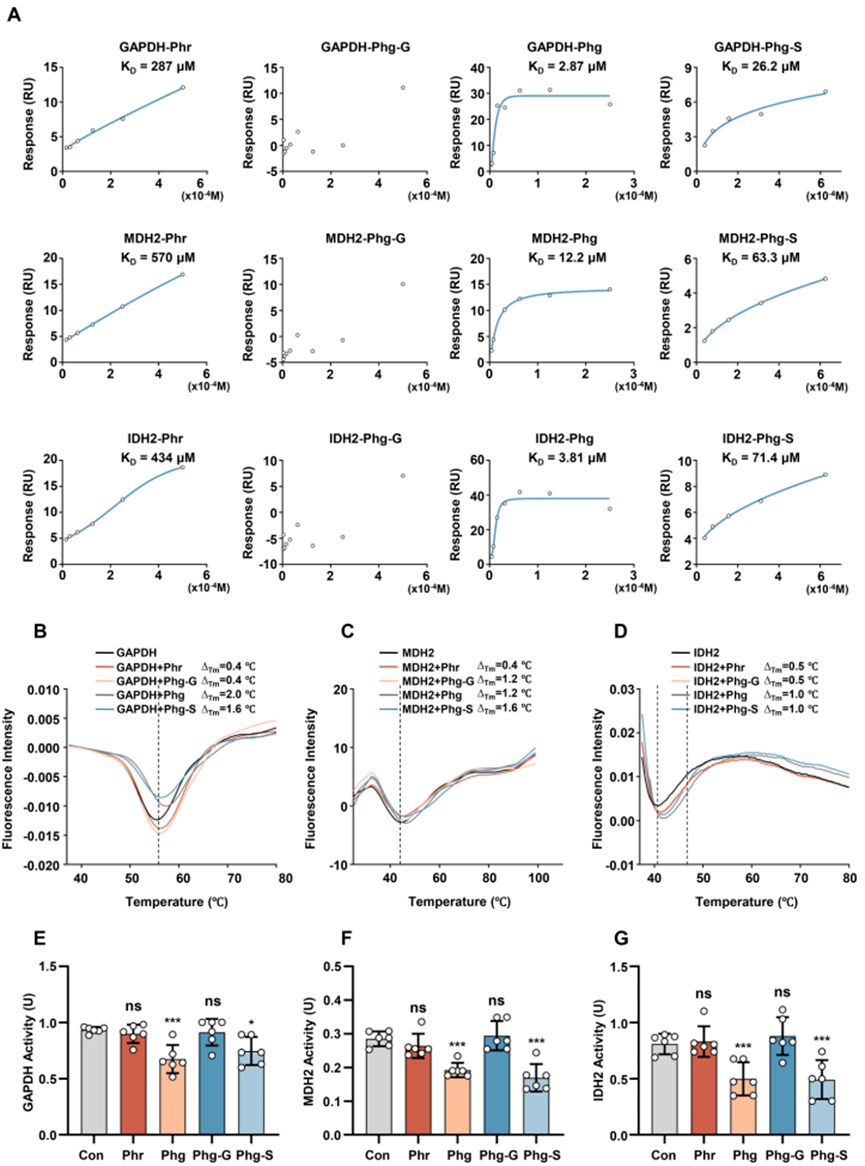
图5 Phg和Phg-S是Phr靶向GAPDH、MDH2和IDH2的主要活性形式
结论
总之,该研究揭示了连翘中的主要药效成分Phr的退热作用与其代谢产物Phg及Phg-S紧密相关,其作用机制涉及对GAPDH、IDH2和MDH2的NAD+结合域的抑制,进而阻碍了酶活性和能量代谢过程,为提升发热治疗的成效提供了新的思路。
参考文献:
Liu W, Li J, Xu S, Wang Y, Li J, Wang S, Fu L, Jiang M, Bai G. Phillyrin and its metabolites exert antipyretic effects by targeting the NAD+binding domain of GAPDH, MDH2 and IDH2. Phytomedicine. 2024 Aug 22;134:155955. doi: 10.1016/j.phymed.2024.155955


