最新综述:肝胆胰肿瘤分子检测现状及如何影响临床诊疗决策
时间:2024-09-29 13:00:23 热度:37.1℃ 作者:网络
肝胆胰肿瘤数量不断增加,是所有主要癌症中预后最差的,代表着一个日益严重的临床问题。其分子诊断已得到显著改善,促进肿瘤分类、明确恶性肿瘤以及发现具有遗传倾向的病例。最重要的是,越来越多的靶向药物、免疫药物获批,以及临床试验开展,预测性分子检测可以识别适合治疗的病例。本综述概述了分子检测的现状及其对临床决策的影响。
研究背景
肝脏、胆管和胰腺肿瘤属于最常见、临床最相关且最具挑战性的恶性肿瘤。此外,其发病率正在上升,尽管在预防、诊断和治疗方面取得了显著进步,但大多数患者的预后仍然不乐观,尤其是在无法实现治愈性切除的情况下。
近年来,由于治疗方法越来越多样化,尤其是全身治疗方案迅速发展,精确诊断和治疗反应预测在肝胆胰癌中的作用越来越大。分子病理学是这些诊断的基石,并以多种方式促进癌症分类(形态分子亚型、不确定病例的恶性评估和对遗传性癌症易感性的怀疑)和预测性检测以指导全身治疗。
肝胆胰肿瘤的分子检测必须反映和适应几个挑战:(a) 切除材料或活检样本(可能很小和/或仅含有少量肿瘤细胞,尤其是在胰腺和胆管活检样本中),在更罕见和特定的情况下,还需要处理液体检测(血液、胆汁、囊液),并且检测方法必须适合这些样本。此外,(b) 检测指征(分型,针对已批准的疗法或分子肿瘤委员会、临床试验的检测,甚至个性化治疗方法)非常重要,并且可能很快因基于分子的辅助和新辅助治疗扩展检测。最后,(c) 检测的可及性、能力、资金和临床环境会影响检测和工作流程的选择。肝活检是一种特殊情况,因为它通常是检测肝外(包括胰腺)或原发部位未知转移性癌症的主要甚至唯一材料。
最近,分子检测在肝胆癌中的临床相关性有所增加。许多成功的临床试验已使分子指导的全身疗法获得批准。此外,生物标志物的复杂性也从单基因检测(通过多基因panel解决所有临床可操作的特定基因变异)增加到复杂标志物检测(例如肿瘤突变负荷 (TMB)、同源重组缺陷 (HRD)、微卫星不稳定性 (MSI))甚至某些情况下全外显子组测序。检测的复杂性、特定组织问题和周转时间代表了分子病理学面临的技术挑战三角,尤其是在肝胰胆肿瘤中。可以预见,这种发展不会停止,需要充分扩大特定病理、生物医学和生物信息学专业知识、资源和设备的规模,这一挑战可能只有专门的中心和网络才能完全解决。
诊断性分子病理检测
肿瘤分类
肝细胞腺瘤
肝细胞腺瘤 (HCA) 是形态和分子分类的典型实体。HCA主要发生于没有预先存在的肝病的(较年轻)女性,与接触类固醇激素有关。此外,代谢(例如肥胖、糖原代谢病)和血管性肝病可能会诱导 HCA 形成。HCA 亚型与潜在并发症以及临床管理有关(表 1)。
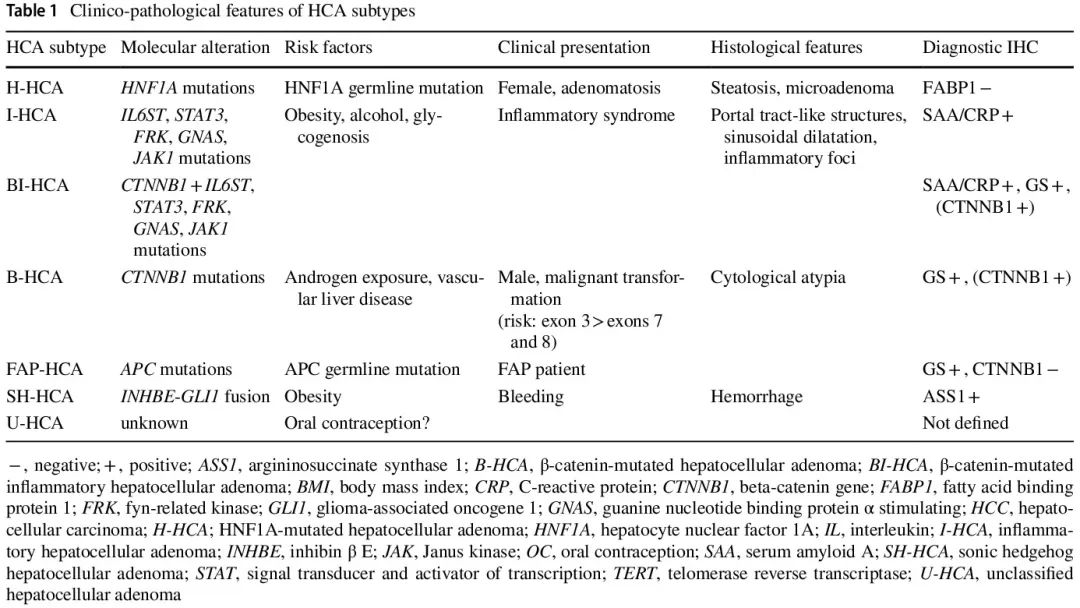
表1
HNF1A 失活的 HCA (H-HCA) 以显著的脂肪变化为特征,免疫组织化学检测显示脂肪酸结合蛋白 1 (FABP1) 呈阴性。虽然它们通常没有较高的恶性转化风险,但已在 60 岁以上且病变直径 > 5 cm 的患者中描述了独立于 CTNNB1 的恶性转化。到目前为止,转化风险尚未与特定的 HNF1A 突变相关联。因此,目前诊断或恶性转化风险评估都不需要对 HNF1A 基因进行测序。值得注意的是,在 HNF1A 胚系突变患者中可能观察到肝腺瘤病(也可能患青少年起病的成人型糖尿病 3 型)。
炎症型HCA (I-HCA) 是由各种基因突变引起的,这些突变会导致 IL-6 信号通路的激活。I-HCA具有一些特殊的组织学特征:炎症灶、窦状扩张和携带导管增生的汇管区样结构。与周围肝组织相比,急性期蛋白(例如血清淀粉样蛋白 A、C 反应蛋白)阳性可用作诊断性免疫标志物。肿瘤相关的急性期蛋白分泌可能导致全身炎症,可通过 HCA 切除术治疗。
CTNNB 基因激活突变是一个 HCA 亚组的特征,具有较高的恶性转化为 HCC 的风险(β-catenin 激活的 HCA,B-HCA)。大约一半的 B-HCA 表现出额外的炎症型 HCA (BI-HCA) 的特征。总体而言,CTNNB1 突变在 HCA 中的发生率为 10% 至 15%。大多数外显子 3 突变会导致 WNT 信号通路高活性,而外显子 7(K335)和 8(N387)突变以及外显子 3 S45 突变会导致较弱的通路激活。谷氨酰胺合成酶 (GS) 和 CD34 免疫组织化学相结合能够在大多数情况下区分这些突变,但建议进行分子检测。具有经典外显子 3 突变的 HCA表现出弥漫性 GS 表达和较高的窦 CD34 表达。外显子 3 S45 突变的特征是异质性 GS 染色,与 GS 阳性但 CD34 阴性边缘有关,而中央病变显示弥漫性毛细血管化。外显子 7/8 突变显示出相似的 CD34 染色模式,但 GS 阳性仅为局部和斑块状。经典外显子 3 突变或 S45 等位基因重复导致 WNT 信号强烈激活,与恶性转化风险高相关。因此,分子检测不仅可以明确 CTNNB 基因突变的确切性质,还可以提供有关恶性转化风险的信息,因此在治疗决策方面具有预测性(切除所有 WNT 通路高度激活的 B-HCA)。
一种罕见的 HCA 亚型表现出融合 INHBE 启动子与 GLI1 的局部缺失导致的音速刺猬信号通路激活 (SH-HCA)。这些肿瘤在肥胖患者中更常见,并且破裂和危及生命的出血风险更高。精氨琥珀酸合酶 1 已被提议作为诊断性免疫标志物。最近描述的家族性腺瘤性息肉病 (FAP)-HCA 发生于 APC 基因胚系突变的患者,并且还显示 WNT 信号通路激活,表现为谷氨酰胺合成酶强阳性。因此,该罕见亚型与 B-HCA 有共同的特征,但它没有显示核 β-连环蛋白积聚,并且尚未确定这些 HCA 恶性转化风险增加。最后,不符合上述亚型的罕见 HCA 被归为未分类的 HCA (U-HCA)。
肝细胞癌
已经进行了许多或多或少不同的尝试,使用分子遗传学检测、表达谱分析(基于 RNA 和蛋白质)、表观遗传学及其组合对肝细胞癌 (HCC) 进行细分。这些分析揭示了导致不同 HCC 发展模式的分子机制,从而为进一步研究提供了基础。这些方法均未用于 HCC 诊断或 HCC 患者的临床管理,因为它们存在一些缺点:就分类方案和方法有许多建议,但尚未达成共识。由于仅包括早期(可切除)肿瘤,尚不清楚分类方案是否代表分子肿瘤分型或分期,以及它们在多大程度上适用于进展性 HCC。
显然,HCC 除了大多数具有不同生长和细胞学模式的典型 HCC(HCC,非特指型)外,还包含几种特定的形态和分子亚型,这些亚型具有特殊的组织学、分子、临床和生物学特征(表 2),其表型通常在整个肿瘤进展过程中保持稳定。HCC 亚型已被纳入第 5 版世界卫生组织 (WHO) 分类。分子检测可能支持在可疑病例中诊断这些亚型,例如纤维板层、硬化或嫌色细胞型 HCC。其他亚型,例如富含淋巴细胞和脂肪变性亚型,定义仍不太明确,缺乏公认的诊断适用分子标志物。
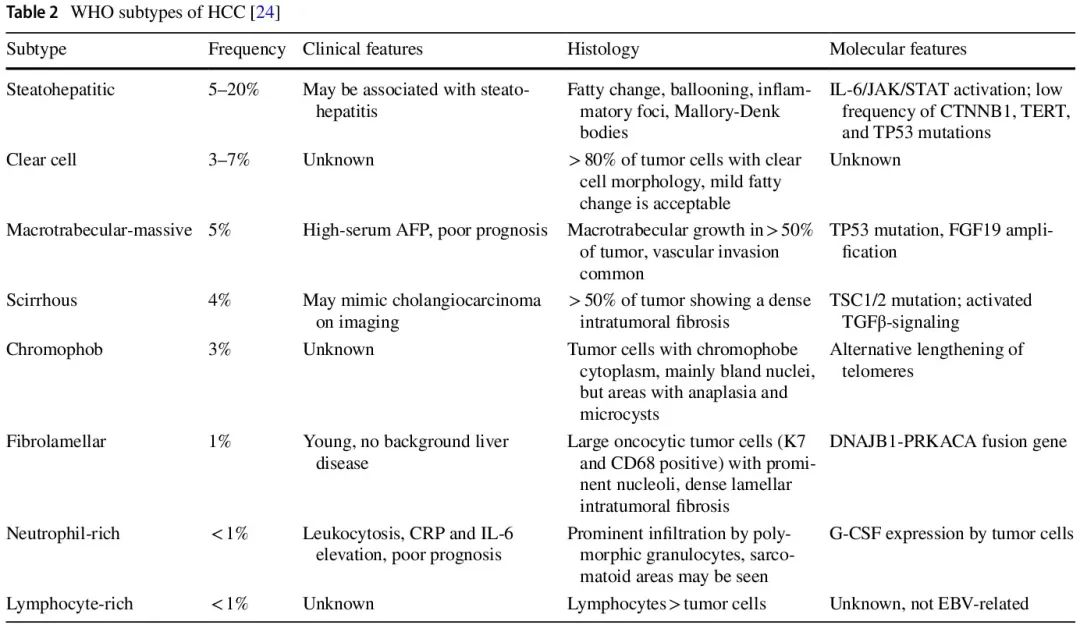
表2
在极少数情况下,HCC 中乙肝病毒 DNA 整合的出现可能表明职业感染与 HCC 发展之间存在因果关系。
胆管癌
肝内胆管癌 (iCCA) 是第二常见的恶性原发性肝肿瘤实体,需要与胆囊癌 (GBCA) 和肝外胆管疾病 (eCCA) 区分开来。动物模型表明,iCCA 可能(在某些条件下)由肝细胞发展而来。根据这一假设,已提出通过白蛋白原位杂交检测白蛋白 mRNA 表达来支持小管 (sd)-iCCA 的诊断。
在组织学层面,sd-iCCA 由非黏液性立方形细胞组成,在促纤维增生性基质中形成小管状和导管结构,与大导管 (ld) 类型不同,后者在生物学上与 eCCA 相似,并含有分泌粘蛋白的柱状癌细胞。sd-iCCA 与 HCC 具有相同的病因风险特征和原发性结节生长模式,而 ld-iCCA 则反映了 eCCA 的病因和生长模式。
虽然 eCCA 和 iCCA 具有一些共同的突变(例如 TP53、BRCA1、BRCA2、PK3CA、KRAS、SMAD4、ARID1A、GNAS),但其他突变对于小导管 iCCA 尤其典型(IDH1、IDH2 和 BAP1 突变以及涉及 FGFR2、NRG1、ALK、NTRK1-3 和可能其他基因的易位;表 3),并且最终可能允许在原发灶不明癌 (CUP) 情况下发现 iCCA。这具有直接的临床意义,因为肝 CUP 腺癌的描述可能为患者提供几种基于指南和批准的特定靶向和非靶向治疗选择,这些选择优于标准 CUP 腺癌化疗。
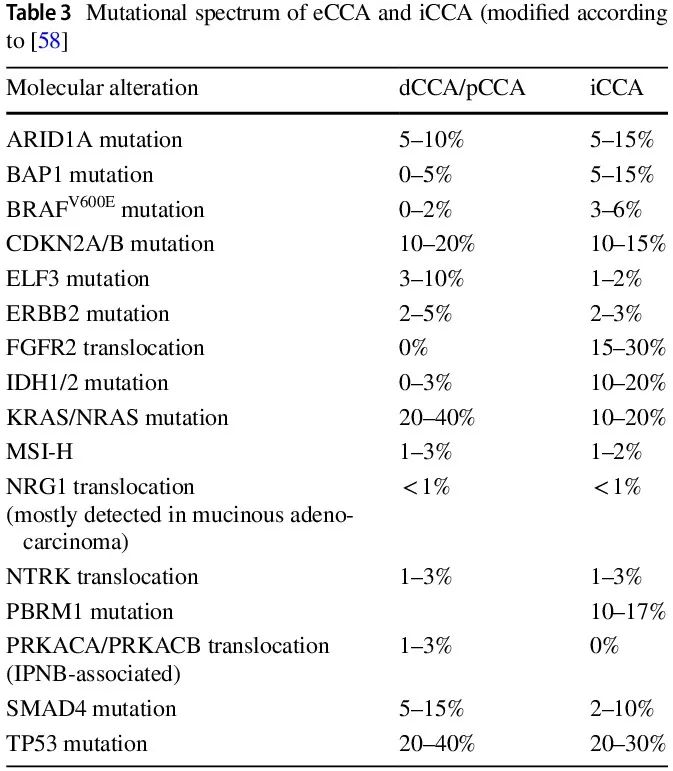
表3
有证据表明,小导管 iCCA,与 HCC 类似,可能在很大程度上包含各种不同的、低频率的、形态和分子定义的亚型;除了已经识别的胆管细胞和胆管板畸形样亚型外,最近还定义了具有特殊形态、抑制素阳性和诊断性 NIPL-NICC1 易位的实性管状囊性(“胆管母细胞”)亚型。已经提出了进一步的潜在形态分子亚型并等待确认。
胰腺癌
几项研究基于从细胞系和 PDAC 组织获得的微阵列数据、从构成肿瘤微环境 (TME) 的细胞中获得的转录本数据进行 RNA 测序计算机减法,尝试对胰腺导管腺癌 (PDAC) 进行分子细分。基于这些结果和其他研究,现在已达成一些共识,承认至少有两种不同的分子亚型,它们之间存在一些重叠以及肿瘤间和肿瘤内异质性(经典型和基底型)。一些临床研究旨在利用分子亚型以及其他基于 RNA 的特征来指导全身治疗的疗效。或者,通过评估拷贝数变异 (CNV) 和更大的染色体重排,可以将 PDAC 分为四种亚型:“稳定”、“局部重排”、“分散”和“不稳定”。这些可能在未来得到临床探索,因为不稳定亚型与同源重组缺陷有关,并且有证据表明富含 CNV 的肿瘤往往表现出冷 TME。目前,临床上不需要分子检测来定义或分类 PDAC。
其他肿瘤实体
在其他肝脏肿瘤实体中,很少需要分子检测进行分类。罕见的例外可能是可疑恶性上皮样血管内皮瘤病例。WWTR1-CAMTA1 融合基因(高达 90% 的病例)或罕见的 YAP1-TFE3 易位可能支持可疑病例的诊断。在肝 CUP 腺癌病例中,分子改变的模式可能为实体提供有价值的信息。例如,检测到 FGFR2 易位可高度确定地将肿瘤表征为 sd-iCCA,并为患者提供几种已获批的全身治疗选择。
明确恶性肿瘤
肿瘤分类包括可靠地区分良性或癌前肝细胞病变与早期高分化HCC。一种情况是B-HCA恶性转化为HCC,另一种情况是癌前发育不良结节与高分化HCC之间的鉴别诊断(图1)。
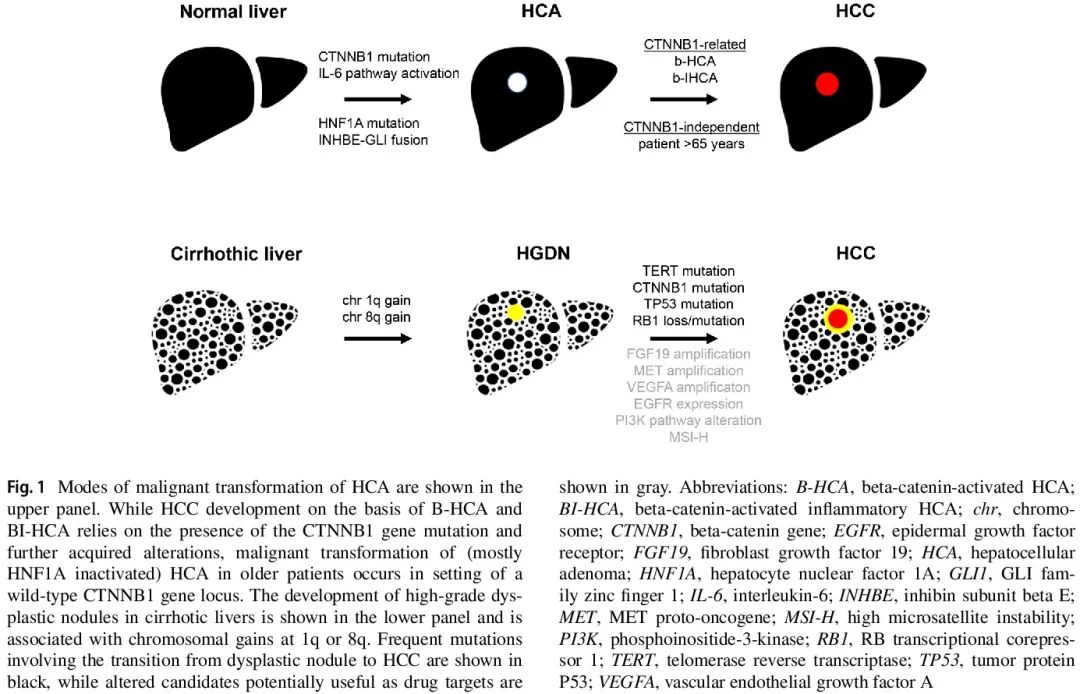
图1
值得注意的是,由潜在慢性肝病引起的周围肝组织的组织学变化,加上基质诊断(例如年龄较大、男性、患有慢性肝病、患者来自高危地区)可能支持 HCC 而非 HCA 或 FNH 的诊断。由于在关键的活检标本中很少发现恶性转化的明确组织病理学特征(间质和血管侵犯),除了小梁结构紊乱的表现外,CD34 免疫组织学显示 HCC 中肝窦弥漫性毛细血管化可能支持高分化 HCC 的诊断。此外,免疫组织学标志物组合(热休克蛋白 70、磷脂酰肌醇蛋白聚糖-3 和 GS;表 4)成为高分化肝细胞肿瘤中恶性肿瘤的分子辅助诊断标准。其在独立研究中提供了高灵敏度(~ 70%)和近乎完美的恶性肿瘤检测特异性。此外,检测端粒酶逆转录酶启动子突变可能有助于识别高分化肝细胞肿瘤中的恶性转化,即 HCA 和发育不良结节 vs HCC 。它利用了这样一个事实:hTERT 启动子突变的频率从 HCA(0%)到“交界性”病例(17%)再到起源于 HCA 的 HCC(56%),以及从发育不良结节(6-19%)到早期高分化 HCC(43-61%)显著增加。必须注意的是,检测 hTERT 启动子突变需要特定的基于 DNA-PCR 的检测,不能通过标准 panel 检测或 WES 检测。
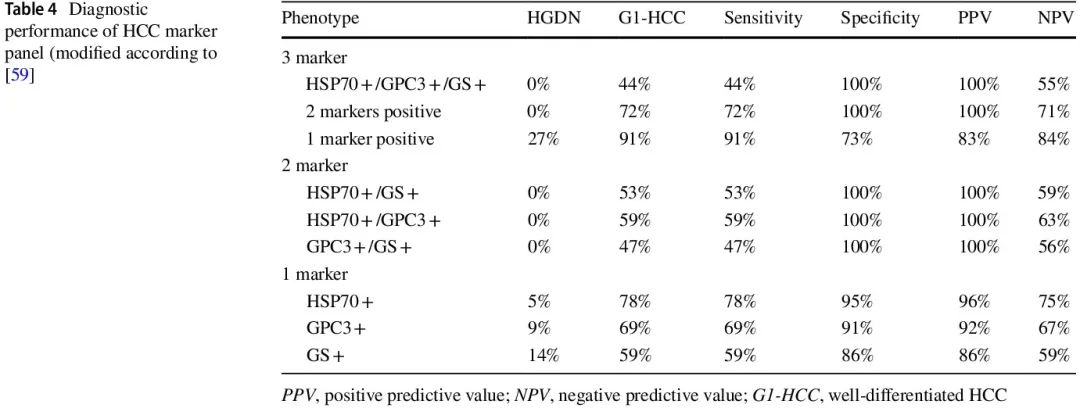
表4
在约 85-90% 的病例中,PDAC 可能由不同的癌前前体发展而来:胰腺上皮内瘤变 (PanIN) 从低级别病变发展为高级别病变,并积累基因变异(例如 KRAS、SMAD4、TP53 突变)。此外,导管内乳头状黏液性肿瘤 (IPMN) 可能从低级别发育不良发展为高级别异型增生,进而发展为 PDAC,而黏液囊性肿瘤 (MCN) 则更少见,可能会发生恶性转化。KRAS 突变在肿瘤发展早期即可观察到(即,即使在低级别 PanIN 和 IPMN 中也是如此),90% 以上的 PDAC 携带 KRAS 激活突变作为主要驱动事件。虽然胰腺癌变中的恶性转化诊断完全依赖于组织学而不需要任何分子检测,但对抽吸液进行分子检测可能有助于明确囊性胰腺病变的性质。
遗传性癌症综合征和遗传性肿瘤易感性
遗传性癌症综合征中肝脏和胆管系统受累的情况非常罕见。绝大多数具有遗传背景的 HCC 病例是由遗传性代谢疾病引起的(例如遗传性铁贮积病、遗传性酪氨酸血症 I 型(罕见)、威尔逊氏病(罕见))。在这些病例中,严重的肝病表现为 HCC 和 iCCA 的发展提供了土壤。因此,预防肝脏受累可消除肿瘤发展的风险。遗传性肿瘤易感性综合征中肝脏受累的相对保护原因尚不清楚。因此,没有迹象表明需要在 HCC 和 CCA 中检查遗传性癌症综合征。肝腺瘤病(> 10 HCA)或组织学或免疫组织学在 HCA 切除标本的非肿瘤实质中检测到多个类似的微病变时,可能存在胚系突变导致的遗传易感性。血管平滑肌脂肪瘤 (AML) 与结节性硬化症有关,但与肾 AML 相比,肝 AML 中这种相关性要低得多。观察到少数与 Peutz-Jeghers 综合征 (STK11)、遗传性胰腺炎 (PRSS1、SPINK1、CFTR)、家族性黑色素瘤 (CDKN2A、CDK4、BAP1)、林奇综合征 (MLH1、MSH2、MSH6、PMS2)、遗传性乳腺癌和卵巢癌综合征 (BRCA2、BRCA1、PALB2)、Li-Fraumeni 综合征 (TP53)、FAP (APC)、毛细血管扩张性共济失调综合征和聚合酶校对相关息肉病 (POLE、POLD1) 相关的遗传性胰腺癌病例。
预测性分子病理检测
肝细胞癌
尽管存在潜在的可靶向分子改变,但目前为止,尚未有 HCC 实体特异性靶向治疗获批。针对 MET 过度表达或 RAS 突变的 HCC 的临床试验未能显示出总体生存获益,可能是由于检测策略或药物疗效存在缺陷。此外,HCC 缺乏活检,严重限制了 HCC 试验中的预测性检测,试验相关分子分析和几项采用通路靶向药物的试验并不依赖于预测性检测。提供与实体无关的特定全身治疗的变异,例如 NTRK 易位、同源重组缺陷或 MMR 缺陷,极其罕见,定期诊断检测不合理。尽管越来越多的证据表明治疗反应取决于 HCC 的分子特征,但目前一线和二线全身治疗方法不需要分子检测。“免疫热”HCC 更有可能对免疫肿瘤治疗产生反应,而 CTNNB1 突变的 HCC 则相对“免疫冷”,似乎对 TKI 的反应更好。仑伐替尼似乎对 FGFR 激活的 HCC 起作用,并且耐药性似乎涉及 EGFR 通路的补偿性激活;此外,预测索拉非尼疗效较好和较差的分子标志物可能存在。尽管如此,目前 HCC 的预测性分子检测主要局限于分子肿瘤委员会的广泛检测和个别的跨适应症尝试。
胆管癌
大多数 CCA 患者被诊断为晚期疾病。顺铂和吉西他滨联合治疗改善了中位总生存期,并成为十多年来的标准一线全身治疗。TOPAZ-1 试验数据显示,将 PD-L1 抑制剂度伐利尤单抗添加到该治疗方案中时,晚期胆道癌患者的总生存期和无进展生存期得到改善。
通常,针对分子变异的二线治疗可能会显著影响治疗决策。在上述常见基因变异中,IDH1 和 BRAFV600E 突变以及 FGFR2 融合已引起临床主要关注。在 ClarIDHy 研究中,IDH1 抑制剂艾伏尼布在先前接受过治疗的晚期 IDH1 突变胆管癌中表现出临床益处,并已获批用于二线治疗。此外,在一项 2 期研究中,BRAF 和 MEK 双重抑制在 BRAFV600 突变胆道癌患者中显示出良好的活性。
iCCA 的另一个重现性分子特征是存在主要可靶向基因融合。特别是,FGFR2 基因融合发生率较高,已成为一个有吸引力的靶点。最初,FIGHT-202 研究首次证明,选择性口服 FGFR 抑制剂在既往接受过治疗且检测到 FGFR2 基因重排的 CCA 患者中产生客观缓解,这一发现促使佩米替尼单药疗法获批用于治疗 FGFR2 融合阳性 CCA 成人患者,这些患者既往至少接受过一线全身治疗且疾病进展。此外,英菲格拉替尼获批用于治疗难治性晚期 CCA。这两种药物都是 ATP 竞争性的,可逆地结合 FGFR 激酶结构域中的 ATP 结合口袋。抑制剂普遍导致获得性耐药突变。与 FGFR 共价结合的下一代抑制剂也带来了可衡量的临床获益。因此,临床相关的 FGFR 抑制剂的前景在不断发展。
其他可靶向用药基因重排包括涉及 NRG1 和 NTRK 基因的融合。尽管在所有类型的胆管癌中很少检测到参与 DNA 修复的基因失活突变(例如 MLH1、MSH2、MSH6、PMS2、POLE,致病或可能致病变异的频率约为 1%),但它们代表了跨适应症免疫检查点阻断疗法的宝贵靶点。
同时,至少在专门的中心,建议对每位晚期 iCCA 患者进行分子病理检测,至少应涵盖 FGFR2 融合、IDH1 和 BRAF 突变以及 NTRK 融合和微卫星不稳定性。超过 50% 的 iCCA 携带潜在可用药变异,我们最近证明,在临床实践中使用大型 DNA 和 RNA panel进行分子检测可以提高患者的生存率。除了上述靶点外,成功处理的分子变异包括 BAP1、BRCA1、IDH2 和 PIK3CA 突变,ERBB2 扩增以及 MET 和 NRG1 融合。
胰腺癌
虽然缺乏获批的特定靶向治疗,并且获批的泛癌种疗法面临 PDAC 中极低的变异频率,但一些改善的迹象正在出现。约 90% 的胰腺导管腺癌是由 KRAS 突变驱动的,目前,靶向治疗尝试尚未成功。但等位基因特异性(约 1.5% 的 PDAC 为 G12C,>40% 为 G12D)和等位基因无关的 KRAS 小分子抑制剂的出现可能会影响治疗前景。其余约 10% 的 PDAC 显示野生型 KRAS,可能携带涉及各种驱动因素(例如 NRG1、BRAF、ALK、NTRK1-3)的基因融合,原则上适合治疗方法。根据 ESMO-ESCAT,NTRK 抑制剂治疗被分类为 IC。这些 PDAC 病例在临床上与年轻时发病有关(< 50 岁),需要特别注意,对于 KRAS 野生型 PDAC,应使用适当的方法检测基因易位(例如,荧光原位杂交、基于 RNA 的靶向 NGS),探究是否存在潜在可用药基因融合。这种方法也得到了 ESMO 指南的认可。大约 5-7% 的 PDAC 携带 HRR(同源重组修复)基因突变。这些大多是胚系事件,随后通常发生体细胞二次打击,这两者都可以在肿瘤组织中识别。这些肿瘤表现出 HRD(同源重组缺陷)表型,使得肿瘤对 PARP 抑制剂或铂类药物敏感。研究表明,PARP 抑制剂可延长 BRCA1 和 BRCA2 致病/可能致病变异病例的无进展生存期,但未能显示出总体生存获益。尽管如此,目前的指南仍建议检测 BRCA1/2 状态(ESMO-ESCAT 分类:IA)。极少数 PDAC 病例(约 0.5–1.0%)与错配修复缺陷 (dMMR) 有关,试验数据显示对检查点抑制剂有中等至良好的反应。鉴于这些数据以及有限的治疗选择,建议通过免疫组织化学检测 dMMR (ESMO-ESCAT 分类:IC)。互补的基于 PCR 的检测和 NGS 可能支持 dMMR/MSI-H 检测。
原发灶不明癌 (CUP)
肝 CUP 腺癌是一种常见的临床相关疾病,需要特别考虑。即使分子检测可能无法缩小实体范围,全面的预测性检测也可能很有价值,因为它可能为患者提供标准非靶向化疗之外的特定治疗选择。最近的试验比较了分子指导的疗法和标准铂类化疗在不利非鳞 CUP 患者中的临床疗效,结果表明,接受基于预测性分子生物标志物的治疗的患者 HR 和缓解率显著较高。因此,目前的 ESMO 指南强烈建议在 CUP 患者的诊断检查中进行分子病理学指导的检测。
前 景
可以预见许多不同的发展,对分子病理学诊断具有重要意义。可能需要预测性检测的获批药物的数量将进一步增加。新的临床环境将显著增加分子检测,包括分子靶向药物抗体偶联物、靶向药物的扩展、辅助治疗(乳腺癌和肺癌中已经出现)和新辅助治疗的相应分子检测以及(基于突变的)新抗原靶向免疫肿瘤治疗的整合。HCC 的形态和分子分类远未完成,在 iCCA 中也刚刚开始;因此,可以预期在合适的诊断中会出现需要相应分子检测的新亚型。
分子病理诊断必须适应这些挑战,同时考虑到适应症、材料、资源和工作流程。考虑到实体、适应症和标志物的复杂性和多样性,基于核酸的检测将越来越多地朝着“通用”方法和“一站式工作流程”发展,以满足时间、资源和材料限制。
重要的是,成功实施个性化肿瘤学方法以及先进的分子检测在很大程度上取决于处理时间。这包括分子检测所需的时间、个性化治疗或临床试验的推荐,以及潜在建议的跨适应症疗法的可及性和费用。专用的临床基础设施,如德国西南部的个性化医疗中心,可能为实施精准肿瘤学方法提供全面的框架(广泛的分子检测和分子肿瘤委员会),并可能有助于降低进展期肿瘤的分子检测和治疗的退出率。
参考文献:
Longerich T, Stenzinger A, Schirmacher P. Molecular diagnostics of hepatobiliary and pancreatic neoplasias. Virchows Arch. 2024 Feb;484(2):263-272. doi: 10.1007/s00428-024-03744-5. Epub 2024 Mar 1. PMID: 38429607; PMCID: PMC10948571.



