河南大学黄永伟/高能物理所王黎明Nano Letters:肺选择性富集的苝酰亚胺高效治疗肺纤维化
时间:2024-09-29 14:00:45 热度:37.1℃ 作者:网络
【研究背景】
特发性肺纤维化(Idiopathic pulmonary fibrosis,IPF)是一种致命性肺疾病,患者确诊后生存期不足3年。更为严峻的是,仅有吡非尼酮和尼达尼布两种药物广泛用于特发性肺纤维化临床治疗,且此类药物仅能减缓但无法逆转纤维化进程,因此,发展治疗特发性肺纤维化新型药物迫在眉睫。此外,目前肺疾病的治疗主要给药方式为口服、雾化吸入、静脉注射等,药物在肺组织富集不佳也是患者治疗的主要障碍之一。因此,发展可实现肺部选择性富集的新型药物,探究其递送和治疗机制对特发性肺纤维化患者乃至肺疾病患者具有重要意义。
鉴于此,河南大学基础医学院黄永伟教授团队和中国科学院高能物理研究所王黎明研究员团队合作,设计和制备一类新型苝酰亚胺衍生物PDIC-DPC, 系统研究了该化合物在肺富集机制和治疗特发性肺纤维化效应。
【图文讲解】
PDIC-DPC肺选择性富集结果和机制
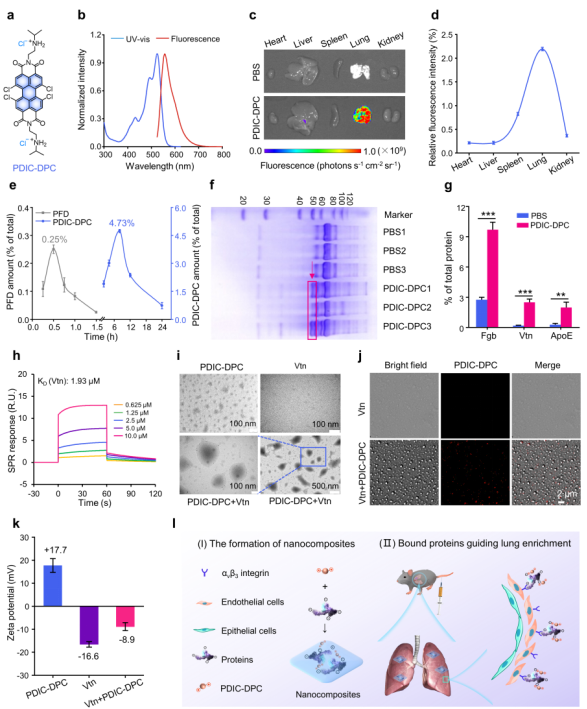
研究人员首先制备一类水溶性苝酰亚胺衍生物PDIC-DPC(图1a),该化合物具有较高的荧光量子产率(图1b)。尾静脉注射后,组织成像显示其主要富集于肺组织(图1c),将各器官粉碎后经荧光定量分析表明PDIC-DPC在肺部的富集量相对于其他组织提高了3-10倍(图1d),表明PDIC-DPC可实现肺选择性富集。同吡非尼酮相比,PDIC-DPC在肺部富集的峰值浓度提高了17.8倍(图1e),进一步确证了PDIC-DPC具有肺选择性富集特性。PDIC-DPC肺富集可能与其进入血浆后结合的血浆蛋白种类相关。与PBS组相比,十二烷基硫酸钠—聚丙烯酰胺凝胶电泳(SDS-PAGE)结果显示PDIC-DPC特异性结合蛋白分子量主要集中于50-60 kD(图1f),蛋白组学揭示,50-60 kD范围内丰度较高的血浆蛋白主要是纤维蛋白原β链(Fibrinogen beta chain,Fgb)和玻连蛋白(Vitronectin,Vtn),较PBS组分别提高了3.5倍和13.8倍(图1g)。表面等离子体共振结果显示,PDIC-DPC与Vtn、Fgb的解离速率常数(Dissociation constant,KD)分别为1.93 μM和24.7 μM(图1h),表明PDIC-DPC和Vtn、Fgb之间具有较强的结合亲和力。透射电镜和共聚焦显微镜的结果证明PDIC-DPC可与Fgb和Vtn蛋白形成纳米复合物(图1i和1j)。该复合物与肺内皮细胞和肌成纤维细胞中αvβ3整合素结合,引导PDIC-DPC实现肺选择性富集。
PDIC-DPC逆转肺纤维化的治疗效应
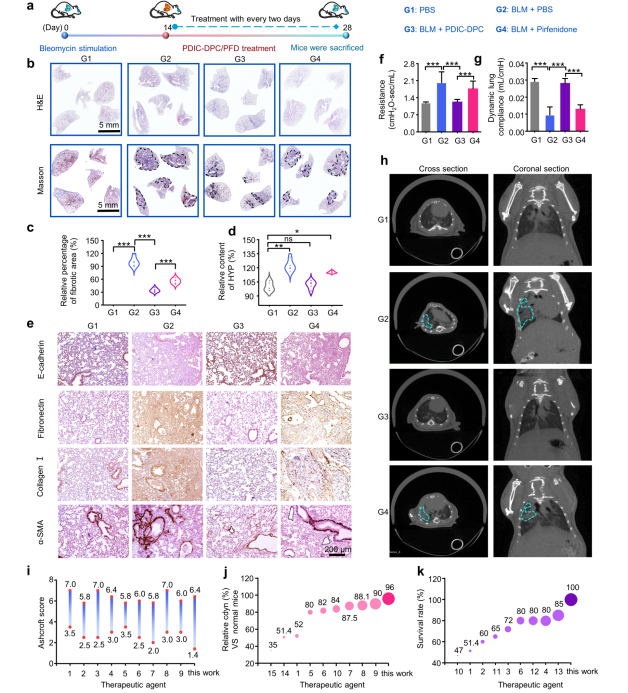
本研究构建了博来霉素诱导的肺纤维化病理模型评估PDIC-DPC的治疗效果(图2a)。PDIC-DPC可有效减少肺纤维化病变区域,并重建了肺泡的正常结构(图2b,2c),恢复了肺组织的弹性和顺应性(图2f,2g),呼吸功能得以显著提升。小动物显微CT结果也表明,肺纤维化区域(CT上表现为蛛网状病变)明显减少,显著优于吡非尼酮的治疗效果(图2h)。同时,肺纤维化的标志性指标如羟脯氨酸(Hydroxyproline,HYP)、α-平滑肌肌动蛋白(Alpha smooth muscle actin,α-SMA)等显著改善(图2d,2e),治疗后小鼠体重无明显减轻,存活率达到100%,证明其可以有效阻止肺纤维化进程且具有良好的生物安全性。与已报道数据相比,PDIC-DPC治疗后小鼠具有最小的Ashcroft评分,肺功能可恢复至正常小鼠的96%及100%生存率(图2i-2k),再次验证了PDIC-DPC具有优异治疗肺纤维化效果。
PDIC-DPC治疗肺纤维化生物学机制
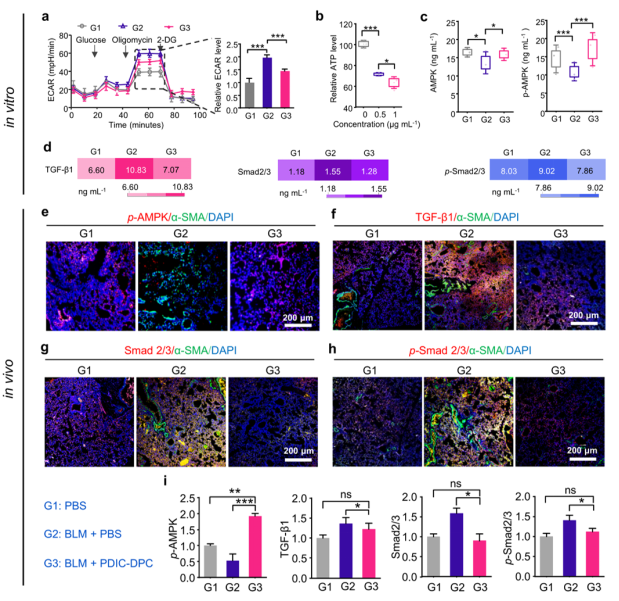
肌成纤维细胞作为肺纤维化的主要效应细胞,对其发生发展起到关键作用。PDIC-DPC可通过诱导肌成纤维细胞凋亡和抑制肌成纤维细胞的生成两方面抑制肺纤维化发生发展。单磷酸腺苷活化蛋白激酶(Adenosine monophosphate-activated protein kinase,AMPK)和转化生长因子-β(Transforming growth factor beta,TGF-β)通路相关蛋白的表达水平与肺纤维化的进展高度相关。体外实验(细胞水平)结果表明,PDIC-DPC作用后,肌成纤维细胞的糖酵解能力下降约25%(图3a),导致细胞内三磷酸腺苷(Adenosine triphosphate,ATP)生成减少进一步激活AMPK磷酸化过程(图3b,3c),同时抑制TGF-β通路相关蛋白的表达阻止纤维化进程(图3d)。体内实验(动物水平)结果进一步证实了PDIC-DPC对AMPK和TGF-β通路的共同作用(图3e-3i)。与博来霉素处理的对照组相比,肺组织切片的免疫荧光分析揭示PDIC-DPC治疗组中p-AMPK的表达量显著提升了约100%,而转化生长因子-β1(Transforming growth factor beta1,TGF-β1)、Smad2/3及磷酸化Smad2/3(p-Smad2/3)蛋白水平则分别下降了20%、74%和35%。总之,PDIC-DPC通过激活AMPK通路和抑制TGFβ-Smad通路阻止了肌成纤维细胞的激活和功能,实现了肺纤维化高效治疗。
【结论】
本研究设计和制备一类新型苝酰亚胺衍生物PDIC-DPC, 系统研究了该化合物在肺富集机制和治疗特发性肺纤维化效应。组织成像显示PDIC-DPC主要富集于肺组织。富集机制研究揭示,PDIC-DPC可与Vtn和Fgb蛋白形成纳米复合物,该复合物与肺内皮细胞和肌成纤维细胞中αvβ3整合素结合,引导PDIC-DPC实现肺选择性富集。PDIC-DPC治疗肺纤维化效应结果显示,该化合物可激活p-AMPK表达,抑制TGFβ产生,逆转小鼠肺纤维化进展。与已报道数据相比,PDIC-DPC治疗后小鼠具有最小的Ashcroft评分,肺功能可恢复至正常小鼠的96%,实验期间患病小鼠存活率达100%,实现最优异的治疗效果。该工作重要意义在于揭示了肺选择性富集小分子药物递送新机制,首次将苝酰亚胺衍生物用于肺纤维化治疗领域,为重大肺疾病治疗提供了理论和物质基础。
参考文献:
Yuting Liu, Damin Xu, Xiaoyi Xing, Anqi Shen, Xinpeng Jin, Shijiao Li, Zhonghua Liu, Liming Wang, Yongwei Huang, Lung-Targeting Perylenediimide Nanocomposites for Efficient Therapy of Idiopathic Pulmonary Fibrosis, Nano Letters, 2024, DOI: 10.1021/acs.nanolett.4c04089.


