安徽医科大学刘琦/南开大学刘阳《AM》:溶酶体靶向聚集性纳米颗粒逆转免疫抑制肿瘤微环境用于癌症免疫治疗
时间:2024-10-05 17:00:37 热度:37.1℃ 作者:网络
近年来,纳米医学的研究主要集中在开发纳米颗粒作为药物载体,以最大限度地提高载药的生物利用度,而很少关注纳米颗粒直接对抗癌症或调节相关生理过程的潜力。近期研究表明,一些具有特定成分、化学结构或表面形态的纳米颗粒(例如,氧化石墨烯纳米片、锰纳米颗粒等)可以发挥某些生物学功能。因此,合理设计的纳米颗粒提供了直接对抗癌症的机会,而不是装载治疗药物。溶酶体在维持细胞稳态中起着至关重要的作用,一旦溶酶体膜通透性(Lysosomal membrane permeabilization, LMP)发生改变,溶酶体倾向于将各种水解酶(如组织蛋白酶)释放到细胞质中,导致溶酶体依赖性细胞死亡。此外,细胞癌变改变了溶酶体膜的结构和功能,使其比正常细胞溶酶体更脆弱,对LMP更敏感。迄今为止,几种类型的小分子(如溶酶体清洁剂、膜溶解肽和光敏剂)已被报道用于诱导LMP,并且还开发了基于纳米颗粒的LMP诱导剂,具有高LMP诱导效果和低毒副作用。但在大多数基于纳米颗粒的策略中,LMP是由纳米载体递送的化学试剂诱导的,纳米材料不具有LMP诱导活性。此外,现有的LMP诱导剂没有被报道用于诱导免疫原性细胞死亡(Immunogenic cell death, ICD)。
近日,安徽医科大学药学院刘琦副教授团队与南开大学化学院刘阳教授团队针对目前没有可用的能够高效诱导ICD的LMP诱导剂,构建了一种新型具有生物活性的溶酶体靶向聚集性纳米颗粒(Lysosomal-targeting aggregated nanoparticle, LTANP)来诱导LMP并激活ICD相关的抗肿瘤免疫反应。LTANP具有核-壳结构,其核为表面具有定制比例的甘露糖-6-磷酸配体(M6PL)和1-乙烯基咪唑(VI)的蛋白质纳米胶囊(PNC),而壳是由pH响应型聚乙二醇(PEG)形成,该结构使得LTANP在血液循环和正常器官中保持稳定,最终在肿瘤组织中富集。PNC被肿瘤细胞摄取转运至溶酶体后形成大尺寸的聚集体难以通过胞吐作用被清除,最终诱导LMP。此外,LTANP诱导的LMP可以干扰自噬-溶酶体途径有效触发ICD,随后通过释放钙网蛋白(CRT)、高迁移率族蛋白B1(HMGB1)和三磷酸腺苷(ATP),促进树突状细胞(DCs)的成熟,增加CD8+ T细胞的肿瘤浸润,降低髓源性抑制细胞(MDSCs)和调节性T细胞(Tregs)的聚集,并将M2样巨噬细胞极化为M1样巨噬细胞,从而逆转免疫抑制性肿瘤微环境。但是,LTANP诱导LMP过程中显著提高了癌细胞表面PD-L1的表达。为了解决这一问题,该团队将LTANP与PD-L1单克隆抗体(αPD-L1)联合使用,进一步增强了癌症免疫治疗效果(图1)。随着LTANP对B16F10荷瘤小鼠的全身给药,研究发现LTANP在血液循环中维持稳定并有效在肿瘤部位蓄积,可有效激活全身抗肿瘤免疫应答,重塑免疫抑制肿瘤微环境,从而将肿瘤免疫原性从“冷”转化为“热”状态。此外,LTANP进一步激活了特异性抗肿瘤免疫记忆效应,显著抑制了恶性肿瘤的复发和转移。
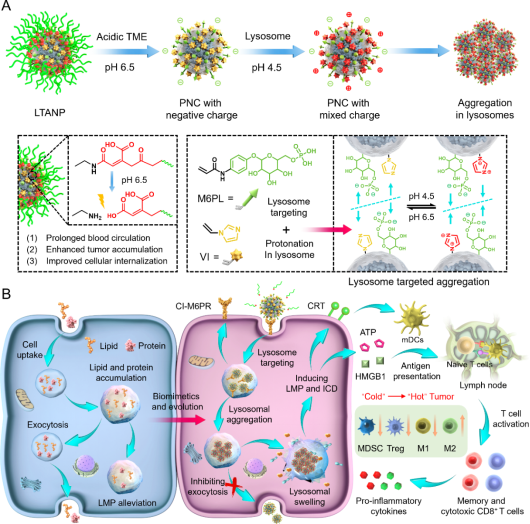
图1. 溶酶体靶向聚集性纳米颗粒诱导肿瘤细胞LMP和ICD用于癌症免疫治疗
该研究工作近日以“Lysosome Targeted Nanoparticle Aggregation Reverses Immunosuppressive Tumor Microenvironment for Cancer Immunotherapy”为题在线发表在《Advanced Materials》上(DOI: 10.1002/adma.202412730)。安徽医科大学刘琦/潘佩副教授、南开大学刘阳教授为本文通讯作者,安徽医科大学研究生杨剑辉为本文共同第一作者,安徽医科大学为第一通讯单位,该研究得到了国家自然科学基金,安徽省高校自然科学重点项目,安徽省自然科学基金,国家重点研发计划等项目的支持。
原文链接:
https://doi.org/10.1002/adma.202412730.


