【Blood Adv】综述:细胞疗法相关心血管毒性的发病率、机制和管理
时间:2024-11-12 11:01:16 热度:37.1℃ 作者:网络
细胞疗法的心血管毒性
在过去的十年中,CAR-T和双特异性T细胞衔接器(BTE)等T细胞重定向治疗重塑了越来越多的血液系统恶性肿瘤的治疗,而肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TIL)则用于治疗实体瘤。新出现的数据表明,这些疗法可能与严重心脏毒性的高发相关,包括房颤、心衰、室性心律失常和其他心血管毒性,它们是细胞免疫疗法治疗后长期生存的主要限制因素。
《Blood Advances》近日发表综述,基于现有证据报道了新型细胞免疫疗法后心血管毒性的发病率、危险因素、机制和管理策略,特别关注CAR-T、BTE及其与心律失常、心衰、心肌炎、出血和其他主要心血管事件的关系,旨在为这些新兴疗法的心血管安全性提供临床相关指导。现整理主要内容供参考。

细胞疗法相关心脏毒性的可能机制
细胞治疗相关心血管毒性的因素:患者很多都高龄,存在心血管合并症,包括高血压、冠状动脉疾病、糖尿病等,增加对心脏毒性的易感性;新兴免疫疗法通常用于复发/难治性患者,患者可能已经接受了蒽环类药物或其他心脏毒性化疗,这些化疗会增加心脏风险;CAR-T疗法之前需要的清淋方案通常包含具有心脏毒性的药物。
虽然 T 细胞疗法导致心脏毒性的确切机制仍未明确,但围绕着三个主要通路的理论已经逐渐形成(图 1)。第一种理论认为,心脏毒性是通过对肿瘤微环境的靶向炎症效应间接产生的,这些效应会触发全身性促炎性细胞因子的释放,导致细胞因子释放综合征(CRS)以及随后的心脏功能障碍。第二种理论表明,T 细胞直接与肿瘤和心脏组织共有的抗原相互作用,引发有针对性的毒性。最后一种理论认为,T 细胞也可能通过与心肌抗原的脱靶(off-target)相互作用攻击心脏,这些抗原与肿瘤组织无关。但应注意,目前的大多数机制数据专门针对 CAR-T 疗法,而关于 BTE 相关的心脏毒性机制的了解相对较少。
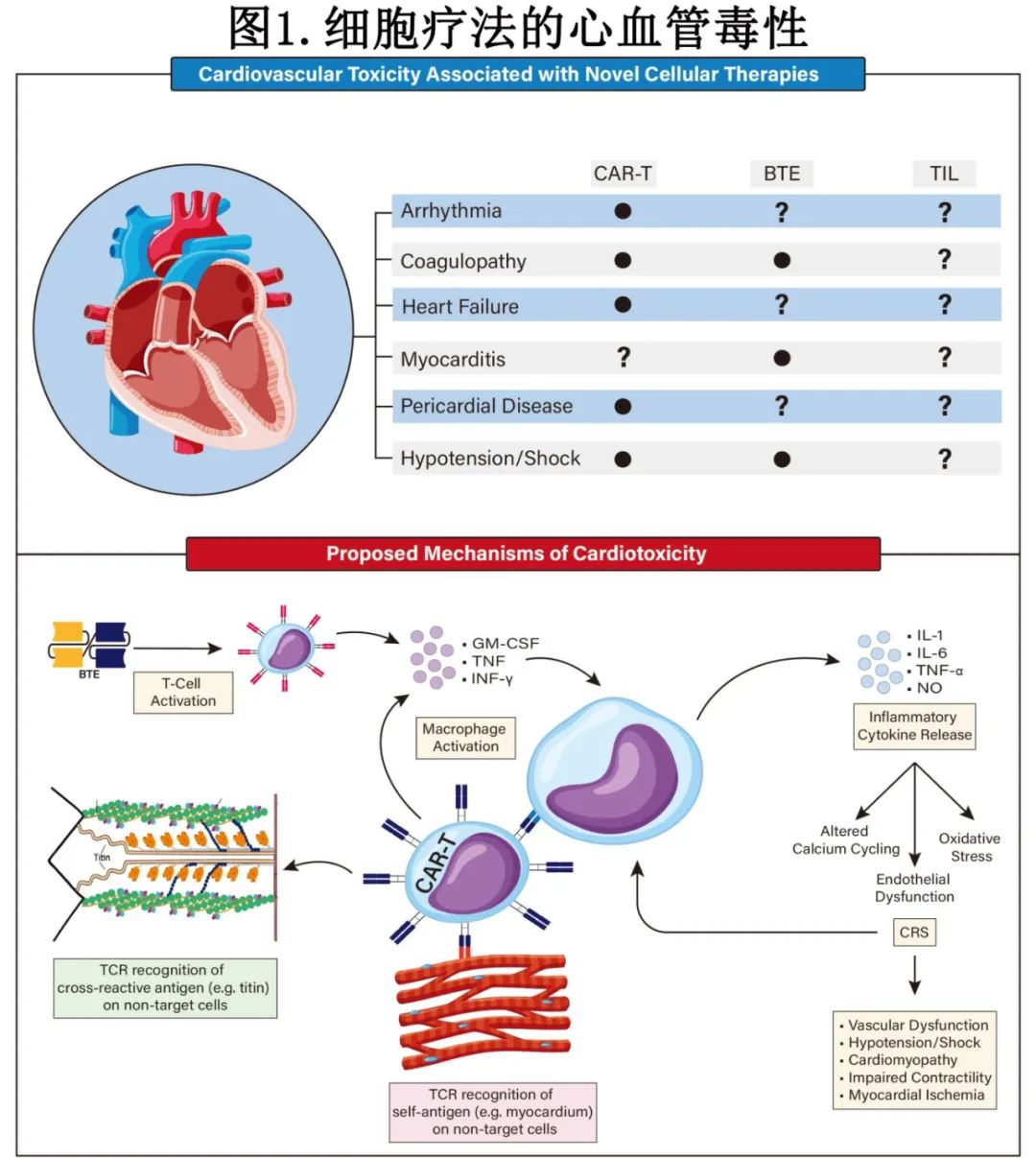
CRS在心脏毒性易感中的作用
CRS是与细胞疗法相关的心血管毒性的关键驱动因素,是 CAR-T 和 BTE 疗法常见的副作用。急性白血病试验中CRS 的发生率在 77%至 92%之间,在B 细胞淋巴瘤试验中为 39%至 94%,在多发性骨髓瘤试验中高达 85%(表 1)。即使是非 CD28结构,CRS 的发生率也高达 76%,表明心律失常等隐匿性相关事件可能仍未得到充分定义。
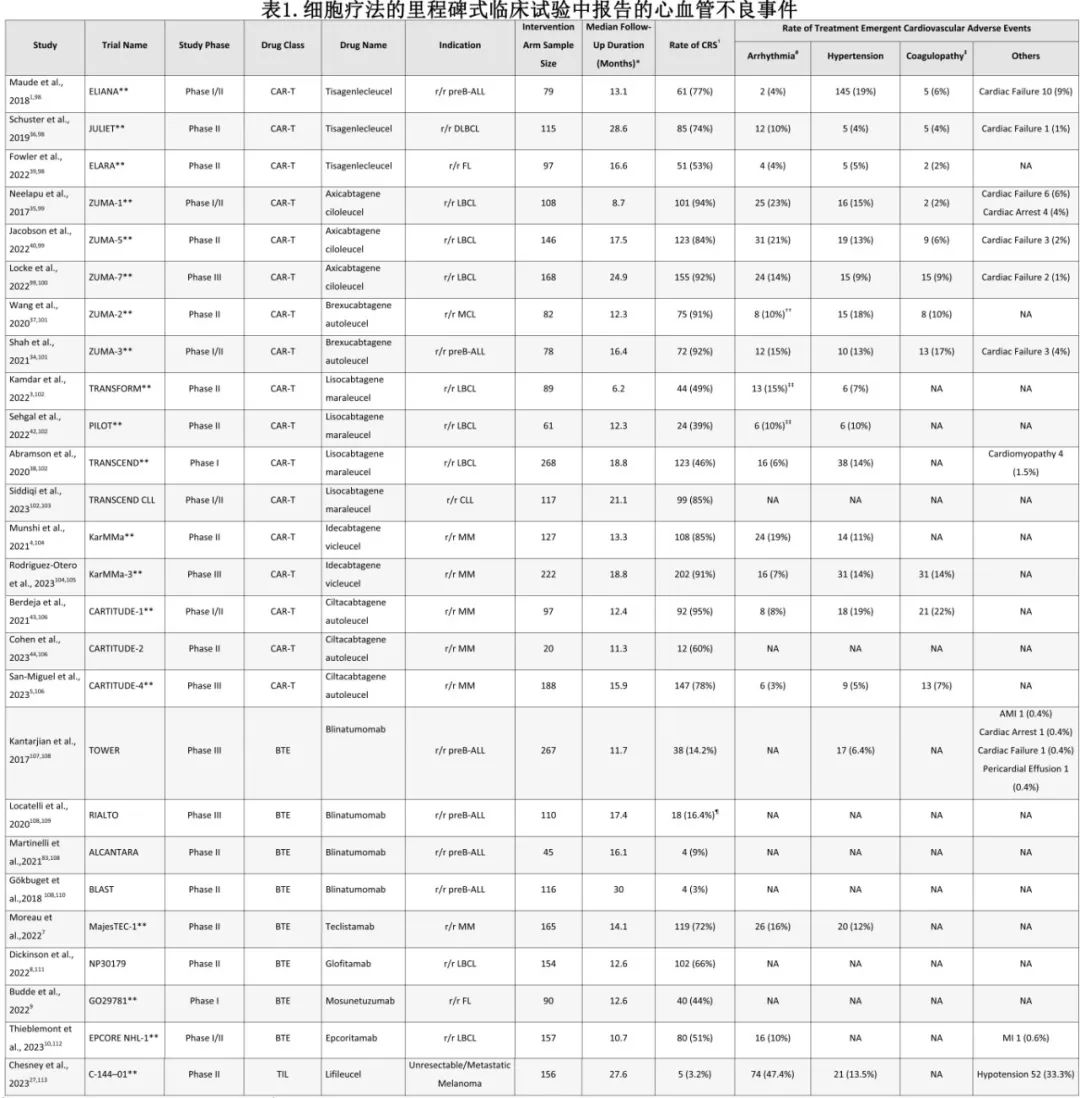
另一方面,BTE 患者中发生 CRS 的比例较低;B 细胞急性淋巴细胞白血病(B-ALL)中高达 14%,多发性骨髓瘤中约为 70%,B 细胞淋巴瘤中在 44%至 70%之间。 此外,BTE治疗中出现的CRS症状较轻。
心血管不良事件(CVAE)在所有级别的 CRS 中均有报道,也可能在没有 CRS 的情况下发生(例如心力衰竭、心律失常)。尽管不同试验中 CRS 的分级可能有所不同,但最广泛使用的两个标准是ASTCT和CTCAE标准,虽然它们在每个 CRS 等级的主要标准上可能一致,但 ASTCT 系统在低血压和低氧的管理方面具有更详细的定义。
CRS的机制涉及促炎性细胞因子的释放,包括白细胞介素-6(IL-6)、IL-1、肿瘤坏死因子-α(TNF-α)和一氧化氮(NO)。虽然最初认为细胞因子的释放是由激活的T细胞引起的,但小鼠的CAR-T模型显示,CRS的严重程度是由巨噬细胞和单核细胞激活产生的细胞因子介导的,从而形成炎症的恶性循环。这些细胞因子的下游信号使免疫细胞从循环中移出,导致血管渗漏和低血压。同时,TNF-α信号可诱导内皮细胞表达组织因子,导致严重CRS中的血栓形成事件。此外,高水平的血管性血友病因子和血管生成素2与接受CAR-T治疗的患者中CRS的严重状态有关,这些分子可能导致内皮细胞激活和凝血级联反应的激活,导致凝血障碍。
IL-6和IL-1是CRS的主要介质,且CRS的严重程度与IL-6水平之间存在关联,导致2017年FDA批准IL-6抑制剂托珠单抗用于治疗重度CRS;IL-1抑制剂anakinra在治疗CRS方面也有效,在预防CRS方面也证实有效。
从心血管的角度来看, CRS的下游效应或许可以解释许多临床上观察到的 CVAE,包括低血压、心律失常、左心室功能障碍、失代偿性心力衰竭和休克。在 CAR-T 的试验中,CRS 的中位发作时间先于心血管事件,心脏毒性通常发生在 CRS 期间。该关联也得到真实世界研究的进一步支持,一项药物警戒性研究报告称,患有 CRS 的患者发生 CVAE 的风险几乎增加一倍。此外,更严重的心脏事件,如补液难治性低血压,以及心肌缺血(表现为肌钙蛋白升高和应激性心肌病)、心包炎和心包积液与高级别CRS相关。
有学者假设,CRS 介导的心脏毒性的机制与全身炎症反应综合征的机制相似。具体而言,上述促炎性细胞因子的释放会导致由于氧化应激引起的血管和细胞破坏,以及钙信号的改变,最终导致内皮完整性受损,它们都可导致急性血流动力学变化,从而可能引发上述心血管不良事件。但还需要开展更多研究来充分解释 CRS 与心脏毒性之间确切的关联机制。
心脏毒性的非CRS机制
关于 CAR-T 介导的心肌毒性的其他假设包括由于抗原模拟或异种反应性而识别心脏抗原所导致的直接心肌损伤。已有报道两例患者出现致命的心肌炎,一例为黑色素瘤,另一例为患有多发性骨髓瘤,他们均接受针对 MAGE-A3 肿瘤抗原的 CAR-T 细胞治疗,这是由于与心肌细胞中的肌联蛋白(一种肌节蛋白)发生交叉反应所致。与移植物抗宿主病类似,异种反应性也与心肌毒性有关,在这种情况下,所施用的 T 细胞对宿主心脏组织中未识别的 MHC 变异体作出反应,从而导致心脏损伤。
临床实践中的心血管毒性
报告细胞疗法心血管毒性的随机对照试验的证据有限,且这些试验经常排除已有心血管疾病的患者(这一群体发生心脏毒性的风险更高),此外大多数试验在设计上不足以检测到 CVAE 等不太常见的不良事件,因为这些试验的主要重点是检测肿瘤相关结局。但观察性研究已经强调了接受 CAR-T 和 BTE 治疗的患者中 CVAE 的普遍性。
与 CRS 相关最常见的心血管副作用为低血压,且心律失常在 CAR-T 和 BTE 治疗中均有发生。关于这两种治疗方法的试验均有报告,多达 19%的患者发生高血压(表 1);但许多试验都是单臂的,从而导致难以确定其是否与治疗直接相关。
CAR-T疗法
在CAR-T的主要临床试验中,难治性休克、心律失常、心肌病和心衰均有相关报告(表 1) 。在实践中心律失常是 CAR-T 治疗后最常报告的心血管毒性,但研究中报告的发生率不一致(见表 2)。一项针对2657例接受CAR-T治疗的患者的药物警戒研究发现,最常报告的心律失常包括窦性心动过速、房颤、室性心律失常和 QTc 延长,可能与 CRS 的炎症状态和血流动力学变化相对应。
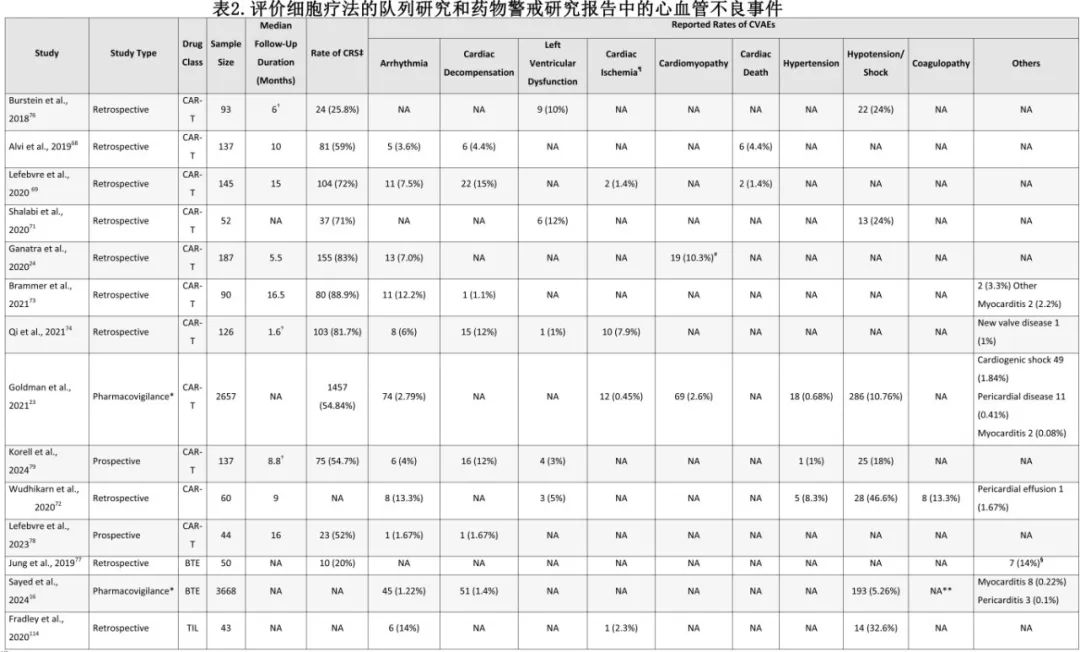
其他与 CAR-T 疗法相关的心血管副作用包括心肌病、心衰、心包疾病和凝血障碍。在一项回顾性研究中,116 例患者中有 10.3%在治疗后的几个月内出现心肌病新发或恶化。在上述药物警戒性研究中,与非 CAR-T 疗法相比,接受 CAR-T 治疗的患者报告心肌病的风险高出 3.5 倍,报告心包疾病的风险高出两倍。此外,主要临床试验中也报告了凝血障碍,即实验室凝血参数升高和/或弥散性血管内凝血(DIC),特别是在使用Brexucabtagene autoleucel的试验中(见表 1);但尚不清楚是否与治疗直接相关,因为这些试验为单臂,并且缺乏对照组。此回顾性研究进一步支持该结果。在一项针对 B 细胞淋巴瘤患者的研究中凝血障碍发生率为 13.3%,只有一例患者出现 DIC。另一项研究发现,凝血障碍的发生与 CRS 之间存在关联,报告称凝血障碍发生率为 51%,有 7 例患者出现弥散性血管内凝血(DIC)。
在主要的临床试验和真实世界研究中,也观察到低血压、休克和充血性心力衰竭(见表1、表2)。低血压和休克通常归因于重度 CRS,而在这些试验中,充血性心力衰竭最多仅报告1例(见表1)。上市后研究进一步深入了解了 CAR-T 治疗中心衰的发生率,报告的发生率范围为 1%至 15%(见表2);然而由于这些研究的回顾性及患者异质性,导致 CVAE 的确切发生率仍不确定。尽管到非 CD28 产品可能毒性更低(例如门诊使用),但仍报告了CRS 和心脏事件,而诸如心律失常和心衰等更隐匿或更晚期的 CVAE 事件的长期风险仍未明确。
此外,关于 CAR-T 治疗后主要心血管不良事件(major adverse cardiac event,MACE)发生率的结果不一致。MACE 是一种综合结果,通常定义为以下一种或多种情况:心血管死亡、射血分数降低性心衰、急性冠状动脉综合征、缺血性中风,或新发(突发)的有症状的心律失常。尽管不同研究中 MACE 的确切组成部分可能有所不同,但至少包括这些心血管事件之一或其变体。
最近一项前瞻性研究报告称,137 例接受 CAR-T 细胞治疗的患者未发生主要不良心血管事件(MACE)。而一项回顾性研究发现,在输注后的一年内,MACE 的累积发病率为 21%;而最近一项针对 44 名相对更健康的患者的前瞻性研究中MACE 发生率低于 5%。尽管研究人群和设计不同,但各报告的差异强调了更好地描述 CAR-T 疗法的心脏毒性特征以及统一和规范报告结果的必要性。
上述药物警戒研究发现,axicabtagene ciloleucel 和 tisagenlecleucel 之间的心脏毒性特征有所不同;tisagenlecleucel 的心脏安全性特征稍好,CRS、心律失常和其他重度CVAE 的发生率较低; Guha 等开展的另一项药物警戒性研究中也报道了该差异。然而鉴于回顾性研究的固有局限性,该结果仅仅是一个信号,表明有必要进一步调查该差异的潜在原因。特别是,这种差异引发了疑问,即 CAR-T 共刺激结构域、患者特征或给药策略的差异是否可能导致 CVAE 的发生;所有这些都需要以前瞻性的方式解决。
BTE疗法
用于治疗 B 细胞急性淋巴细胞白血病、非霍奇金淋巴瘤及复发/难治性多发性骨髓瘤的BTE 疗法的临床试验主要是小规模的二期研究,招募的患者一般少于 100例,因此检测心脏毒性的效力可能不足。
在主要的 BTE 试验中,心律失常是最常报告的 CVAE。对于相对较新的 BTE 疗法,如 talquetama、elranatamab、mosunetuzumab、epcoritamab 和格菲妥单抗的试验,并未报告具体CVAE。
尽管临床试验存在局限性,但真实世界的数据提供了一些有关 BTE 疗法相关心脏毒性的数据,尽管其仍存在一定程度的不一致性。在一项大规模的药物警戒研究中,20%的患者报告了CVAE。值得注意的是,特立妥单抗(而非其他BTE)的致命性心血管事件和心肌炎的发生率过高而贝林妥欧单抗的BTE 相关DIC的发生率较高。 该研究发现 CVAE 与 CRS 之间没有关联;鉴于 BTE 治疗中的 CRS 发生率和严重程度较低,可能存在其他机制导致心脏毒性。该研究的局限性治愈在于,当时仅报告了关于贝林妥欧单抗和特立妥单抗的数据,因为当时获批的 BTE 疗法的数据较少。
细胞治疗相关心脏毒性的风险因素
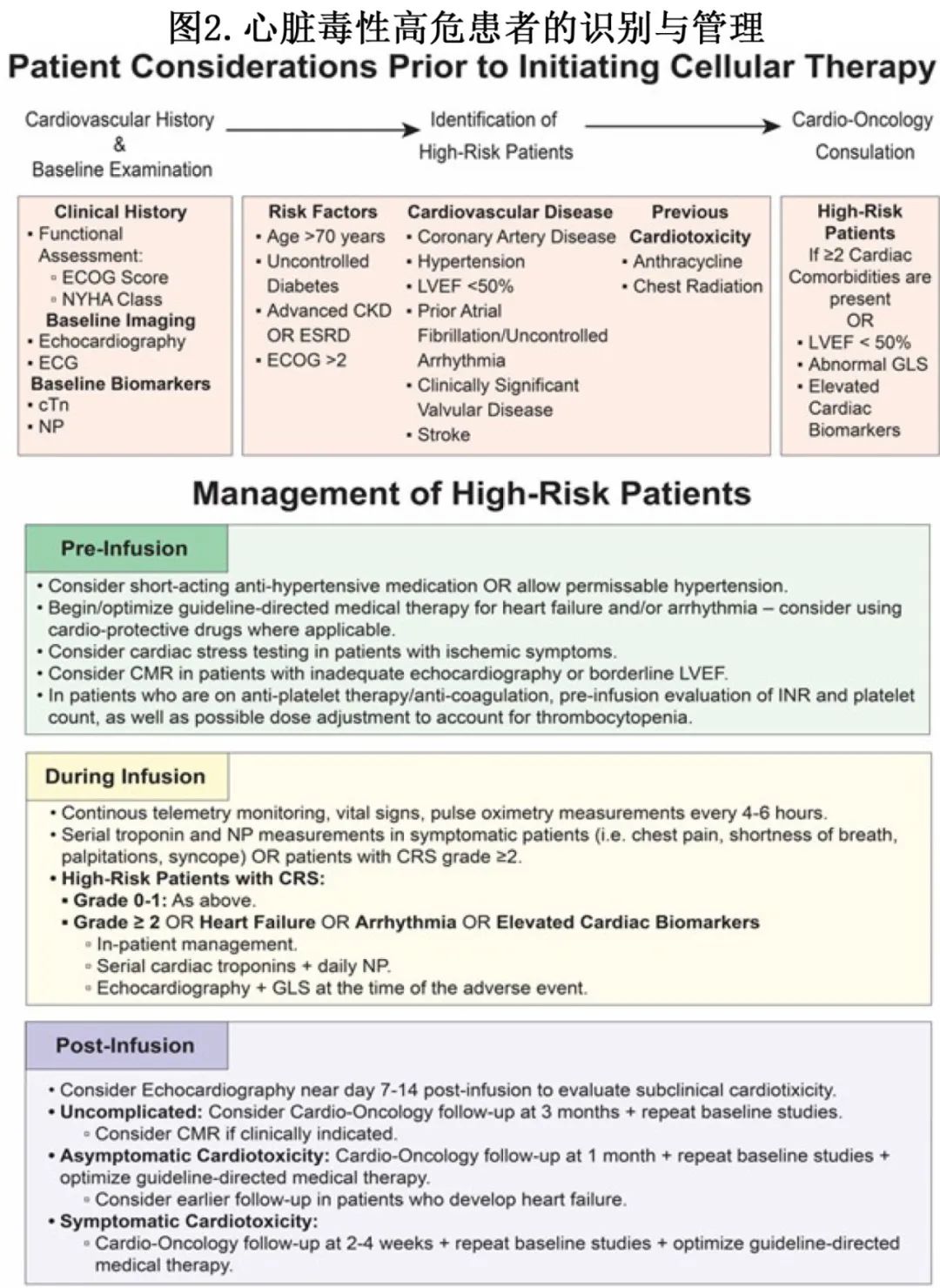
多个关键因素可能会增加心脏毒性的风险,包括高龄、存在基线合并症(如未控制的糖尿病、肾功能障碍、冠状动脉疾病和心衰)、既往接受过心脏毒性化疗方案(如蒽环类药物或纵隔放疗)。因此,对心血管健康进行全面的治疗前评估和风险分层,对于识别需要更密切监测的患者至关重要(图2)。
细胞治疗相关心脏毒性的预后影响
由于缺乏长期随访数据(随访9-16.5 个月),T 细胞治疗相关持续性心脏毒性相关发病率和死亡率的长期风险仍不清楚。在随访时间相对较长(5-16.5 个月)的研究中,报告称大多数CVAE发生在 CAR-T 治疗开始后的 3 个月内,心脏事件的中位持续时间约 1-2 周,然而这些事件的长期影响仍不清楚。在一项纳入202 例CAR-T 患者的回顾性研究中,16%的患者经历了重度心血管事件,包括心肌梗死、心血管性休克或心衰。这些发生重度CVAE 的患者死亡风险几乎是无重度CVAE 的患者的 3 倍。同样,一项关于 BTE 疗法的药物警戒研究表明,与 BTE 疗法相关的 CVAE(若发生) 比其他BTE相关不良事件更致命。令人欣慰的是,有证据表明心脏毒性往往可逆,不会产生持久影响,但相关证据尚无定论。由于缺乏长期研究,在继续开发和扩大细胞疗法的使用时也需要进一步探索CVAE。
细胞治疗相关心脏毒性的诊断
治疗前评估
建议在开始 T 细胞治疗前对所有患者进行全面的心脏基线筛查(图2),包括心脏生物标志物,如心肌肌钙蛋白(cTn)和利钠肽(NP;包括 BNP 和 NT-proBNP),作为早期检测梗死或心衰的基线。还建议进行 12 导联心电图,以评估新发缺血和心律失常。此外可进行带有整体纵向应变的经胸超声心动图,以评估基线心室功能和进行风险分层;对于潜在的高危患者,例如左心室射血分数(LVEF)临界降低(例如 45-50%)、心脏内恶性疾病受累,甚至经胸超声心动图图像质量不充分的患者(图2),可能需要更先进的影像学,如心脏磁共振成像(MRI)来明确和/或排除潜在的心脏功能障碍;而对于可能有冠状动脉缺血的患者,心脏应激测试可能最合适。综合起来,这些检查可能会为治疗期间耐受血流动力学变化的能力提供额外的关键数据。
治疗后评估
输注后的持续监测可能包括连续心电图、重复超声心动图以检查任何新出现的症状,以及频繁评估cTn和NP以了解心肌损伤/应激(图2)。根据其可用性,跟踪炎症标志物如IL-6和IL-1也可为心脏毒性提供早期预警信号。如果超声心动图不充分或不明确,可以考虑进行心脏MRI。尽管关于预测性炎症/生物标志物cutoff值的证据仍有限,但其升高与心血管事件的增加相关,例如心血管事件与IL-6、铁蛋白和肌钙蛋白升高之间具有关联。在一项关于接受CAR-T治疗的患者的前瞻性研究中,报告了高敏肌钙蛋白(hsTn)与全因死亡率之间的关联,表明hsTn升高的患者可能受益于更密集的输注后监测和早期干预。然而还需要更多研究来确定明确预测心脏毒性的生物标志物阈值。
细胞治疗相关心脏毒性的预防与管理
CRS的管理
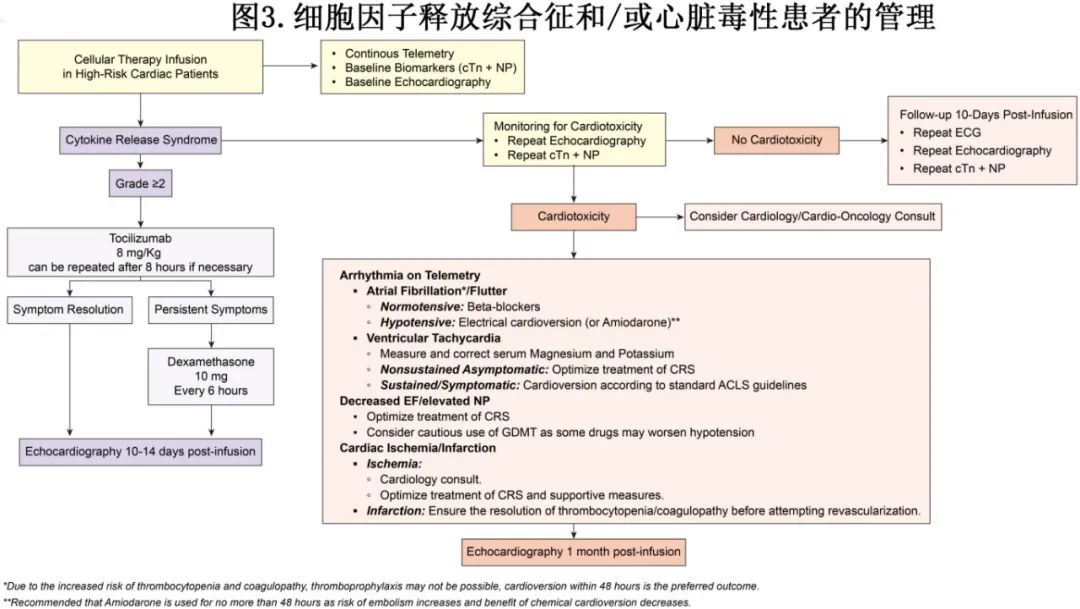
由于 CRS 与心脏毒性症状密切相关,大多数建议旨在预防或早期管理 CRS(图3)。对于低级别CRS,支持治疗和退热药就已足够,而重度CRS 则需要使用托珠单抗、皮质类固醇及血流动力学支持。近来,一种更有效的IL-6抑制剂司妥昔单抗显示出对 CRS 的良好疗效,但还需要进一步研究。
对于出现早期CRS迹象的患者,早期使用预防性药物进行干预可作为一种减轻重度CRS的潜在策略。在 ZUMA-1 研究中,早期使用托珠单抗和皮质类固醇进行干预可使重度 CRS 的发生率绝对值降低 11%(早期干预组CRS 发生率为 2%,而未早期干预组为 13%)。多项研究也显示早期预防性干预均可降低 CRS 发生率。然而,尽管这些结果很有希望,但各中心管理方式的异质性以及缺乏有力的证据,限制了关于这些药物的使用或使用时机的标准预防性建议。
此外,ZUMA-1 研究的后续分析评估了在输注后第 2 天预防性使用托珠单抗以预防重度(≥3 级)CRS。初步结果显示,未接受预防的队列中重度 CRS 的发生率为 13%,而接受预防性托珠单抗的队列中为 3%。同一研究还评估了预防性使用皮质类固醇(地塞米松)的使用情况,结果显示地塞米松组重度CRS 的发生率为 0%,而未接受预防的组为 13%。但应注意,接受皮质类固醇治疗的队列肿瘤负荷较低,可能导致 CRS 总体发生率较低。因此,鉴于目前缺乏可靠的数据,CRS 的预防性管理目前并非标准治疗,需要在随机对照研究中进行进一步研究。
心脏毒性的管理
除了早期或预防性使用托珠单抗等靶向治疗外,CRAE的预防和管理还依赖于回顾性数据和传统的心脏肿瘤学策略。高危患者需要通过遥测、心电图、超声心动图、cTn和NP检测来监测心脏毒性,以早期发现心律失常和循环衰竭,这也得到了欧洲心脏病学会心脏肿瘤学意见指南的支持。心血管并发症应按标准方案处理。此外,有学者建议高危患者通过不服用降压药来解决血液循环波动问题,但目前支持该建议的证据有限。
未来方向
细胞疗法在血液肿瘤和实体瘤中的应用越来越广,虽然初步研究和药物警戒数据显示了一些令人担忧的安全信号,但我们目前对T 细胞的疗法的心血管风险和机制的理解仍较为有限。此外,关于新兴的 T 细胞疗法(如 BTE)对心血管影响的研究很少,现有证据存在许多知识空白(表 3)。随着 BTEs在非癌症适应症中的持续研究,对于这些更广泛的患者群体,潜在的心脏毒性的认识和监测至关重要。
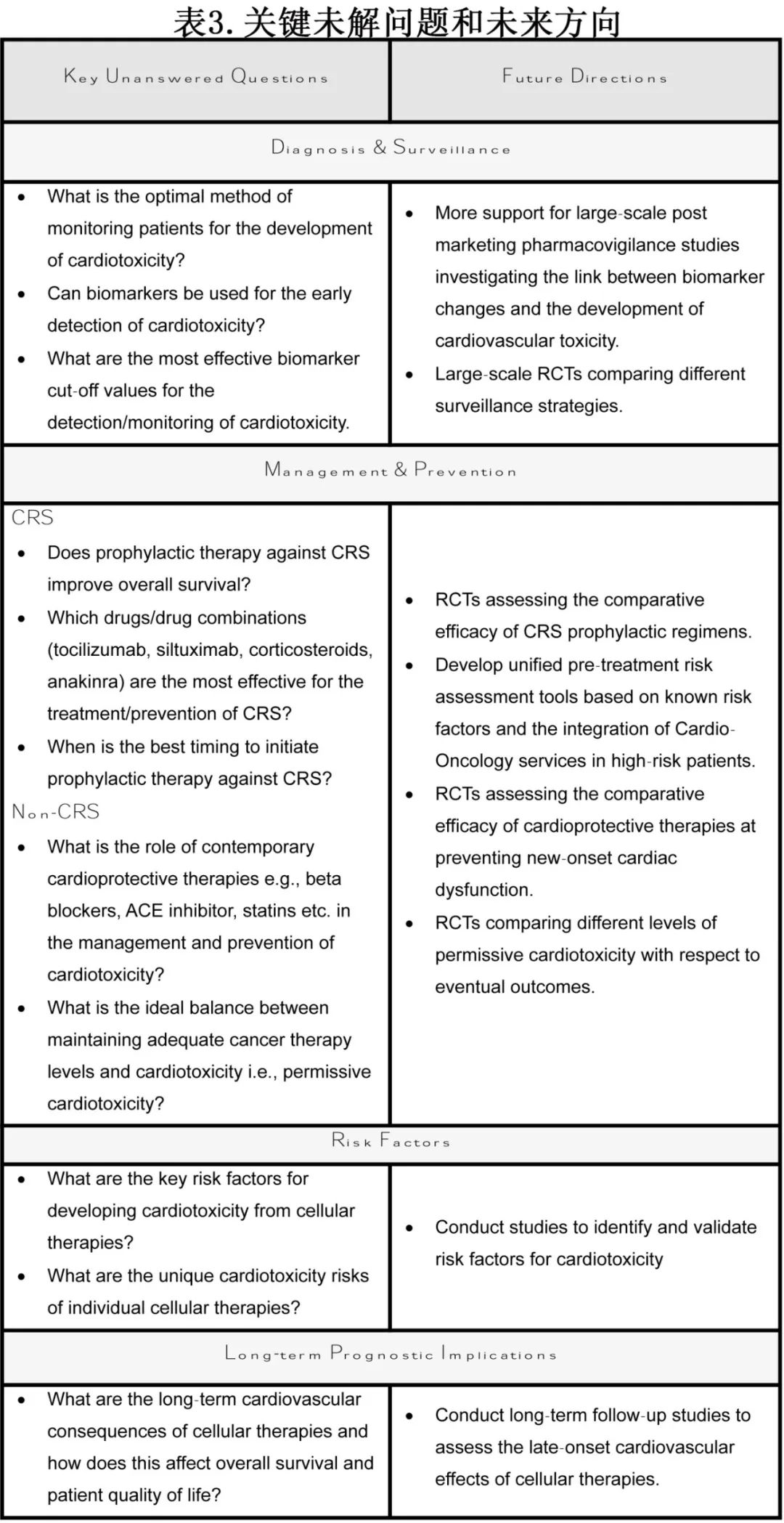
CAR-T 疗法的文献证据较为详实,但关于心血管事件的潜在通路、发生率和风险因素的研究仍显不足。目前关于新型自体 CAR-T在血液肿瘤和实体瘤中的应用,以及异基因和装甲 CAR-T 细胞的研究很有前景,但也需要担心潜在的毒性。虽然使用装甲 CAR-T 细胞提高肿瘤特异性的前景为可能减少心血管不良事件带来了希望,但异基因 CAR-T 方案中使用供者来源的细胞还是令人担忧,其更广泛的可及性加上可能出现的不可预测的off-target风险,意味着异基因 CAR-T 疗法的广泛使用可能会放大现在看到的心血管不良事件信号。因此, 在大规模采用这些新兴细胞疗法之前,迫切需要更好地描述其心脏毒性的特征。
随着近期肿瘤浸润淋巴细胞疗法的获批,过继细胞疗法已扩展到实体瘤,但也带来了心血管毒性的潜在风险。然而相关风险尚不清楚,因为部分在设计中未纳入检测 CVAE 的具体措施。此外,最近报道的研究中,使用肿瘤浸润淋巴细胞治疗黑色素瘤时偶然记录到严重低血压风险,可能导致心肌缺血。一项回顾性研究也证实 TIL 治疗中的CVAE风险。
预测、识别和预防心血管毒性应继续成为 T 细胞疗法研究中的重点之一。与此重点一致,未来的研究还应探索开发有针对性的阻断技术,例如分子安全开关和基因改造,旨在防止这些不良事件的发生。然而需要注意的是,这些进展取决于为每种细胞疗法建立全面的心脏毒性特征。
心脏病专家和肿瘤学家之间的多学科合作,以及加强药物警戒报告,对于充分评估心血管结局也至关重要。此外,试验中的标准化安全终点以及登记处的数据有助于勾勒出长期的心脏毒性特征;因此研究人员、监管机构和医生之间的合作对于最大限度地发挥这些新型细胞疗法的潜力同时确保患者安全至关重要。
总结
细胞疗法彻底改变了血液肿瘤和许多实体瘤的治疗,但心脏毒性仍然是这些疗法有效应用的潜在限制因素。了解这些快速发展的疗法的影响将有助于有针对性地预防和控制这些不良事件。需要多学科策略,包括心血管肿瘤学评估以及与患者、心脏病专家和肿瘤学家共同决策,以促进这些疗法的更多应用。尽管当前的证据还存在差距,但现有数据可为未来研究提供基础,以确定接受细胞治疗的患者中心脏毒性的真实发生率、影响和负担,从而为进一步研究提供令人信服的动力,并确定这些疗法的心脏毒性的机制和最佳预防策略。
参考文献
Munir M, et al.Cardiovascular Toxicities Associated with Novel Cellular Immune Therapies.Blood Adv . 2024 Oct 17:bloodadvances.2024013849. doi: 10.1182/bloodadvances.2024013849.


