Cell stem cell:这种miRNA能够逆转阿尔兹海默症的记忆丧失
时间:2021-06-06 19:05:25 热度:37.1℃ 作者:网络
阿尔茨海默症(Alzheimer's disease, AD),俗称“老年痴呆症”,是一种严重的神经退行性疾病,患者通常会出现以记忆力衰退、学习能力减弱为主的症状,并伴有情绪调节障碍以及运动能力丧失,极大地影响个人、家庭乃至社会的发展。
目前,全球约有5000万人罹患阿尔兹海默症。随着人类平均寿命增长,老年化社会加剧,阿尔兹海默症的患病率也在不断上升,预计到2050年,阿尔兹海默症患者将增加至1.5亿以上。
位于海马的神经干细胞终身维持成年大脑的神经发生,成年海马神经发生(AHN)在功能上与记忆和认知有关。在阿尔茨海默症(AD)中,海马产生新神经元的过程受到阻碍。
当考虑将成年海马神经发生(AHN)作为阿尔兹海默症的治疗靶点时,对成年海马神经发生(AHN)所涉及的分子机制的更深入了解变得尤为重要。miR-132在成年神经发生中可能发挥作用,但是关于miR-132在成年啮齿动物和人类海马中的作用知之甚少,miR-132在阿尔兹海默症背景下的成年海马神经发生(AHN)中的作用仍然难以捉摸。
近日,比利时鲁汶大学、荷兰神经科学研究所等机构的研究团队在 Cell 子刊 Cell Stem Cell 期刊上发表了题为:Restoring miR-132 expression rescues adult hippocampal neurogenesis and memory deficits in Alzheimer’s disease 的研究论文。
该研究证实了成年海马神经发生(AHN)直接受阿尔茨海默症(AD)的病理影响,并揭示了提高miR-132水平,在神经退行性疾病中的潜在治疗潜力。

研究团队首先使用两种AD模型检测对照组与疾病组齿状回(系海马结构的一部分)中miR-132水平,发现与野生型相比,AD齿状回中miR-132的早期下调趋势。
BrdU注射实验显示AD组在跑步时诱导神经元祖细胞增殖的潜力受损。强调了AD对两种不同小鼠模型miR-132表达和AHN损伤的影响。
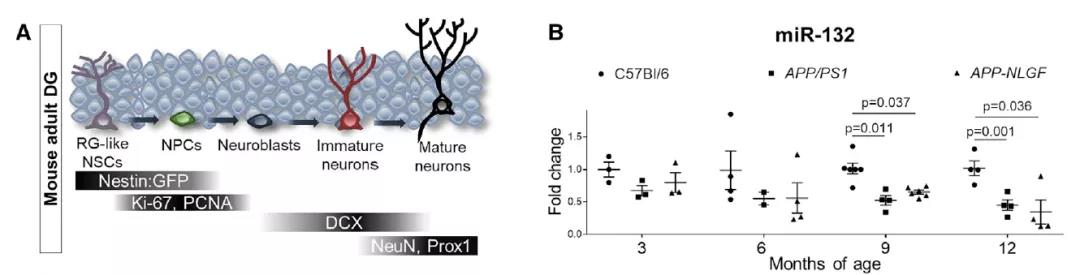
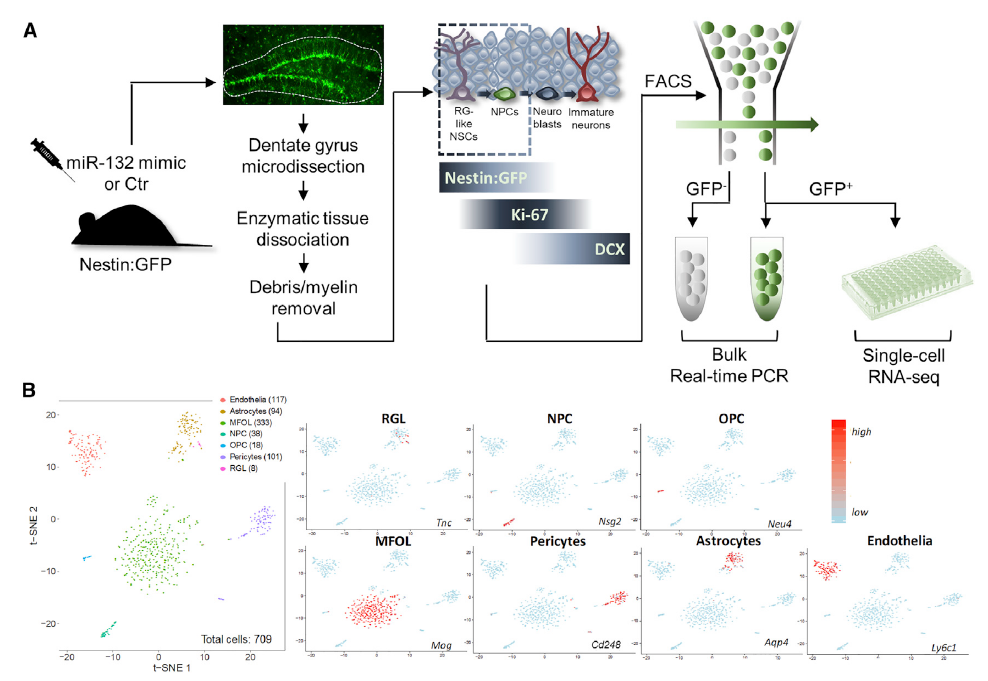
接下来研究团队评估了miR-132在成年齿状回中的定位和表达。他们采用了基于Nestin启动子的绿色荧光蛋白示踪技术,在齿状回标记神经干细胞和神经元前体。
结果显示miR-132是由成年神经干细胞和祖细胞募集的,作为对运动或衰老相关刺激反应的一部分,但在AD中则丧失了对以上刺激的反应。
接下来研究团队评估了miR-132调节是否也参与了人类神经元前体向神经元的分化。
在将原代人胚胎干细胞神经诱导为神经元前体后,miR-132水平显着增加,并且在神经元成熟过程中进一步提高,支持miR-132参与人类神经发生的过程。
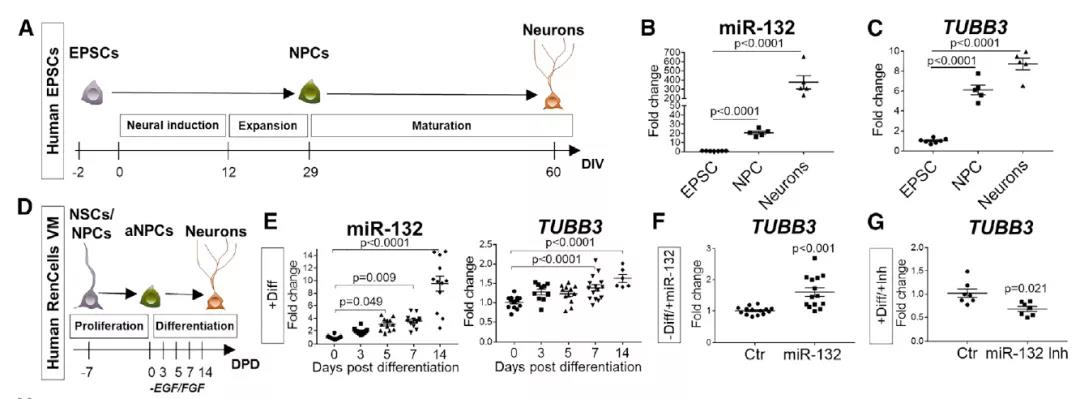
进一步的研究提示 miR-132调控人类神经的发生,AD相关血清衍生因子抑制了人类干细胞中miR-132的表达。
为了明确AHN的miR-132调节机制,研究团队运用单细胞RNA测序评估了miR-132特异性的巢蛋白转录反应,结果显示有五种mRNA显着变化,表明这些转录物可能是 miR-132调节的分子网络的直接效应子的一部分。
最后,功能挽救实验显示,提高miR-132水平诱导了齿状回神经细胞增殖和分化,显着改善了AD小鼠模型的记忆力。
总之,该研究证实了miR-132在神经系统中充当信号传感器,有助于记忆形成。阿尔兹海默症导致miR-132缺乏并最终损害成年海马神经发生。描绘miR-132神经源性作用背后的分子和细胞机制可能为确定在阿尔兹海默症中治疗性成年海马神经发生的新策略提供动力。
原始出处:
HannahWalgrave, et al. Restoring miR-132 expression rescues adult hippocampal neurogenesis and memory deficits in Alzheimer’s disease. Cell stem cell, 2021.


