J Invest Dermatol :通过激活IL-22受体下游的信号治疗银屑病的研究
时间:2021-10-28 12:03:03 热度:37.1℃ 作者:网络

银屑病是一种常见的慢性皮肤病,通常与关节炎、心血管疾病和代谢综合征有关。虽然已经有几种抗细胞因子抗体和抑制剂可用于治疗银屑病,但改进的替代品也将是受欢迎的。Michiels等人在“皮肤病研究杂志”上发表了一篇新文章。提出了一种治疗咪喹莫特(Imiquimod)诱导的小鼠银屑病样皮炎的新策略,该策略针对皮肤中IL-22受体激活下游的信号转导和转录激活因子(STAT)3的非常规激活,而不影响肠道中依赖IL-22的屏障防御。
细胞因子的器官特异性功能在一些细胞因子普遍表达,而另一些细胞因子在不同器官或细胞中选择性表达。大多数细胞因子的功能和作用在不同器官的不同细胞之间共享。例如,TNF-α,IL-1b和IL-6是促炎细胞因子,其激活许多不同种类的细胞,包括各种器官中的免疫细胞,内皮细胞和上皮细胞。相反,某些细胞因子(包括趋化因子)的表达是组织特异性的。例如,CCL17和CCL27是主要在皮肤中表达的趋化因子,并且它们对于皮肤归巢T细胞的迁移是必需的。现在有多种针对细胞因子的抗体可用于临床,我们应该在使用这些生物制剂时考虑组织特异性作用的可能性。
银屑病是一种常见的炎症性皮肤病,涉及表皮角质形成细胞(KCs),真皮血管内皮细胞,树突状细胞和T辅助(Th)17细胞之间的串扰。银屑病中的关键细胞因子包括TNF-α,IL-23和IL-17。,针对IL-17A的抗体有可能引发或加剧炎症性肠病,即使它们迅速清除银屑病皮损。尽管克罗恩病患者固有层内的IL-17A水平升高,并且有人提出这种细胞因子可能是炎症性肠病患者的治疗靶点,但仍会发生这些不良事件疾病。一个可能的解释是尽管IL-23--IL-17A轴明显参与银屑病,但抗IL-23抗体适度降低Th17介导的自身免疫。
IL-22是由Th17细胞,Th22细胞,gd细胞和III型先天淋巴细胞产生的另一种细胞因子.IL-22通过诱导KCs增殖和增加抗微生物肽的产生参与银屑病的发展。与IL17A类似,IL-22对于包括皮肤,肠,肺和肝在内的各种器官的屏障防御和组织修复是重要的。尽管终止了针对IL-22治疗银屑病的人mAb的临床试验,但IL-22缺陷型和抗EIL-22阻断抗体治疗的小鼠对IMQ诱导的皮炎和其他小鼠具有抗性。因此,抗IL-22抗体对肠道的可能副作用研究是令人感兴趣的。
细胞因子受体下游的信号通路细胞因子激活其受体下游的许多信号通路。用小分子抑制剂阻断JAKs或MAPKs等信号分子的酶活性在某些方面比阻断细胞因子之间的相互作用更容易,而且大多数信号通路都已经有了抑制剂。阻断信号分子是一把双刃剑。虽然疾病中的主导信号通路通常可以被废除,但可能会出现副作用,因为相关的信号通路可能在许多类型的细胞中具有稳态作用。IL-22通过由IL-22Ra和IL-10Rb两条链组成的受体传递信号。IL22与其受体结合后,激活了Jak-STAT通路,并在较小程度上激活了MAPK和蛋白激酶B通路。经典的JAK-STAT途径需要STAT的SH2结构域,并涉及IL-22受体中Y残基的磷酸化。然而,在某些情况下,STAT的激活是以磷酸酪氨酸独立的方式发生的。在IL22Ra的情况下,C-末端结构域与STAT3结构性相关。这一非规范途径导致了STAT3的大量激活。在他们的报告中,通过IL-22RaC末端部分的信号在皮肤和肝脏中的IL-22信号中起主要作用,但在回肠中只起到很小的作用。表达IL-22受体的小鼠缺乏IL-22ra的C末端部分,仅取消了非规范途径,对ImQ诱导的皮炎和由齿柠檬酸杆菌诱导的结肠炎也具有抵抗力。作者总结说,皮肤和回肠对IL-22受体的不同反应是由于器官特异性的非典型途径的参与程度所致。IL-22RaR完全缺乏的小鼠对ImQ诱导的皮炎也有部分保护作用,因此,通过适度激活细胞因子信号可能会使IL-22阻断在皮肤中产生理想的治疗效果,而不会对肠道产生有害的副作用(图1)。
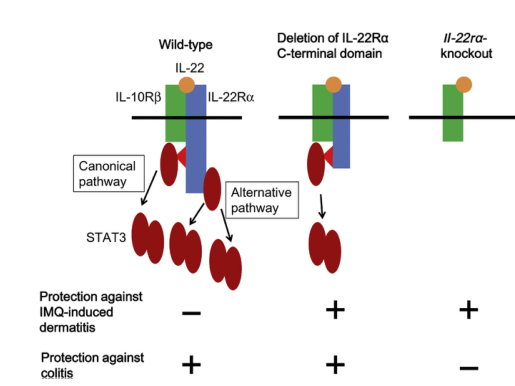
图1.轻触缺少IL-22ra的C-末端结构域的IL-22受体可提供对ImQ诱导的皮炎和结肠炎的保护。IL-22通过激活受体的膜-近端Y残基的磷酸化(典型途径)和IL-22ra的CTerinal结构域(替代途径)激活STAT3。通过这两种途径大量激活STAT3可以保护小鼠免受结肠炎的侵袭,但不能保护小鼠免受ImQ诱导的皮炎的侵袭。IL-22RaR完全缺乏的小鼠对ImQ诱导的皮炎有保护作用,但它们对结肠炎敏感。IL-22ra的CT端部分缺失的小鼠,只取消了非规范途径,对ImQ诱导的皮炎和结肠炎都有抵抗力。Imq,咪喹莫特;STAT3,信号转导和转录激活因子
文献来源:Sugaya M,Treating Psoriasis with a Light Touch.J Invest Dermatol 2021 Nov;141(11)


