JAMA Neurology:争议中上市的阿尔茨海默病新药,超1/3患者治疗后出现脑水肿
时间:2021-11-24 15:02:04 热度:37.1℃ 作者:网络
2021年6月7日,FDA宣布加速审批渤健的单抗药物aducanumab(商品名Aduhelm)上市,用于治疗阿尔茨海默症源性轻度认知障碍(MCI)及轻度阿尔茨海默症。这是自2003年以来,FDA批准的首个阿尔茨海默症治疗新药,也是首个能阻止疾病进展的药物。
aducanumab获得FDA批准后,立即引发了巨大争议,临床试验显示,这款单抗药物能够清除大脑中的β-淀粉样蛋白(Aβ),但没有足够证据表明其能够减缓或阻止阿尔茨海默病的疾病进展,三位FDA评审专家愤而辞职,以示抗议。
该药物价格昂贵,高达5.6万美元/年。由于缺乏有效性证据,且存在副作用风险,该药物虽然获得美国FDA批准上市,但美国各大保险公司纷纷拒绝支付该药物的治疗费用。
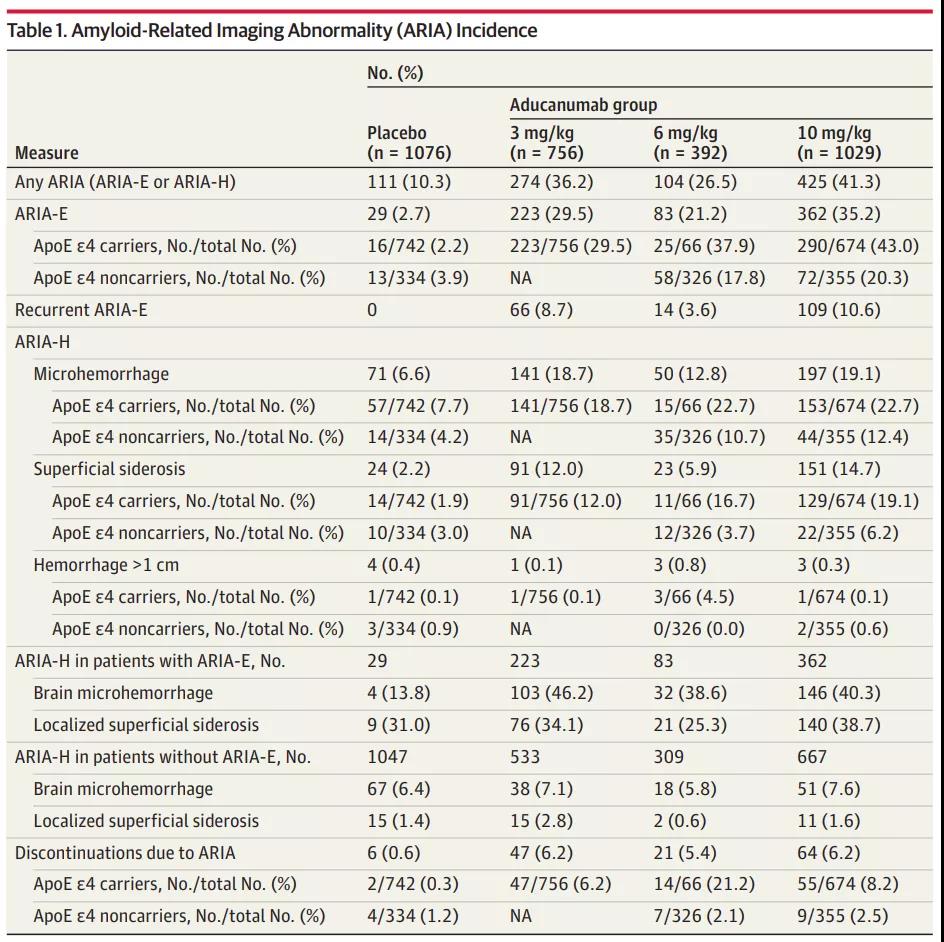
2021年11月22日,JAMA Neurology 期刊发表了题为:Amyloid-Related Imaging Abnormalities in 2 Phase 3 Studies Evaluating Aducanumab in Patients With Early Alzheimer Disease 的论文。

该论文报告了两项aducanumab治疗阿尔茨海默病的大型3期临床试验,并重点关注了治疗期间患者的淀粉样蛋白相关成像异常(ARIA)问题。
试验结果表明,在10mg/kg剂量组的1029名患者中,425名患者(41.3%)经历了 淀粉样蛋白相关成像异常(ARIA)问题,362名患者(35.2%)出现ARIA脑水肿,其中94人出现了相关症状,例如头痛、意识模糊、头晕和恶心。197名患者(19.1%)出现了ARIA微出血,151名患者(14.7%)出现了ARIA表层铁沉积。在这些出现副作用的患者中,有14人情况严重。
这两项大型3期临床试验表明,超过40%的患者在接受aducanumab治疗后出现了淀粉样蛋白相关成像异常(ARIA)问题,其中又有约四分之一出现了相关症状。
起死回生、大起大落
2007年11月,渤健从Neurimmune公司引进了用于治疗早期阿尔兹海默症的单抗候选药物aducanumab,该单抗药物能够有选择性地与阿尔兹海默症患者大脑中的β-淀粉样蛋白(Aβ)沉积结合,然后通过激活免疫系统,清除大脑中的Aβ沉积蛋白。
从2017年10月开始,渤健和卫材在全球范围内合作开展了该单抗药物的开发和商业化。
然而,2019年3月21日,渤健宣布终止aducanumab的两项代号为ENGAGE和EMERGE的全球III期临床试验研究,独立委员会评估其很可能难以达到预期疗效。此消息一出,渤健股价大跌27%,市值缩水150亿美元。
万万没想到的是,2019年10月22日,渤健宣布其医学数据统计师在分析了更大的数据集之后,发现aducanumab相比于安慰剂有明显效果。于是重新向FDA提交《生物制剂许可证申请》(BLA)申请。受此消息影响,渤健股价暴涨40%。
然而,这还没完。
2020年11月6日,FDA外周和中枢神经系统药物咨询委员会针对渤健重新申请中,大多数成员投票反对。
2021年4月,美国FDA外周和中枢神经系统药物咨询委员会的三名成员——Caleb Alexander、Scott Emerson和Aaron Kesselheim在 JAMA 期刊发表文章抨击aducanumab,称渤健这是先射箭,后画靶子。
经历了起死回生的aducanumab至此仍然前途未卜,外界对于FDA是否会批准渤健和卫材研发的阿兹海默症候选药物aducanumab仍充满疑问,这也让其成为2021年最受关注的药物研发故事(之一)。
18年来FDA批准的首个阿尔兹海默症新药
而就在美国当地时间6月7日,FDA宣布加速批准渤健公司开发的aducanumab治疗阿尔茨海默症患者。aducanumab也成为自2003年以来获批用于阿尔茨海默症的首个新型疗法。
原始出处:
Stephen Salloway, et al. Amyloid-Related Imaging Abnormalities in 2 Phase 3 Studies Evaluating Aducanumab in Patients With Early Alzheimer Disease. JAMA Neurol. Published online November 22, 2021. doi:10.1001/jamaneurol.2021.4161.


