JEADV:Ixekizumab可中到重度生殖器银屑病相关的性影响
时间:2021-12-02 10:02:08 热度:37.1℃ 作者:网络

据报道高达63%的银屑病患者患有生殖器银屑病。它往往与与健康相关的生活质量(HRQoL)严重受损有关,包括对性健康的影响比没有生殖器受累的银屑病大得多尽管银屑病很普遍,负担也很重,但基因多态性往往被低估和治疗不足。
Ixekizumab(IXe)是一种选择性针对白细胞介素-17A(IL-17A)的高亲和力单克隆抗体,是美国食品和药物管理局(FDA)批准的唯一一种治疗中到重度斑块型银屑病患者的药物,其中包括成功治疗生殖器损害患者。在IXORA-Q试验中,IXe在治疗12周后显著改善了HRQOL和基因对性影响的影响。我们在此报告了IXORA-Q试验的持续性。
149名患者参加了诱导期(0-12周);患者随机分为安慰剂(PBO)或Ixekizumab(IXEQ2W);大多数人的GPSIS影响得分为≥3(中度至非常高),近三分之一的患者GPSIS回避评分为5分(总是避免由于GenPs引起的性活动)。在第12周,93%的患者(PBO:n=65;IXE Q2W:n=74)进入开放标签治疗期,其中所有患者每4周(Q4W)接受IXE 80mg直至第52周,初始PBO随机化接受160mg IXE起始剂量的患者。如果需要,可以增加剂量以实现或维持令人满意的疾病控制。
接受IXe治疗的患者在第12周时,通过DLQI(0,1)和SF-36的多个领域的测量,以及在基因对性的影响方面,在HRQL方面取得了持续的改善;这些改善一直持续到第52周。在两个时期都接受IXe治疗的组(IXe/IXe)中,GPSIS回避(1,2)反应的患者比例持续到第52周,80%(n=24/30)的患者实现了GPSIS回避(1,2)。
从PBO转换为IXE后,GPSIS回避(1,2)反应从26%(n=9/35)(第12周)迅速增加到72%(n=21/29)(第16周)和79%(n=23/29)(第52周)(图1A)。从PBO转换为IXE后,GPSIS-Impact(1,2)反应从53%(n=9/171)(12周)迅速增加到94%(15/16)(16周),并持续到52周(93%,n=13/14)。在开放标签治疗期间,PBO/IXe组的GPSIS-IMPACT(1,2)反应数值更高。(图1B)。
在IXe/IXe人群中,47%的患者在第12周达到DLQI(0,1),并持续到第52周(图1C)。在52周时,85%的IXe/IXe患者完成了DLQI项目9(0,1)(图1D)。PBO/IXe组有51%的患者在52周达到DLQI(0,1),94%的患者在第52周达到DLQI(0,1)(图1C-d)。
在第12周,IXe治疗导致6个SF-36领域(9)和物理成分摘要(表1)的平均变化明显大于基线。在切换到IXEQ4W后,PBO/IXe组所有SF-36领域和两个组成部分的总结分数从基线的平均变化从第12周增加到第52周。在IXe/IXe组,在第12周观察到的改善一般持续到第52周,但数值较低。
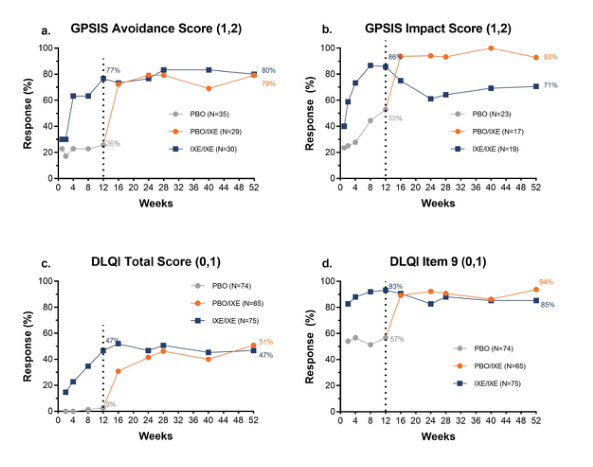
图1.GPSIS-避免(1,2)和GPSIS-Impact(1,2)结果,以及DLQI(0,1)和DLQI项目9(0,1)应答率,到52周的IXORA-Q(无应答者归罪[基于患有Mx+PX1的GPSIS-Impact的患者]),包括盲目T2T和开放标签T2T。(A)报告他们从未(1)或很少(2)因生殖器牛皮癣而避免性行为(GPSIS-回避[1,2])的患者的比例[基于基线GPSIS-回避得分≥为3的患者];(B)报告性行为后生殖器银屑病症状恶化程度很低或根本没有(1)或低(2)的患者的比例(GPSIS-Impact[1,2])[根据基线的GPSIS-回避评分≥3的患者];(C)在DLQI总分中达到(0,1)分的患者的比例,表明对HRQI没有影响;(D)在DLQI项目9上达到(0,1)分的患者的比例,表明‘。虚线分隔双盲治疗周期(0-12周)和开放标签治疗周期(12-52周)。
结果表明,接受IXe治疗的患者在GENS症状、HRQOL和GEN的性影响方面取得了显著的临床改善,持续了长达1年,支持了IXORA-Q研究和IXe作为中到重度GEN的有效治疗选择的先前结果。
文献来源:Ryan C, Guenther L, Foley P, Ixekizumab provides persistent improvements in health-related quality of life and the sexual impact associated with moderate-to-severe genital psoriasis in adult patients during a 52-week, randomized, placebo-controlled, phase 3 clinical trial.J Eur Acad Dermatol Venereol 2021 Nov 23;