让“冷”肿瘤变“热”,中国药科大学开发光热疗法,有效增强PD-L1抑制剂抗肿瘤效果
时间:2019-10-28 12:13:56 热度:37.1℃ 作者:网络
热肿瘤:肿瘤组织附近已经聚集了不少免疫细胞,免疫细胞已经在这里跟癌细胞发生过殊死搏斗,然而,道高一尺魔高一丈,癌细胞占据了上风,但是,胜负仍未尘埃落定,战场依然“
火热”。
冷肿瘤:与热肿瘤相对,肿瘤组织中没有或者只有很少的免疫细胞,这里免疫细胞未曾与癌细胞战斗过,战场甚至没能点燃。
2018年的诺贝尔生理学或医学奖授予了日本科学家本庶佑和美国科学家James P Allison,因开创了免疫检查点癌症疗法而获此殊荣。
基于免疫检查点开发的免疫检查点抑制剂,如PD-1抑制剂、PD-L1抑制剂等,在皮肤黑素瘤,非小细胞肺癌,肾癌,膀胱癌,头颈癌和霍奇金淋巴瘤等癌症中起到了非常不错的效果。
但是,免疫检查点抑制剂对所谓的“热肿瘤”效果更好。因为热肿瘤中已经存在免疫细胞,尤其是T细胞,但是这些T细胞已经被肿瘤细胞结合并束缚,免疫检查点抑制剂能够解除肿瘤对T细胞的刹车效应,这些被解放的T细胞能够迅速动员,快速杀伤肿瘤细胞。
对于“冷肿瘤”来说,免疫细胞很难识别并杀伤,免疫检查点抑制剂也就难以发挥功效,那么,有没有一种方法能够让“冷肿瘤”变身“热肿瘤”呢?
2019年10月25日,最新一期的Nature Communications杂志上线了中国药科大学孙春萌、涂家生,华中科技大学罗亮作为共同通讯作者的研究成果。该研究开发了一种新疗法——共生温和光热辅助免疫疗法(SMPAI),将近红外(NIR)光热剂IR820和PD-L1抑制剂都装入具有良好的热可逆凝胶-溶胶相变特性的脂质凝胶库中。
通过手动控制近红外(NIR)辐射可调节PD-L1抑制剂的释放,更重要的是,可增加肿瘤浸润淋巴细胞的募集并增强T细胞针对肿瘤的活性。对4T1和B16F10模型进行的体内抗肿瘤研究表明,
SMPAI是治疗“冷肿瘤”的有效且有希望的策略。

旨在逆转来自免疫抑制肿瘤微环境(TME)信号的免疫检查点封锁(ICB)正在被作为重要的癌症治疗手段,基于免疫检查点封锁(ICB)的癌症免疫疗法的疗效在很大程度上取决于PD-L1在肿瘤组织中的表达以及肿瘤浸润淋巴细胞(TIL)的募集。但是,最近的研究表明,许多肿瘤似乎并不包含高水平的肿瘤浸润淋巴细胞(TIL)这些肿瘤在免疫学上被认为是“冷肿瘤”,它们对免疫检查点抑制剂无反应。具有局部治疗,无创性以及可控制的辐射和温度优势的光热疗法
(PTT)已成为精准癌症治疗的新范例。
通常,为了实现相对苛刻的环境以有效消融肿瘤,需要将光热严格加热到50°C以上的高温,显然人体组织无法承受如此高温。但是,一旦光热能降低,光热疗法的效果就会大大受损。
这项研究的团队发现,将45°C左右温度相对较低的温和光热疗法作为辅助治疗而不是用于直接杀死肿瘤细胞,可能是一种有前景的方式。
而且,类似于发烧的热量提升,能够诱导有利的肿瘤微环境,受此启发,该研究团队提出了温和光热疗法和免疫检查点抑制剂疗法结合,以解决二者单独治疗时的缺陷。为了验证上述假设,研究团队采用具有光热敏感性和可逆相变能力的可注射脂质凝胶(LG),作为局部共生温和光热敏免疫疗法(SMPAI)的双管齐下的方式。将有效载荷,即光热剂(IR820)和抗PD-L1抗体(aPD-L1)封装到脂质凝胶中形成多合一制剂。
肿瘤内注射该制剂后,该制剂能够响应39°C左右的小温度变化而经历可逆的凝胶-溶胶转变。光热剂(IR820)在手动近红外辐射下可以在注射部位产生温和的热量,并诱导可调节的脂质凝胶相变,从而可控制aPD-L1的释放。
同时,温和光热疗法可以激活全身免疫反应,从而增加T细胞肿瘤浸润,并上调PD-L1在肿瘤细胞表面的表达,有望有效重塑肿瘤微环境并使肿瘤对免疫检查点疗法的敏感性 。
接下来,研究人员应用这种多合一和全控制相结合的策略,在4T1和B16F10这两种缺乏肿瘤浸润淋巴细胞(TIL)的“冷肿瘤”中测试,结果表明,该策略能够提高抗PD-L1的治疗效果,成功移植肿瘤生长。
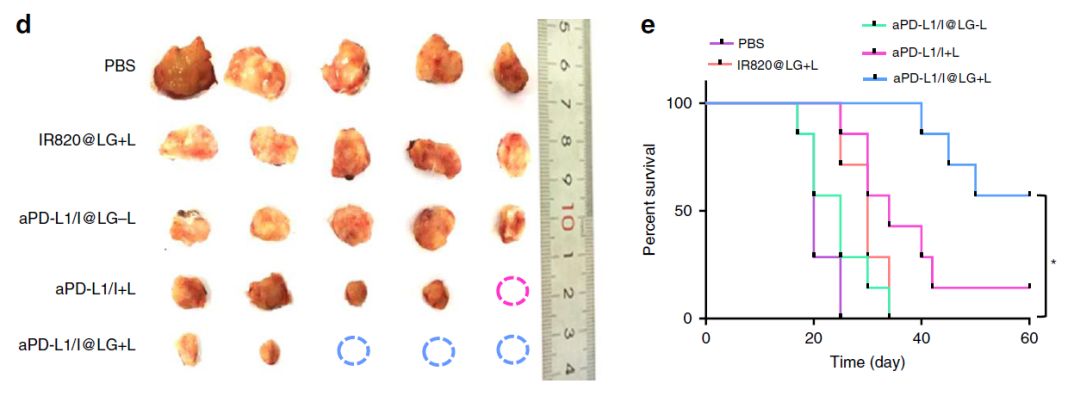
该研究表明,共生温和光热辅助免疫疗法(SMPAI)能够改善“冷肿瘤”的免疫应答,增强抗PD-L1疗法的治疗效果。通过可控的治疗释放起到长期抗肿瘤作用,并且可以根据罹患癌症的个体的各种需求来实现所需的预编程剂量方案。SMPAI可作为治疗“冷肿瘤”的有效且有希望的策略。
论文链接:
https://www.nature.com/articles/s41467-019-12771-9


