Resmetirom治疗NASH的三期临床(MAESTRO-NASH)成功
时间:2022-12-20 05:59:14 热度:37.1℃ 作者:网络
2022年12月19日,Madrigal Pharmaceuticals宣布Resmetirom治疗NASH的三期临床MAESTRO-NASH达到主要终点和关键次要终点。
此前II期研究结果于2019年发表在Lancet上,见:Lancet:Resmetirom治疗非酒精性脂肪性肝炎II期临床效果显著。在2020年III期临床试验时,曾一度受到疫情影响,不过初步结果也喜人,见:3期临床新数据证明:THR-β激动剂Resmetirom可显着降低NASH患者的肝脏脂肪和纤维化程度
此次发布的是III期MAESTRO-NASH 试验,符合 MAESTRO-NASH 资格要求的患者按 1:1:1 的比例随机接受 resmetirom 80 mg、resmetirom 100 mg 或安慰剂,每天口服一次。研究终点为双主要终点,即NASH 消退,NAS(NAFLD 活动评分)减少≥2 分,纤维化没有恶化,或者纤维化减少 1 分,NAS 没有恶化。 任一主要终点的实现被认为是成功的试验结果。 一个关键的次要终点是降低 LDL-C。
参加 MAESTRO-NASH 研究的所有患者(总共多达 2,000 名)在最初的 52 周治疗期后继续接受治疗长达 54 个月,以累积和测量肝脏临床结果事件,包括活检进展为肝硬化(52 周和 54 个月)和肝脏失代偿事件,以及全因死亡率。
主要分析 NASH 人群(ITT,安全人群)中 966 名随机患者的基线特征在治疗组之间是平衡的,包括年龄 57 (10)(平均值 (SD))、女性 56%、白人 89%、西班牙裔 21%、 BMI 36 (7) kg/m2,2 型糖尿病 67%,高血压 78%,血脂异常 71%,甲状腺功能减退 13%,FibroScan,千帕 (kPa) 13 (7),CAP 348 (38),MRI-PDFF 18% ( 7), FIB-4 1.4 (0.7), ALT 55 (32) IU, AST 41 (23) IU, LDL 99 (40) mg/dL, 甘油三酯 188 (132) mg/dL, 血红蛋白 A1C 6.6 (1) % , 精灵 9.8 (0.9)。 药物包括 49% 的他汀类药物、14% 的 GLP-1 激动剂和 14% 的 SGLT2 抑制剂。 基线肝活检纤维化评分包括 F3 (~60%)、F2 (~35%)、F1B (~5%)(主要分析人群),其中 84% 的 NAS ≥5,基于整个研究的独立初级病理读片和两位中央病理学家进行评估。
主要结果:
- 接受 resmetirom 80 mg 和 100 mg 治疗 52 周后,NASH 缓解率分别为 26% 和 30%,而安慰剂组为 10%。
- 对于肝纤维化,分别有 24% 和 26% 的 resmetirom 80 mg 和 100 mg 患者以及 14% 的安慰剂患者观察到纤维化改善 ≥ 1 级且 NAFLD 活动评分 (NAS) 没有恶化(两种剂量 p <0.0001)
- 纤维化改善至少一个阶段,NAS 没有恶化(80 毫克和 100 毫克分别为 p=0.0002 和 <0.0001)
- 在降低 LDL-C 的次要终点中,resmetirom 80 mg 和 100 mg 导致降低 12% 和 16%,而安慰剂组增加 1% (p<0.0001)
- 对 NASH 生物标志物和成像的多重积极影响
- Resmetirom 在 MAESTRO-NASH 研究中安全且耐受性良好,与 3 期 MAESTRO 试验的总体安全性一致,扩大了大型安全性数据库
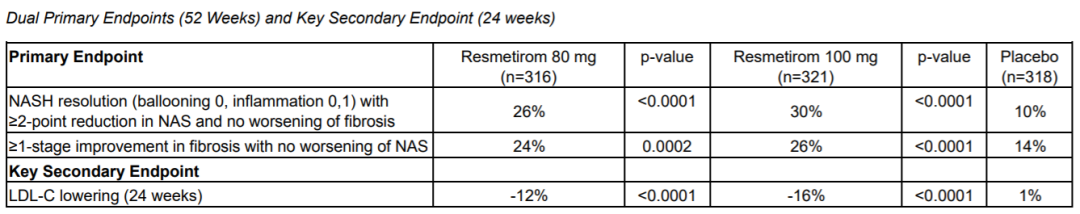
52周双主要终点和24周关键次要终点的结果
| Primary Endpoint | Resmetirom 80 mg (n=316) |
p-value | Resmetirom 100 mg (n=321) |
p-value | Placebo (n=318) |
|||
| NASH resolution (ballooning 0, inflammation 0,1) with ≥2-point reduction in NAS and no worsening of fibrosis | 26% | <0.0001 | 30% | <0.0001 | 10% | |||
| ≥1-stage improvement in fibrosis with no worsening of NAS | 24% | 0.0002 | 26% | <0.0001 | 14% | |||
| Key Secondary Endpoint | ||||||||
| LDL-C lowering (24 weeks) | -12% | <0.0001 | -16% | <0.0001 | 1% | |||
Madrigal 拟提交新药申请,寻求加速批准 resmetirom 用于治疗非肝硬化 NASH 伴肝纤维化。
另外,该公司目前正在进行 NASH resmetirom 的四项 3 期试验,包括MAESTRO-NASH, MAESTRO-NAFLD-1, MAESTRO-NAFLD-OLE, MAESTRO-NASH-OUTCOMES.
MAESTRO-NASH 即是本次发布的III期临床研究。
MAESTRO-NAFLD-1 于 2019 年 12 月启动,为期 52 周的多中心、随机、安慰剂对照 resmetirom 3 期研究在 1,200 多名 NAFLD(假定为 NASH)患者中完成,已经完成双盲组和开放标签 100mg治疗臂。 早期(代偿良好)NASH 肝硬化患者的另一个开放标签积极治疗组正在进行中。 主要终点是评估 resmetirom 的安全性和耐受性。
MAESTRO-NAFLD-OLE是一项单独的 52 周 3 期临床试验,即 MAESTRO-NAFLD-1的开放标签扩展研究,还正在进行。
MAESTRO-NAFLD-1 研究中,患者以 1:1:1:1 的比例随机接受每日一次的resmetirom 80 毫克、resmetirom 100 毫克、安慰剂双盲组或resmetirom 100 毫克的开放标签臂。 MAESTRO-NAFLD-1(与 MAESTRO-NASH 不同)不包括肝活检,代表“真实世界”的 NASH 研究。 具有 3 种代谢危险因素的患者通过历史肝活检或非侵入性技术记录为 NASH 或 NAFLD。 MAESTRO-NAFLD-1 使用无创措施,旨在提供增量安全信息以支持 NASH 适应症,并提供有关临床相关关键次要疗效终点的额外数据,以更好地表征resmetirom对心血管和肝脏相关疾病的潜在临床益处。 达到了主要安全终点和几个关键的次要终点,包括 LDL-C、载脂蛋白 B 和甘油三酯降低以及 MRI-PDFF 确定的肝脂肪减少。 评估了其他次要和探索性终点,包括肝酶、FibroScan 和 MRE 评分以及其他 NASH 生物标志物的减少。
来自 MAESTRO-NASH 52 周前 1,000 名患者部分的数据,以及来自 MAESTRO-NAFLD-1、MAESTRO-NAFLD-OLE、2 期和 1 期数据的数据,包括安全参数,将构成潜在子部分的基础 H 向 FDA 提交加速批准 resmetirom 用于治疗 NASH。
2022 年 8 月,Madrigal 启动了 MAESTRO-NASH-OUTCOMES,这是一项随机双盲安慰剂对照研究,对大约 700 名早期 NASH 肝硬化患者进行了研究,以无创监测肝功能失代偿事件的进展。 预计一个积极的结果将支持 resmetirom 用于非肝硬化性 NASH 的完全批准,可能会加快完全批准的时间表。 此外,这项研究有可能支持瑞美替罗在代偿良好的 NASH 肝硬化患者中的额外适应症。
Resmetirom为一款THR-β选择性激动剂。
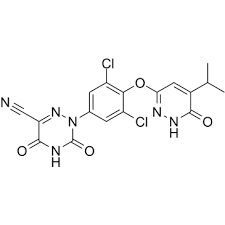
图:Resmetirom化学结构
下图为一些公布的结果:
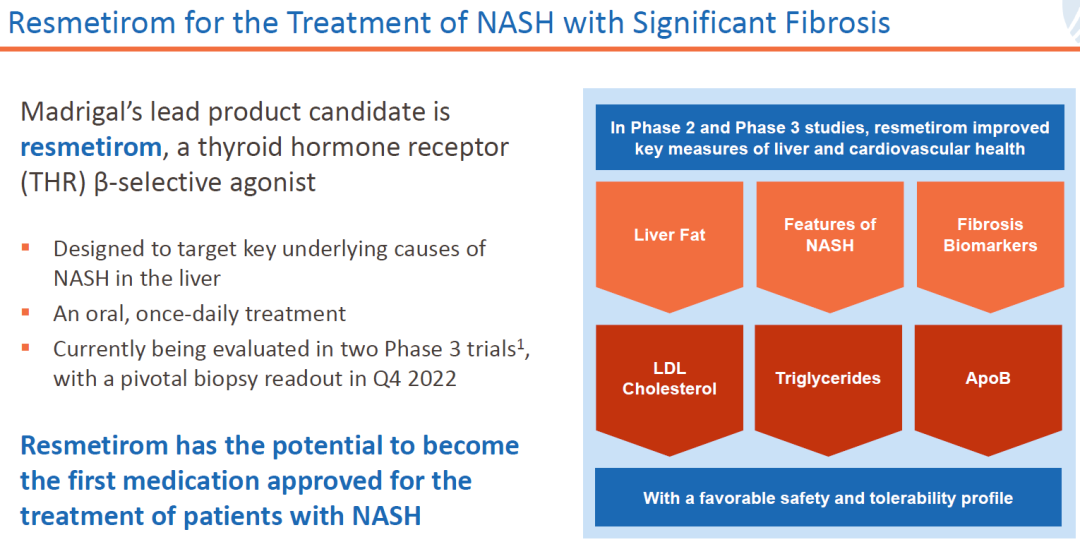
Resmetirom可以减少肝脏脂肪、下调纤维化生物标志画、降低甘油三酯、LDL、ApoB等。
二期临床中,Resmetirom已经表现出强大的治疗潜力。
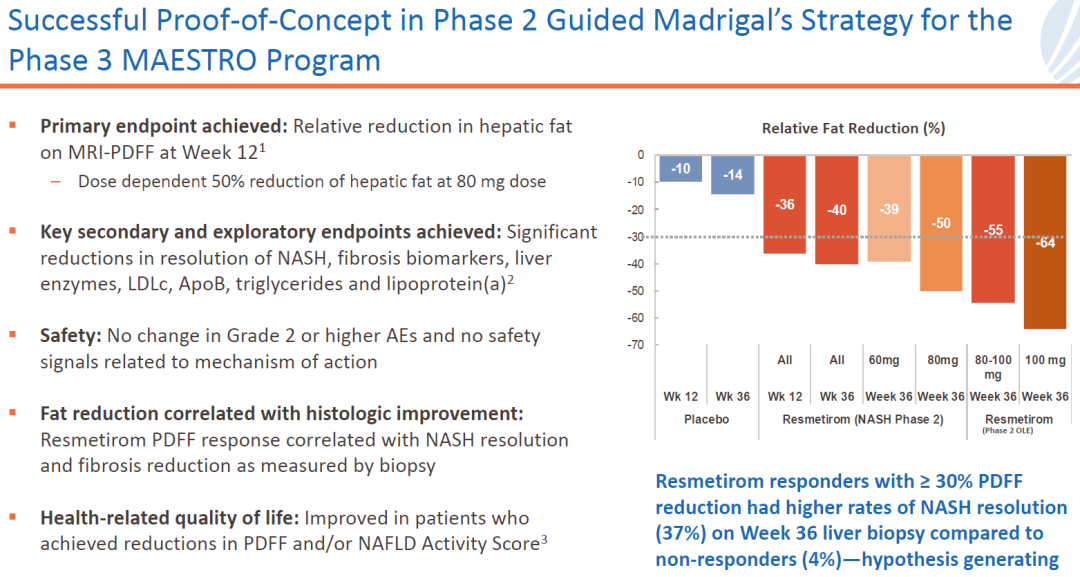
此次公开数据的三期临床表明,Resmetirom两个剂量NAS下降超过2分的比例都显著超过安慰剂组,至少一个阶段纤维化改善比例都显著超过安慰剂组,关键次要终点LDLC的下降显著超过安慰剂组。
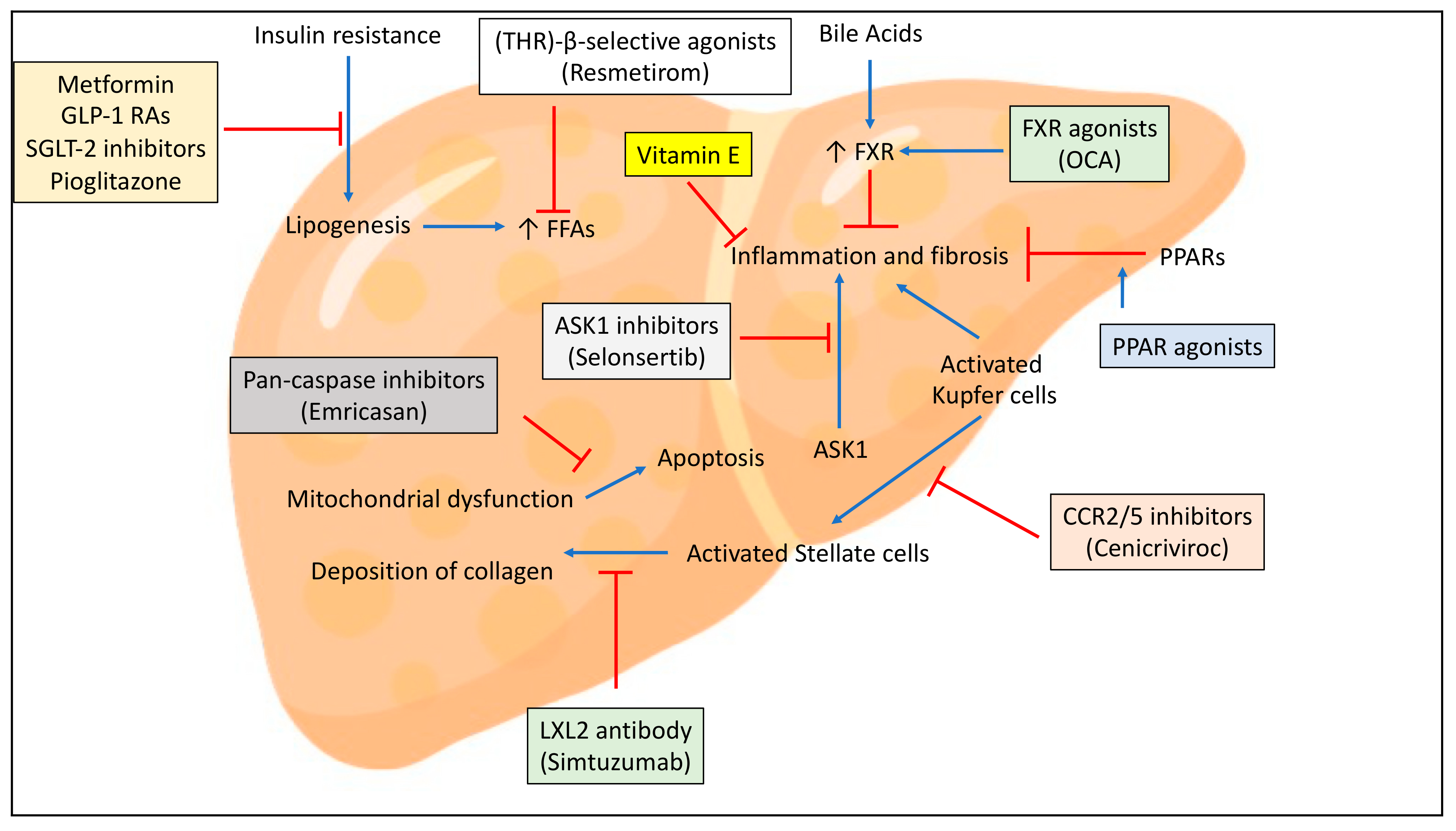
虽然,NASH领域一直认为是研究黑洞,但是近年来屡有进展。针对NASH的多个靶点,包括FXR,ASK1,THR-β,LXL2,PPAR等,均有一定的进展,见下图:
随着NASH的机制越来越明确,未来会呈现更为激烈的竞争。此前相关研究:
索马鲁肽挑战NASH初获成功,过半患者NASH消除症状
FDA授予辉瑞Ervogastat/Clesacostat用于非酒精性脂肪性肝炎 (NASH) 的快速通道资格
NEJM:拉尼兰诺治疗NASH的疗效
Efruxifermin (EFX) 治疗非酒精性脂肪性肝炎 (NASH),FDA授予其“快速通道资格”
J Hepatol:MRG15可能是非酒精性脂肪肝炎的新潜在靶点
新研究揭示非酒精性脂肪肝炎的有效治疗靶标和血清诊断标志物
Nat Med:Aramchol治疗非酒精性脂肪性肝炎的疗效分析
Nat Med:Eruxifermin治疗非酒精性脂肪性肝炎的疗效如何?


