Advanced Science:重庆医药高等专科学校许商成团队发现镉诱导肝毒性的潜在机理
时间:2023-01-22 18:01:05 热度:37.1℃ 作者:网络
镉(Cd)是导致肝脏疾病的高危毒素。过度的线粒体自噬是Cd诱导肝毒性的标志,但对其发生机制尚不清楚。
2023年1月15日,重庆市职业病防治院实验医学中心/重庆医药高等专科学校许商成团队在Advanced Science 在线发表题为“MCU Upregulation Overactivates Mitophagy by Promoting VDAC1 Dimerization and Ubiquitination in the Hepatotoxicity of Cadmium”的研究论文,该研究发现线粒体Ca2+单向转运蛋白(MCU)是线粒体和细胞稳态的关键调节剂。该研究发现Cd暴露上调了MCU表达并增加了线粒体的Ca2+摄取。通过siRNA或Ru360抑制MCU显着减弱Cd诱导的过度线粒体自噬,能够挽救线粒体功能障碍并增加肝细胞活力。杂合子MCU敲除小鼠的肝功能、病理损伤、线粒体碎裂和Cd暴露后的线粒体自噬均表现出明显改善。
从机制上讲,Cd通过磷酸化激活Ser133处的cAMP反应元件结合蛋白(CREBS133)并随后结合TGAGGTCT,ACGTCA和CTCCGTGATTA区域的MCU启动子,上调MCU表达,使MCU基因转录增加。上调的MCU与电压依赖性阴离子选择性通道蛋白1(VDAC1)强烈相互作用,增强其二聚化和泛素化,诱导过度的线粒体自噬。该研究揭示了一种Cd上调MCU以增强线粒体自噬和肝毒性的新机制。

镉(Cd)是一种广泛分布在环境中的重金属污染物,容易被人类以各种形式吸收,继而沉积在目标组织中,长期以来一直威胁着人类健康。肝脏是Cd中毒的关键靶器官。流行病学研究表明,接触Cd可诱导非酒精性脂肪肝,非酒精性脂肪性肝炎、肝细胞癌、肝脂肪变性和纤维化、肝坏死炎症和人类功能障碍等疾病。此外,动物研究还表明,接触Cd会导致肝脏结构破坏,加速炎症、脂肪变性、纤维化或肝癌的进展。但Cd诱导肝毒性的潜在机制仍不清楚,探索Cd诱导肝毒性的新发病机制将提供新的致病因素和治疗策略参考。
线粒体是Cd肝毒性的主要靶细胞器。各种疾病模型中,Cd暴露加速了线粒体外膜和内膜(OMM和IMM)的破裂,导致线粒体肿胀和碎裂。以往研究表明,过度激活的线粒体自噬与Cd诱导的肝毒性线粒体功能障碍高度相关。与健康肝细胞中的线粒体自噬相反,Cd导致线粒体自噬过度,导致正常线粒体大量丢失,线粒体代谢紊乱,如ATP合成下降、线粒体活性氧(MtROS)过量产生,MtROS是Cd诱导肝毒性的关键介质。上述研究强调,过度的线粒体自噬是Cd诱导的肝毒性的关键标志,表明靶向线粒体自噬可能是一种新的治疗策略。
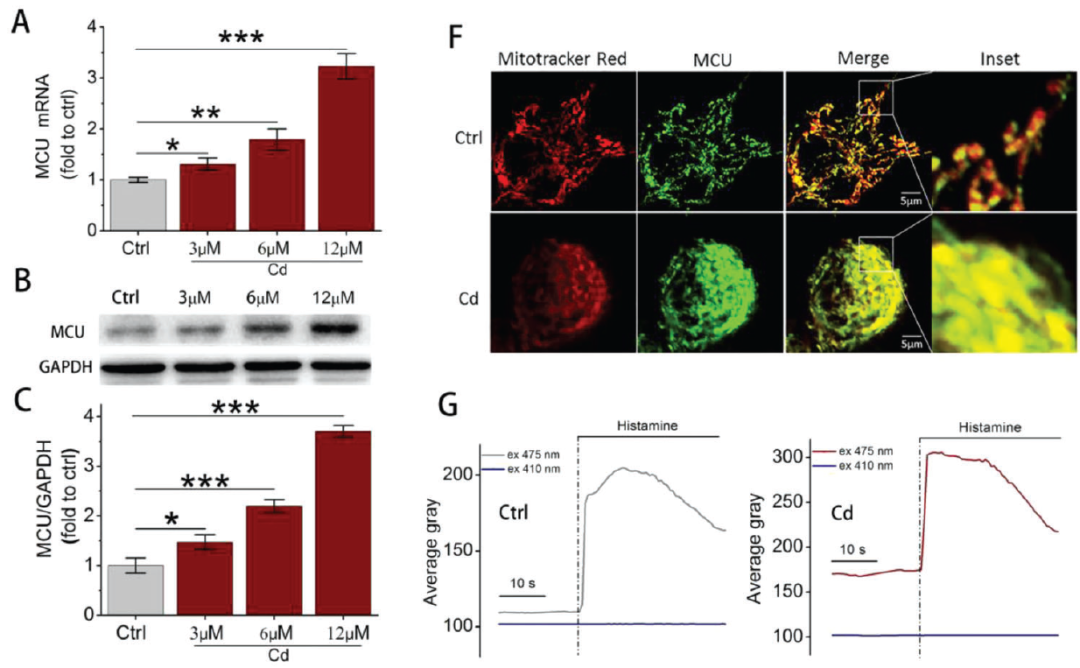
Cd暴露对MCU表达和线粒体Ca2+吸收的影响(摘自Advanced Science )
线粒体Ca2+稳态维持了正常的线粒体形态和生物学功能。研究报道,线粒体Ca2+持续性过载等体内平衡的紊乱,将导致线粒体分裂和自噬以清除受损的线粒体部分。线粒体Ca2+单向转运蛋白(MCU)与其调节亚单位形成复合物,是线粒体内膜上主要的Ca2+摄取通道。MCU已被确定为MCU复合物的核心成孔分子,其对线粒体Ca2+稳态的调节其主要作用。MCU能够通过调节线粒体Ca2+信号传导导致肝脏脂质积聚、脂肪变性和HCC细胞转移。
值得注意的是,MCU通过DRP1-ZIP1介导的线粒体自噬参与线粒体质量监测,以维持正常条件下线粒体网络的动态平衡。进一步研究发现,MCU通过线粒体自噬介导经缺血/再灌注(IR)或氯化镧(LaCl)处理的神经细胞损伤。结合已有研究,Cd暴露显著增加了线粒体Ca2+含量,该团队假设MCU可能是调节Cd肝毒性中过度线粒体自噬的关键分子。
该研究发现基于cAMP响应元件结合蛋白(CREB),Cd暴露使MCU表达明显增强,随后通过增加电压依赖性阴离子选择性通道蛋白1(VDAC1)二聚化和泛素化诱导过多的线粒体自噬。该研究将MCU确定为对抗Cd肝毒性的新型治疗靶点。此外,MCU的上调可作为Cd诱导的肝毒性潜在生物标志物。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202203869


