北京大学戴志飞课题组ACS Nano: 通过操纵仿生纳米盘的血管靶向能力,助力肿瘤靶向栓塞与化疗协同治疗
时间:2023-08-14 11:32:51 热度:37.1℃ 作者:网络
肿瘤血管栓塞疗法是一种前景广阔的抗肿瘤策略,具有抗癌普适性、疗程短、起效快、耐药风险低等优点。然而,其临床应用受到肿瘤栓塞边缘复发和非特异性血管闭塞等潜在风险的阻碍。鉴于此,北大戴志飞团队研制了一种血管靶向的高密度脂蛋白仿生纳米盘(PCPN),其负载焦脱镁叶绿酸-a(Ppa)和喜树碱(CPT),介导光激活的肿瘤靶向栓塞和化疗协同治疗(图1)。通过对纳米盘的平面或侧边分别进行靶向配体RGD修饰,研究了配体修饰的各向异性对其血管内皮细胞靶向能力的影响。结果表明,平面修饰纳米盘(PCPN)的内皮细胞摄取效率是侧边修饰纳米盘的7倍。体内实验证明,PCPN可有效靶向肿瘤血管内皮细胞,在激光照射下,光动力反应在肿瘤局部诱发大量血栓,从而切断肿瘤细胞营养供应。同时,CPT在肿瘤细胞还原环境下释放,进而杀灭栓塞边缘残存的细胞,抑制肿瘤复发。相关工作以“Manipulating Neovasculature-targeting Capability of Biomimetic Nanodiscs for Synergistic Photoactivatable Tumor Infarction and Chemotherapy”为题发表在ACS Nano。
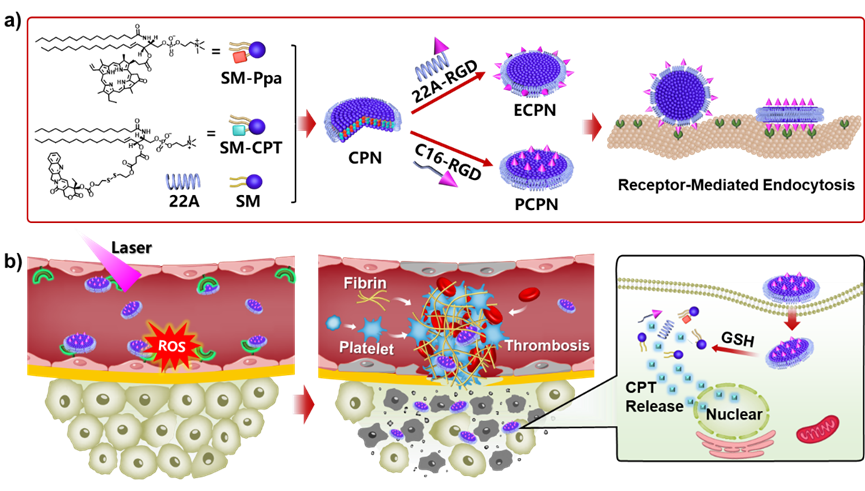
图1 操纵仿生纳米盘的血管靶向能力,实现肿瘤靶向栓塞与化疗协同治疗
首先,利用流式细胞术研究了配体各向异性修饰的纳米盘在小鼠结直肠癌细胞CT26、人黑色素瘤细胞M21和人脐静脉内皮细胞HUVEC中的细胞摄取情况。与ECPN相比,PCPN在CT26、M21和HUVEC中的内吞效率分别增强了5倍、5倍和7倍。RGD配体修饰的各向异性对细胞内吞效率的巨大影响主要是由于纳米盘上能同时与细胞膜接触的RGD肽的数量不同。ECPN中,RGD分布在侧边不同方向,只有一小部分RGD能与细胞表面的整合素结合。相反,PCPN中的RGD均匀地分布在顶部或底部两个方向,因此约50%的RGD能与细胞膜相互作用(图1a)。与细胞膜接触的RGD数量越多,意味着纳米盘与整合素有更高的结合亲和力,类似多价肽结合机制。在4℃下,PCPN在CT26和HUVEC细胞表面的粘附效率也显著高于ECPN。以上结果证明,通过操纵RGD配体修饰的各向异性,可以大大提高受体介导的纳米盘胞吞效率(图2)。
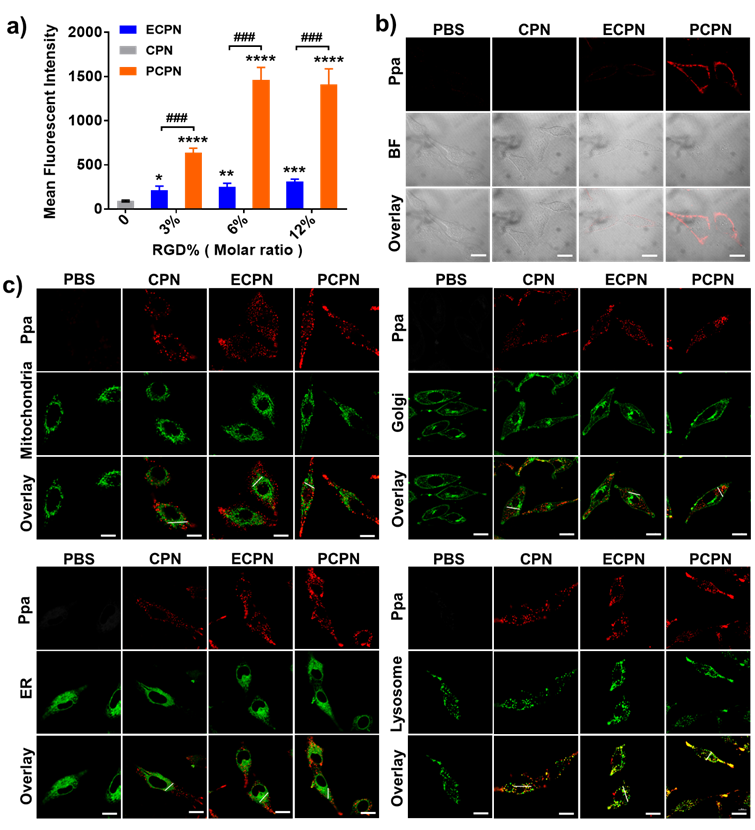
图2 纳米盘配体修饰的各向异性影响受体介导的细胞内吞效率
小鼠肿瘤组织免疫荧光结果表明,PCPN在体内可有效靶向肿瘤血管内皮细胞。为了进一步研究PCPN是否能通过光动力反应特异性诱导肿瘤血栓形成,作者对CT26荷瘤小鼠静脉注射PCPN后进行激光照射,利用超声造影成像(CEUS)监测肿瘤血液灌注的变化。结果显示,PCPN组在激光照射后的肿瘤血流灌注量显著下降,证明其诱导了大量的肿瘤血栓。肿瘤组织HE染色的结果显示,与非靶向纳米盘相比,PCPN组肿瘤有更多明显的出血及含有纤维蛋白的血栓区域(图3)。
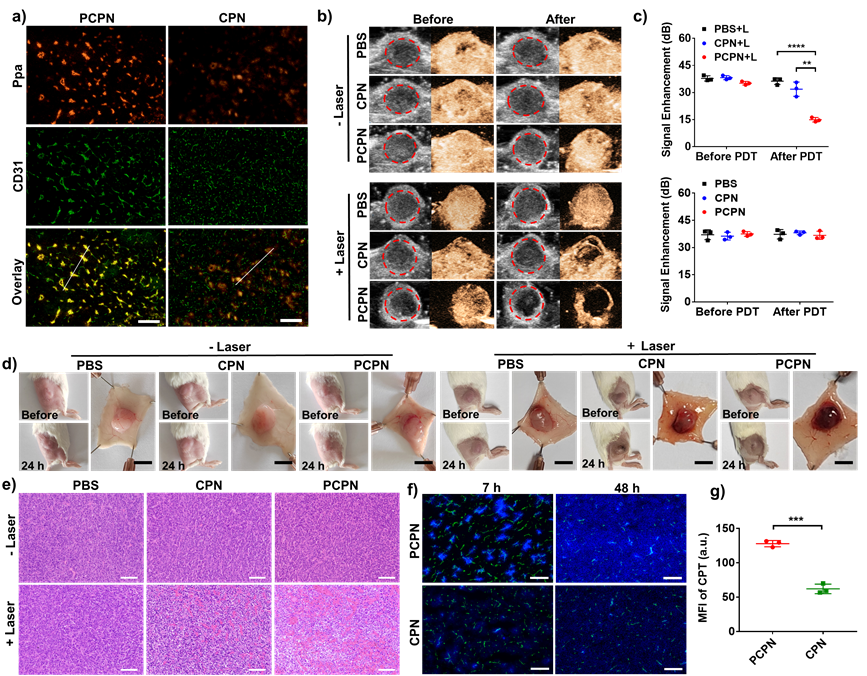
图3 平面修饰的纳米盘PCPN靶向肿瘤血管并介导肿瘤血栓形成
最终,作者考察了PCPN对CT26荷瘤小鼠的抑瘤效果。PCPN联合光照介导的肿瘤栓塞与化疗的协同治疗彻底消融了肿瘤组织,后期无复发。肿瘤组织凋亡染色(TUNEL)染色结果显示,PCPN联合光照组的凋亡率约为94.8%,明显高于其余对照组,进一步佐证了光激活的肿瘤栓塞与化疗协同治疗是一种极具潜力的抗癌疗法(图4)。

图4 PCPN的体内抑瘤效果研究
【总结】
本研究开发了一种新型血管靶向仿生纳米盘,用于光激活的肿瘤血管栓塞和还原响应型化疗的协同治疗。通过操纵纳米盘靶向配体修饰的各向异性,作者发现平面修饰RGD的纳米盘具有更高的细胞摄取效率及更好的抑瘤效果,这主要是基于其具有更多的RGD能同时与细胞表面接触,从而与整合素具有更高的结合亲和力。PCPN具有良好的肿瘤血管内皮细胞靶向性,在激光照射下可诱导大量肿瘤局部血栓形成,并在肿瘤还原微环境中释放CPT,从而有效根除结直肠肿瘤且不复发。这项研究不仅证明了靶向配体平面修饰的仿生纳米盘作为一种潜在的药物递送系统,其效果优于脂质体和未修饰纳米盘,还为癌症协同疗法提供了一种具有广阔临床应用前景的药物。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.3c05463


