2023年美国麻醉医师协会神经肌肉阻滞的监测和拮抗实践指南解读
时间:2023-04-01 16:07:07 热度:37.1℃ 作者:网络
肌松药作为全身麻醉用药重要组分,包括去极化与非去极化肌松药。术后残余肌松作用会引起患者的不良预后,如上呼吸道阻塞、再插管、肺不张、肺炎,麻醉后恢复室(post-anesthesia care unit, PACU)停留时间延长,并降低患者满意度。
通过肌松监测可预防上述不良事件的发生,改善患者的不良预后。2023年1 月美国麻醉医师学会(ASA)神经肌肉 阻滞专家组在《Anesthesiology》杂志发布《2023美国麻醉医师协会神
经肌肉阻滞的监测和拮抗实践指南》(以下简称指南) 。
该指南提供了关于神经肌肉监测和肌松药拮抗的 循证医学建议,以期通过减少术后残余肌松作用提高 患者全身麻醉后的安全性。该指南更新的具体内容见表1。

表1 指南更新内容
NO.1 指南解读
1. 全麻下肌松监测对患者预后的影响
常用的全麻下肌松监测方法包括临床经验评估(如抬头)、定性评估(周围神经刺激器)和定量评估,即TOFr。该指南提出,接受肌松监测定量评估的患者比使用定性评估与临床经验评估的患者,肌松残留阻滞的发生率更低,见表2。肌松监测定量评估可能会降低全身麻醉后肺部并发症和缺氧的发生率。
一项单中心质量改进前后对照研究显示,与定性评估相比,定量评估的患者肺 部并发症发生率较低;也有多中心前瞻性队列研究 认为使用定量或定性评估对于呼吸衰竭、缺氧、肺部 感染、炎症浸润、肺不张、吸入性肺炎、支气管痉挛或肺水肿等肺部并发症的发生无差异。
但需要注意的是,该研究有关于肺部并发症的证据力度较低。在三项有关肌松监测对缺氧事件发生的临床随机对照研究中,有两项提示定量肌松评估能够降低缺氧的发生。目前有充足的证据证明定量肌松监测能够降低肌松残留阻滞的发生,而对肺部并发症的影响,尚缺乏足够证据。
『琥珀胆碱』作为唯一临床上应用的去极化肌松药,与非去极化肌松药相比,全麻下肌松阻滞监测呈现出不同的恢复模式。目前,有效监测正常与异常琥珀酰胆碱诱导的神经肌肉阻滞的唯一方法是测量一个单个抽搐的基线高度,使用这个单个抽 搐的百分比判断肌肉力量的恢复。
当阻滞衰退的比率异常时,临床医师需要注意可能存在异常的假性胆碱酯酶活性。考虑到实际临床应用中,琥珀酰胆碱常与临床经验评估的患者,肌松残留阻滞的发生率更低,见表2。肌松监测定量评估可能会降低全身麻醉后肺部并发症和缺氧的发生率。
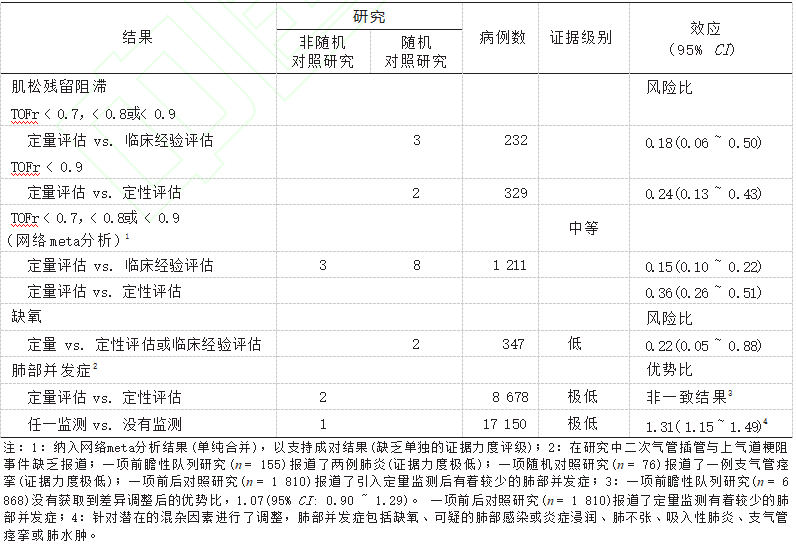
表2 肌松监测的定量评估与定性评估或临床评估比较的证据级别
一项单中心质量改进前后 对照研究显示,与定性评估相比,定量评估的患者肺 部并发症发生率较低;也有多中心前瞻性队列研究 认为使用定量或定性评估对于呼吸衰竭、缺氧、肺部 感染、炎症浸润、肺不张、吸入性肺炎、支气管痉挛或 肺水肿等肺部并发症的发生无差异。
但需要注意的是,该研究有关于肺部并发症的证据力度较低。在与非去极化肌松药联合应用,当有琥珀酰胆碱阻滞作用延迟消退的临床迹象时,建议使用神经肌肉监测指导气管导管拔除的时机。
2. 全麻下肌松监测拔管指征
残余神经肌肉阻滞被定义为拇收肌的TOFr=0.9。指南提出,当使用定量监测时,建议拔管前保证TOFr≥0.9。研究表明,用新斯的明或者舒更葡糖拮抗后,拔管前确认TOFr 的患者比没有确认的患者出现肌松残余作用的机率低,见表3。需要注意的是,这些分析都是间接比较。目前尚缺乏关于拔管前确认或不确认TOFr的随机试验的直接证据。
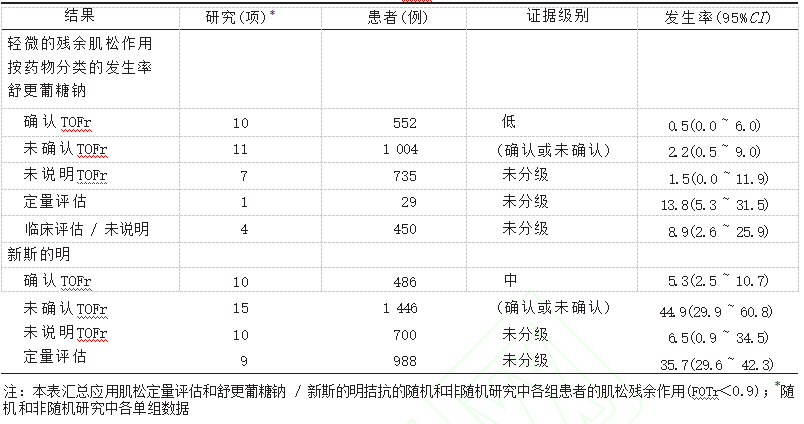
表3 使用舒更葡糖钠或新斯的明拔管前是否确认TOFr≥0.9对残余肌松作用出现几率证据级别
3. 全麻下肌松监测技术要点
全麻下肌松监测可指导术中肌松药的使用,有助于麻醉医师掌握停药和拔管时机,降低手术风险。该指南强烈建议使用拇内收肌行肌松监测,而不建议使用眼肌行监测。与皱眉肌、眼轮匝肌、眼窝肌相比,使用拇内收肌监测时 TOFr ≥ 0.8、0.9或 1.0 的时间更长,见表4。
运用拇内收肌行肌松监测的残余肌松发生率低于皱眉肌。手部拇内收肌、第一骨间背侧肌和小指 外展肌常被用来行肌电图监测。同时测量拇内收肌 和第一骨间背侧肌时TOFr结果相似,因而二者之间数 据相互转化是合理的。该指南认为,在拇内收肌不可 用或信号质量差的情况下可监测第一骨间背侧肌。
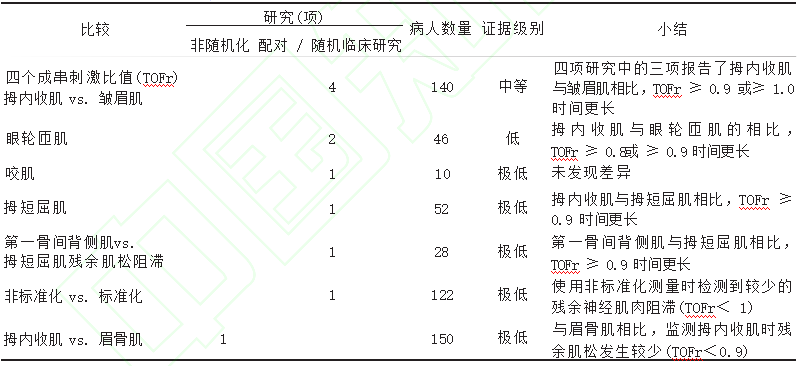
表4 肌松监测实施技术相关研究的汇总及其证据级别
二者同时测量时,拇内收肌的TOFr低于小指外展肌, 因而需谨慎使用小指展肌的数据指导肌松监测。研究显示拇内收肌和咬肌的恢复时间相似,拇内收肌和 拇屈肌之间的恢复时间比拇内收肌和眼肌之间的时间更为相似。
此外,神经肌肉阻滞深度的有效测量对 于指导药理学拮抗药物和剂量的选择也至关重要。 如果术中因没有其他部位可供监测,而只能对眼部肌肉进行神经肌肉监测,该共识建议在拮抗前将监测部 位改为拇内收肌。
4. 肌松药的拮抗
对于接受非去极化肌松剂的患者,目前可选用的拮抗剂包括胆碱酯酶抑制剂和舒更葡糖钠。神经肌肉阻滞深度的定量和定性监测内容见表5。指南评估了肌松拮抗剂新斯的明与舒更葡糖钠的疗效和安全性。相比于新斯的明,更推荐给予舒更葡糖钠拮抗罗库溴铵或维库溴铵不同程度的肌松效应,以避免出现肌松残留。
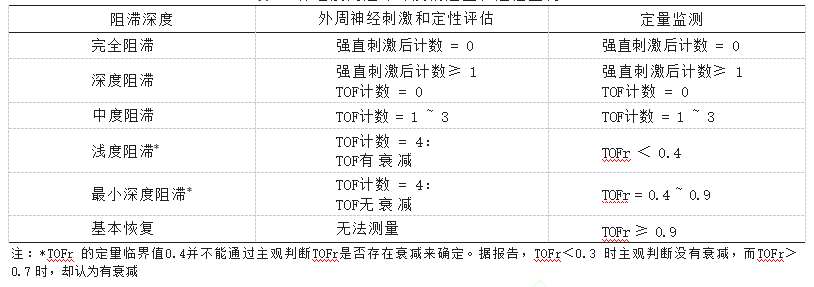
表5 神经肌肉阻滞深度的定量和定性监测
在最小肌松深度(TOFr:0.4 ~ 0.9)时,可以用新斯的明替代舒更葡糖钠进行肌松拮抗。与新斯的明相比,舒更葡糖的肌松残余发生率较低,达到TOFr ≥0.9的时间较短,但再麻痹率和再插管率没有差异。
低级别证据显示,舒更葡糖钠和新斯的明拮抗的患者在呼吸衰竭、低氧、肺部感染、肺不张、误吸性肺炎、支气管痉挛或肺水肿等肺部并发症发生率方面没有差异。
选择新斯的明还是舒更葡糖钠主要取决于是否能够识别出那些新斯的明就能够有效拮抗的患者。拮抗时患者肌力的恢复程度决定了新斯的明是否可以产生及时有效的拮抗效果。TOF计数为4 时给予新斯的明更有可能达到满意和及时的拮抗效果。
有研究结果显示,TOF计数虽然已经恢复到4次,但如果第4 次颤搐还非常微弱,也不能保证有效的拮抗作用。最小肌松深度时(TOFr = 0.4 ~ 0.9,TOF计数4且无衰减),新斯的明可达到有效拮抗。TOFr ≥ 0.4 的定量监测比主观观察四连串刺激有无衰减更能预测新斯的明拮抗效果。
美国食品药品监督管理局(FDA)建议用舒更葡糖钠拮抗 罗库溴铵或维库溴铵的剂量是2 mg/kg(TOF计数2 至 TOFr<0.9),4 mg/kg(强直后计数 1至TOF计数 1 的),16mg/kg(单次给予罗库溴铵1.2 mg/kg后即刻),最小肌松深度时新斯的明剂量30μg/kg。
新斯的明的拮抗作用在大约10分钟内达峰,因此在苏醒和拔管前超过10分钟使用新斯的明没有益处。如果恢复时间超过10分钟则不太可能是新斯的明的效果不佳,而更可能是因为给予新斯的明之前肌力未充分恢复。当新斯的明达到峰值但TOFr<0.9 时,仍有三种方法可实 现充分的拮抗作用。
(1)等待肌力自行恢复;
(2)如肌 松用药为罗库溴铵或维库溴铵,可给与舒更葡糖钠;
(3)如果已给予低剂量新斯的明,则追加新斯的明(总量不超过 50μg/kg)。
选择肌松拮抗药时应考虑肌松药类型(如甾体类、苄基异喹啉类)、神经肌肉阻滞的 深度、适用的拮抗药物类别,拮抗剂药物的封顶效应,以及完全拮抗所需的时间。可见进行肌松定量监测及合理应用肌松拮抗剂可以减少肌松残余的发生。FDA 规定使用激素避孕药(口服或非口服)的女性,应用舒更葡糖钠后7天内可能避孕效果有影响,需要备用避孕措施。
此外,该指南也总结了苄基异喹啉类神经肌肉阻滞剂的拮抗策略。使用阿曲库铵或顺式阿曲库铵并使用定性肌松监测时,新斯的明给药后到TOFr ≥ 0.9的时间范围为1 ~ 143分钟。为避免肌松残留,建议在最小肌松深度下用新斯的明拮抗。在没有定量肌松监测的情况下,从给予拮抗到拔管至少需要10分钟。有条件进行定量肌松监测时,拔管前只要确认 TOFr ≥ 0.9即可拔管。
苄基异喹啉类神经肌肉阻断药只能用乙酰胆碱酯酶抑制剂如新斯的明拮抗,舒更葡糖钠无效,拮抗是否能成功主要取决于给药时的肌松深度。TOF计数达到4次或目测4次颤搐没有衰减时,基本可以实现10分钟内完全拮抗。
如果TOF计数未达到4次则拮抗效果不佳。虽然给拮抗的时机差得很远(从TOFr<0.4恢复到TOF计数2~3),但拮抗作用的中位时间基本比较一致,均短于10分钟。因此,需要使用定量肌松监测,测量TOFr验证肌松是否恢复。
NO.2 指南展望
当前,定量监测肌松仍未作为临床实践中的常规项目,常规监测肌松残余存在挑战。患者持续抬头等床旁检测无法准确预测神经肌肉功能的恢复,其敏感性也存在欠缺;而定量肌松监测可提高患者满意度、缩短PACU停留时间、减少术后肺部并发症以及降低死亡率。
基于上述原因,指南对肌松监测的 要点进行了全面的评估,但该指南更适用于欧美人群,有必要制订符合中国国情的肌松监测管理指南。麻醉医师需接受定量肌松监测的继续教育培训,并在临床实践中持续跟踪反馈,最终达到科学的肌松管理降低相关的手术风险及术后并发症。
参考文献
[1]Murphy GS, Brull SJ. Residual neuromuscular block: lessonsunlearned. Part I: definitions, incidence, and adverse physiologiceffects of residual neuromuscular block[J]. Anesth Analg, 2010, 111:120-128.
[2]Thilen SR, Weigel WA, Todd MM, et al. 2023 American society ofanesthesiologists practice guidelines for monitoring and antagonism ofneuromuscular blockade: a report bythe american society ofanesthesiologists task force on neuromuscular blockade[J].
Anesthesiology, 2023, 138:13-41.
[3]Weigel WA,Williams BL, Hanson NA, et al. Quantitativeneuromuscular monitoring in clinical practice: a professional practicechange initiative[J]. Anesthesiology, 2022, 136:901-915.
[4]Kirmeier E, Eriksson LI, Lewald H, et al. Post-anaesthesia pulmonarycomplications after use of muscle relaxants (POPULAR): amulticentre, prospective observational study[J]. Lancet Respir Med,2019, 7:129-140.
[5]Adembesa I, Mung'ayi V, Premji Z, et al., A randomized control trialcomparing train of four ratio > 0.9 to clinical assessment of return ofneuromuscular function before endotracheal extubation on criticalrespiratory events in adult patients undergoing elective surgery at atertiary hospital in Nairobi[J]. Afr Health Sci, 2018, 18:807-816.
[6]Wardhana A, Kurniawaty J, Uyun Y. Optimised reversal without trainof- fourmonitoring versus reversal using quantitative train- of- fourmonitoring: An equivalence study[J]. Indian J Anaesth, 2019, 63:361-367.
[7]Murphy GS, Szokol JW, Marymont JH, et al. Intraoperativeacceleromyographic monitoring reduces the risk of residualneuromuscular blockade and adverse respiratory events in thepostanesthesia care unit[J]. Anesthesiology, 2008, 109:389-398.
[8]Abdulatif M, el- Sanabary M. Blood flow and mivacurium- inducedneuromuscular block at the orbicularis oculi and adductor pollicismuscles[J]. Br J Anaesth, 1997, 79:24-28.
[9]Larsen PB, Gätke MR, Gätke MR, et al. Acceleromyography of theorbicularis oculi muscle II: comparing the orbicularis oculi andadductor pollicis muscles[J]. Acta Anaesthesiol Scand, 2002, 46:1131-1136.
[10] Vega EA, Ibacache ME, Anderson BJ, et al. Rocuroniumpharmacokinetics and pharmacodynamics in the adductor pollicis andmasseter muscles[J]. Acta Anaesthesiol Scand, 2016, 60:734-746.
[11] Jones RK, Caldwell JE, Brull SJ, et al. Reversal of profoundrocuronium- induced blockade with sugammadex: a randomizedcomparison with neostigmine[J]. Anesthesiology, 2008, 109:816-824.
[12] Lee TY, Jeong SY, Jeong JH, et al. Comparison of postoperativepulmonary complications between sugammadex and neostigmine inlung cancer patients undergoing video- assisted thoracoscopiclobectomy: a prospective double- blinded randomizedtrial[J]. AnesthPain Med (Seoul), 2021, 16:60-67.
[13] Kim KS, Cheong MA, Lee HJ, et al. Tactileassessmentforthereversibilityofrocuronium- induced neuromuscular blockade duringpropofol or sevofluraneanesthesia[J]. Anesth Analg, 2004, 99:1080-1085.
[14] Kirkegaard H, Heier T, Caldwell JE. Efficacy of tactile- guidedreversal from cisatracurium- induced neuromuscular block[J].Anesthesiology, 2002, 96:45-50.
[15] Miller RD, Van Nyhuis LS, Eger 2nd EI, et al. Comparative times topeak effect and durations of action of neostigmine and pyridostigmine[J]. Anesthesiology, 1974, 41:27-33.
[16] Fuchs- Buder T, Meistelman C, Alla F, et al. Antagonism of lowdegrees of atracurium-induced neuromuscular blockade: doseeffectrelationshipforneostigmine[J].Anesthesiology, 2010, 112:34-40.
[17] Olesnicky BL, Lindberg A, Marroquin-Harris FB, et al.Asurveyofcurrentmanagementof neuromuscular block and reversal in Australiaand New Zealand[J]. Anaesth Intensive Care, 2021, 49:309-315.
[18] Naguib M, Kopman AF, Lien CA, et al. A survey of currentmanagement of neuromuscular block in the United States and Europe[J]. Anesth Analg, 2010, 111:110-119.
[19] Murphy GS, Szokol JW, Avram MJ, et al. Postoperative residualneuromuscular blockade is associated with impaired clinical recovery[J]. Anesth Analg, 2013, 117:133-141.
[20] Murphy GS, Szokol JW, Avram MJ, et al. Residual neuromuscularblock in the elderly: incidence and clinical implications[J].Anesthesiology, 2015, 123:1322-1336.
[21] Bronsert MR, Henderson WG, Monk TG, et al. Intermediate- actingnondepolarizing neuromuscular blocking agents and risk ofpostoperative 30-day morbidity and mortality, and long-term survival[J]. Anesth Analg, 2017, 124:1476-1483.


