Mol Cancer:CAR T治疗套细胞淋巴瘤的综述
时间:2023-04-11 06:01:14 热度:37.1℃ 作者:网络
CAR T治疗MCL
套细胞淋巴瘤 (MCL) 是成熟 B 细胞非霍奇金淋巴瘤 (NHL) 的一种亚型,以染色体易位为特征,典型原因是 Cyclin D1 的过度表达。尽管对 MCL 病因和 MCL 的治疗策略获得了较大进展,MCL仍然无法治愈。年龄、男性、快速进展、显著淋巴结受累、血清乳酸脱氢酶水平升高和预后指征(包括 Ki-67 表达增加和 TP53 突变)是结局较差的标志。使用CAR T 细胞的先进免疫治疗对 B 细胞恶性肿瘤和 MCL 患者有利。靶向细胞表面的 B 细胞抗原是复发 (R/R) MCL 的可行方法,因为在其他 B 细胞癌症中已获得显著的应答。但其严重不良反应、抗肿瘤活性有限、过敏原戒断(allergen withdrawal)、抗原逃逸、肿瘤浸润有限和转运是 CAR T 细胞治疗成功的主要障碍。
近日《Molecular Cancer》发表一篇综述,通讯作者为新乡医学院附属第一医院赵红兵教授和印度Lallubhai Motilal药学院Vivek P. Chavda教授,第一作者为赣南医学院第一附属医院黄走方教授和Vivek P. Chavda教授,文中简要概述了 CAR T 细胞治疗 MCL 的发展。现整理主要内容供各位老师参考。

MCL的治疗方案
MCL 的主要治疗策略因年龄和疾病特征而异,总结见图1。年轻和体能状态好的患者可开始采用含阿糖胞苷的强化免疫化疗方案,最终联合自体干细胞移植 (ASCT)。但对于老年人和体能水平较差的患者,低强度化疗和连续利妥昔单抗治疗是更好的替代方案;也有基于纳米技术的干预措施正在开发中。
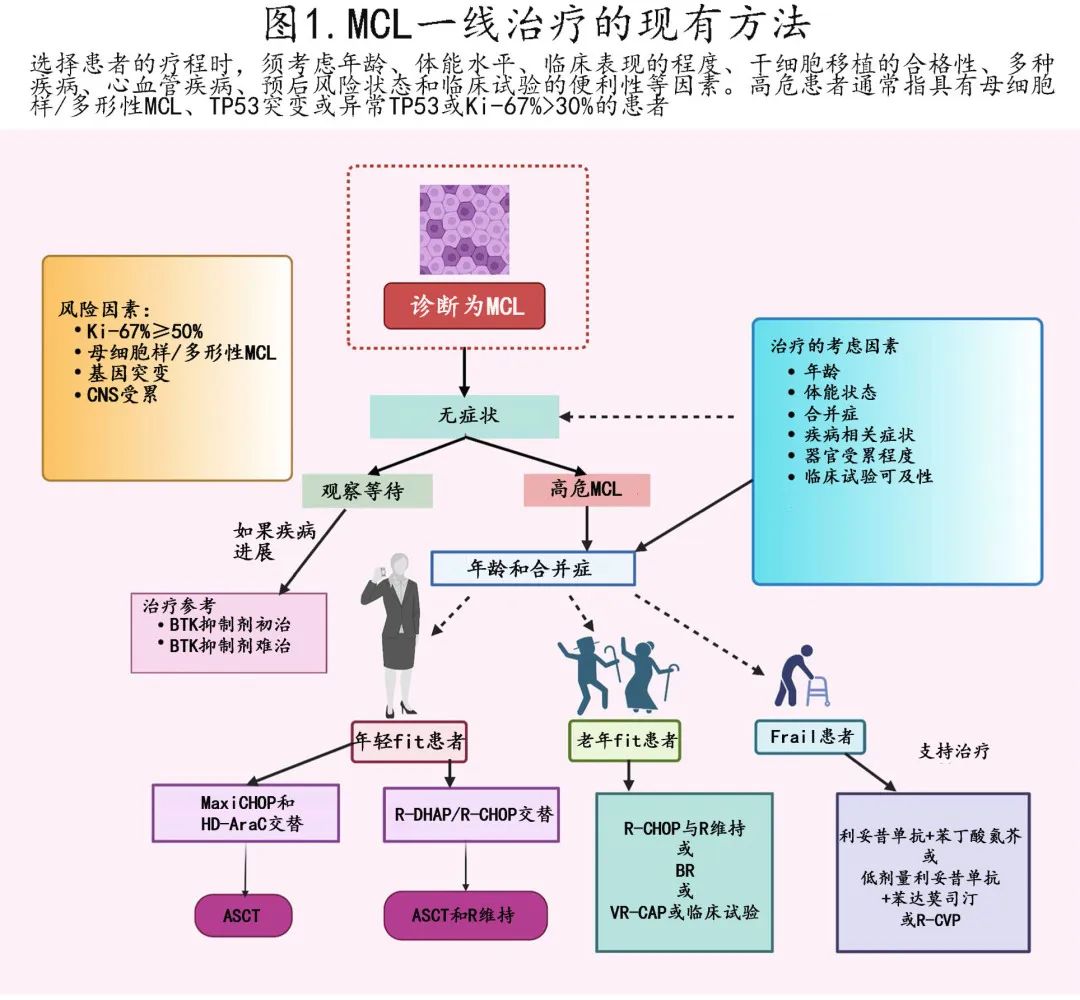
方案之一是 Nordic 方案,即maxi-CHOP(包含大剂量长春新碱、多柔比星、环磷酰胺和泼尼松)与大剂量阿糖胞苷和利妥昔单抗交替给药。其他策略为R-CHOP与利妥昔单抗、阿糖胞苷和地塞米松(包括铂衍生物)(R-DHAP)交替使用。利妥昔单抗和苯达莫司汀 (BR) 可与大剂量阿糖胞苷连续或交替给药。自体干细胞移植 (ASCT) 后,利妥昔单抗维持给药也可改善总生存期。
在首次缓解时ASCT可提高无进展生存期 (PFS),但不能提高总生存期 (OS)。因此有研究重新评估了移植部分的价值。进行中的 ECOG-ACRIN 4151 随机 III 期研究正在评估干细胞移植后使用利妥昔单抗,以评估其与利妥昔单抗单药相比在治疗二代测序 (NGS) “MRD阴性”患者中的表现;结果发现,尽管大多数年轻患者的结果有利,但部分高危(如 高Ki-67 增殖评分或 TP53 突变的患者)在强化治疗后没有显著获益。
老年患者或伴相关疾病的患者无法维持大剂量阿糖胞苷治疗;B或利妥昔单抗、硼替佐米、泼尼松、环磷酰胺和多柔比星方案是推荐的方案,但也可能建议尚未接受治疗的患者使用利妥昔单抗和来那度胺。
对于 R/R MCL 患者,免疫化疗的作用远小于一线治疗,因为复发频繁且预后不良。由于其安全性和有效性佳,通常使用靶向药物。最早获批的靶向药物是硼替佐米、Temsirolimus和来那度胺,但目前BTK抑制剂已成为二线治疗的明星。伊布替尼、阿可替尼和泽布替尼三种 BTK 抑制剂的半衰期较短但易于给药。在 R/R MCL 中也正在广泛研究联合治疗,伊布替尼与维奈克拉联合使用非常有效,结果优于任一药物单独使用且保持可耐受的安全性;在16周即可达到显著缓解率,完全缓解 (CR) 率分别为42%(无PET)和62%(有PET)。SYMPATICO III期研究正在分析协同使用伊布替尼和维奈克拉与伊布替尼单药相比治疗 R/R MCL 的疗效。
BTKi治疗后复发患者的有效治疗是一项迫切的临床需求,目前尚不清楚使用 BTKi 后改善患者的最佳疗程,但维奈克拉、化学免疫治疗和免疫治疗是可选方案。回顾性分析显示,利妥昔单抗、苯达莫司汀和阿糖胞苷 (R-BAC) 联合治疗在 BTKi 治疗后发生客观缓解率 (ORR) 的 MCL 生存者中ORR较高 (83%)。尽管缓解持续时间不长(PFS为10.1个月),但R-BAC已用作适合移植患者ASCT 巩固治疗前的过渡治疗。
此外BCL2抑制剂也有可能治疗MCL(MCL中 BCL2 通常过度表达)。维奈克拉是 BCL2 的强效选择性抑制剂。在涉及 R/RMCL 患者的1期研究中,维奈克拉的缓解率为75%(21例患者),CR率为21%。尽管 BTK 和 BCL2 抑制剂具有良好的缓解率,但其使用受限于耐药性扩大。有证据表明,BCL2蛋白家族的突变是 MCL 对维奈克拉获得性耐药的原因。
一项研究评估了 allo-SCT 作为 R/R MCL 患者的挽救治疗和 MCL 的一线治疗,两组均显示了相当的结局,5年总生存率为73%。根Simon Rule 等认为早期 allo-SCT 可能有利于风险增加的青少年患者,主要是 TP53 突变患者。
常规治疗选择存在一些局限性,而抗 CD19 CAR T 细胞治疗的发展彻底改变了 R/R 淋巴恶性肿瘤的治疗,基于 CAR T 细胞的过继细胞免疫疗法为BCL2 患者亚组提供了有效和持久的治疗效果。根据 ZUMA-2研究,与其他治疗选择相比,CAR T细胞治疗是 MCL 和 R/R MCL 最有效的治疗方法
CAR T疗法
图 2A为不同代次的CAR。

自2017年以来,FDA已批准6种CAR T疗法用于多发性骨髓瘤和白血病等不同血液肿瘤(图3),包括Axicabtagene ciloleucel、tisagenlecleucel、Idecabtagene vicleucel、Ciltacabtagene autoleucel、Lisocabtagene maraleucel和Brexucabtagene autoleucel,其中靶向 CD19 抗原的 Brexucabtagene autoleucel 对 MCL 最有效。

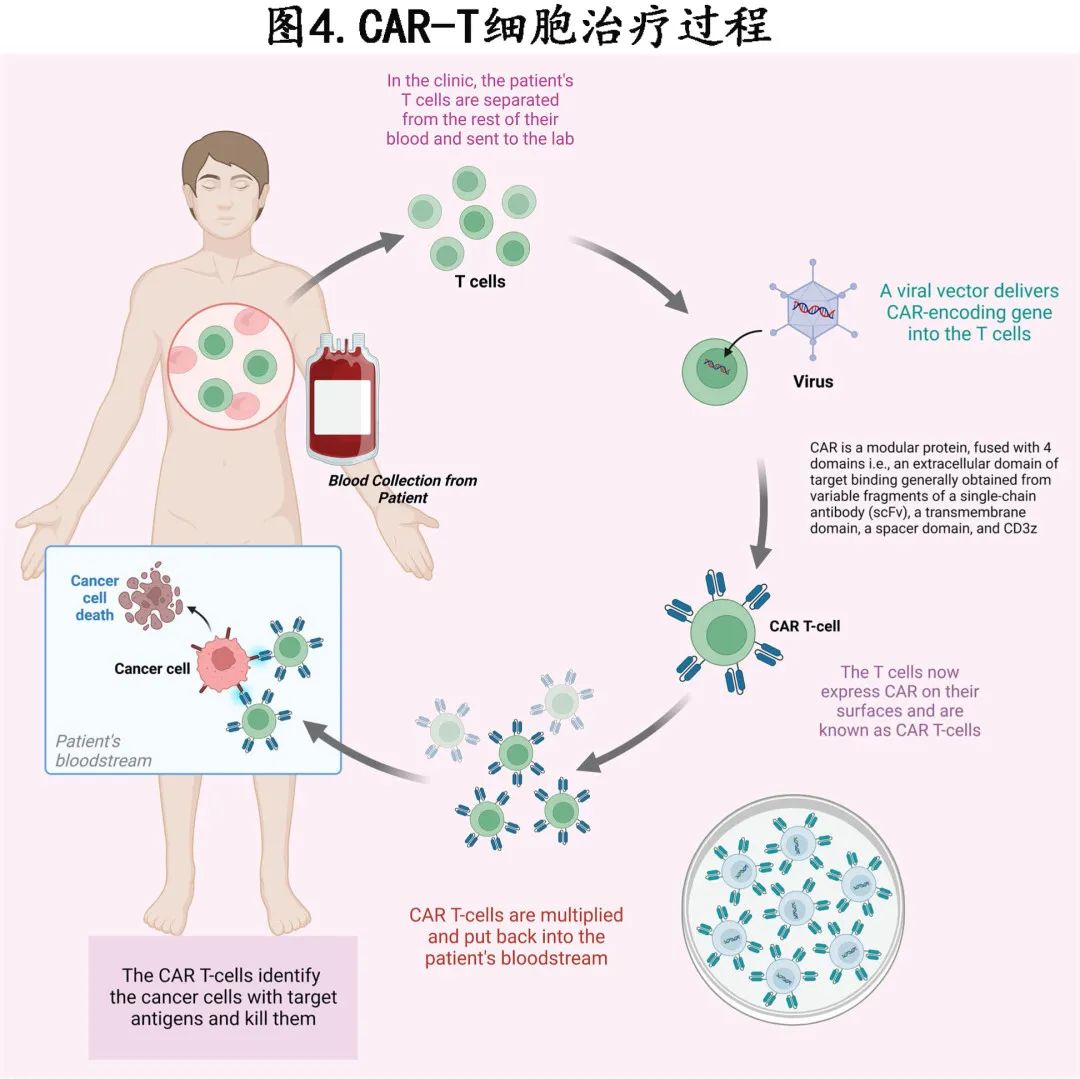
图 2B 和图4描述了 CAR T 细胞的生产工艺。
CAR T疗法在MCL的使用
ZUMA 2 和 TRANSCEND NHL 001研究在复发性和耐药性 MCL 患者中达到很好的结果。表1总结了MCL中CAR T的各种临床发展和结局。

ZUMA-2是一项 II 期、多中心临床研究,旨在评估 KTE-X19 (Brexucabtagene autoleucel,CD28 共刺激结构域CD19 CAR T 细胞)在 R/R MCL 患者中的有效性,研究的第2阶段目标剂量为2X106 CAR 阳性T细胞/kg。结果获得显著的缓解率,在任何特定的不良预测亚组中均未发现统计学显著性:Brexucabtagene autoleucel在老年患者、母细胞样变异和高 Ki-67 增殖指数患者以及 MIPI 评分和 TP53 突变高危患者中均安全有效,且缓解率显著。
牵头ZUMA-2 研究的 Michael Wang 教授认为,与其他现有药物相比,CAR T细胞治疗具有控制 MCL 耐药性的能力。ZUMA-2 在60例既往接受过最多5种治疗的 MCL 患者中评估了KTE-X19,结果ORR为93%,CR为67%。但在意向治疗评估中,所有74例患者的 ORR 为85%,59%达到CR。Brexu-cel 治疗反应迅速,中位缓解时间为1个月,中位至 CR 时间为3个月。
研究者在第47届EBM年会上报告了截至2019年12月的安全性和疗效结果。根据中位随访17.5个月报告,29例患者 (48%) 保持缓解,包括达到 CR 的患者中高达70%。随着随访时间的延长,brexu-cel反应保持一致。随访32.3个月,入组的前28例患者中39%仍有反应。Brexu-cel的长期持久性尚不清楚,但到目前为止,其在部分高危 BTK 抑制剂难治性患者中的疗效令人鼓舞。
Moffitt 癌症研究所的 Frederick Locke 医学博士表示,ZUMA-2研究取得了显著而持久的缓解,且评估按高危或其他特征分层(通常与 MCL 较差结局相关)的持续缓解率时,任何预后不良亚组均无统计学显著性:≥65岁患者的长期缓解率相同,母细胞样变异患者的长期缓解率与其他患者相当,高Ki-67 增殖指数的患者长期缓解比例相同,TP53 突变以及MIPI中高危患者也是如此。即使在高危患者中,KTE-X19 CAR T细胞治疗也显示出卓越的长期缓解率。每例接受 KTE-X19 治疗的患者均发生至少1例AE,99%的受试者发生≥3级AE,最典型的 AE 是血液学毒性。2例 (3%) 同时接受预处理化疗的患者发生了5级AE;在第2例患者中,菌血症与化疗和 brexu-cel 输注均相关。
所有 CAR T 细胞治疗中具有特殊意义的 AE 包括免疫效应细胞相关神经毒性综合征和细胞因子释放综合征 (CRS)。总体 CRS 发生率91%,15%为≥3级。为治疗CRS,59%的患者接受了托珠单抗,22%的患者接受了糖皮质激素。
Brexu-cel 选择性靶向 CD19 阳性细胞,因此 B 细胞再生障碍性贫血是预测的不良反应,可导致低丙种球蛋白血症。流式细胞术分析显示,在初始评估期间出现客观缓解和有效 CAR T 细胞生长的患者存在 B 细胞再生障碍性贫血。与之相反,在实验过程中未缓解患者均未发生 B 细胞再生障碍性贫血。但随着随访时间的延长,在12个月时持续缓解的患者B 细胞恢复。
TRANSCEND 研究 (lisocabtagene maraleucel (liso-cel))入组了 MCL 患者。截至2020年12月41例患者完成了采集,32例患者接受了liso-cel输注。Liso-cel 对治疗患者高度有效,ORR为84%,CR为59%;母细胞样形态缓解率达75%。liso-cel 安全性极佳,84%发生≥3级TEAE,大部分≥3级不良事件是血液学异常,此外有34%的患者的≥3级血液学毒性持续至输注后第29天。
单倍体 CAR T 细胞来源于血缘关系中匹配的健康供者,如兄弟姐妹或儿童,已被证明对难治性 MCL 患者有效。Haplo-CAR T细胞可在体内有效增殖,具有临床显著的抗肿瘤活性,且无严重副作用。一例患者的报道中,患者达到部分缓解但存在微小残留病灶。
CAR T细胞治疗的局限性
CAR T 细胞疗法存在一些不良反应,此外尽管其在复发或耐药B 细胞血液恶性肿瘤中疗效较佳,但也有显著的复发率。严重不良反应、抗肿瘤活性有限、过敏原戒断、肿瘤浸润有限和运输限制都是 CAR T 细胞治疗成功的障碍。许多因素可导致初始 CAR T 细胞治疗失败,例如对于部分患者,输注后或生产工艺期间的问题导致CAR T 细胞未在患者体内充分生长,其他问题包括CAR T细胞生产不当或患者有基础疾病。初始 CAR T 细胞治疗失败或受限的另一个因素在于,缺乏充分的研究来最大化 CAR T 细胞的治疗作用。
抗原逃逸或肿瘤对单抗原靶点 CAR 结构产生耐药性是 CAR T 细胞治疗的主要制约因素之一,现在许多技术通过靶向多种抗原来减少这种限制。为了同时靶向几种靶肿瘤抗原,这些使用串联CAR,即由两个 scFvs 组成的单个 CAR 结构,或双 CAR 结构。使用 CD19 和 CD20 或 CD19 和 CD22 的临床研究表明均有可能产生持续的永久缓解率。T 细胞和 CAR T 细胞代谢重编程均可改善 TME 应答、活性和效应功能,或减轻肿瘤细胞对侵袭 T 淋巴细胞进行的某些 TME 特异性改变的有害后果
Off-tumor/on-target识别、插入性致癌(insertional oncogenesis)、过敏反应、移植物抗宿主病和脱靶抗原识别是与 CAR T 细胞治疗相关的一些常见不良反应,为了确保治疗效果和防止“"on-target off-tumor”毒性,抗原选择在 CAR 设计中至关重要。MCL 的靶点主要是 CD19 和CD22,而健康正常 B 细胞也表达 CD19 和CD22,靶向这些抗原的 CAR T 细胞会消除正常 B 细胞,因此B细胞再生障碍性贫血是确定 CD19 和 CD22 CAR T 细胞治疗的疗效和持久性及其成功率的指标。这一局限性可通过设计 TME 特异性 CAR T 细胞疗法来克服(如靶向 TME 的低氧),其设计目的是将 CAR 的表达限制于驻留在低氧 TME 中的 CAR T 细胞(而非驻留于非恶性组织的非缺氧环境中的 CAR T 细胞)。靶向肿瘤特异性翻译后改变(如实体瘤过表达截短的 O-聚糖)可能是绕过该限制的另一种方法
此外,肿瘤微环境、宿主和 CAR T 细胞之间的相互作用也对 CAR T 细胞功能产生显著影响。与 T 细胞治疗相关的常见不良反应可能是迟发型、速发型、重度或轻度,或者可能在转基因 T 细胞的整个生命周期中持续存在。毒性取决于 CAR T 细胞与患者特异性蛋白的相互作用,分为两类;另一类是由 CAR T 细胞活化和细胞因子风暴生成增加所引起,细胞因子释放风暴 (CRS)、神经毒性、巨噬细胞活化综合征 (MAS) 和噬血细胞性淋巴组织细胞增生(hemophagocytic lymphohistiocytosis,HLH)是 CAR T 细胞全身细胞因子毒性的症状之一。CRS是由 CAR T 细胞的体内增殖引起的,并触发多种细胞因子的释放以及全身炎症反应,其严重程度有多个分级量表,包括 Lee 标准、美国移植和细胞治疗学会 (ASTCT)、CAR T细胞治疗相关毒性通用术语标准 (CARTOX) 和 Penn 标准。免疫效应细胞相关神经毒性综合征 (ICANS) 是 ASTCT对神经毒性的分类,困倦、精神病、脑病、共济失调、惊厥、坐立不安以及(极罕见的)脑水肿只是神经毒性的少数体征。使用10分免疫效应细胞脑病 (ICE) 等级评估ICANS 评分。
发热、低血压、感染、脑病、疲倦、心动过速和心律失常都是 brexucabtagene 的典型不良反应,大多数副作用发生在治疗的前两周内,但有些副作用可能在之后出现。
Michael Wang 教授的研究中,60名患者中有3人死于治疗相关的副作用,此外被剥夺 CAR-T 细胞治疗的患者可能在不到一年的时间内死于MCL。有必要进行更多的研究来确认患者治疗所需的平均时长。CAR T细胞的这种能力似乎是利用患者免疫系统对抗癌症的个性化疗法的另一个适应症,同时也利用了医学领域这一新的有前景的的科学突破。KTE-X19 存在细胞因子释放综合征(一种潜在致死性疾病)以及神经认知不良反应的风险,只能通过风险评估和缓解策略 (REMS) 程序获得。
泽布替尼、伊布替尼、阿可替尼和奥布替尼改变了 R/R MCL 的治疗格局,而CAR T对 BTK 抑制剂耐药的恶性肿瘤患者至关重要,这些患者的总体预后较差,甚至有部分患者在使用 BTK 抑制剂后迅速进展为更严重的疾病形式。CAR T是复发性和难治性 MCL 治疗的巨大发展,应在所有患者中进行评估。
CAR T 细胞疗法的毒性和耐药性管理
CAR T 细胞疗法取得了上述成功,但仍有较高的可能性引发多种副作用,如神经毒性、细胞因子释放综合征、on-target/off-tumor识别、插入性致癌(insertional oncogenesis)、移植物抗宿主病和速发过敏反应。与 Axicabtagene ciloleucel 一样,Brexucabtagene autoleucel也有一些不良反应,如细胞因子释放综合征和神经元毒性,但这些不良反应可控且具有自限性。为了克服系统性细胞因子毒性,研究人员引入了不同的方法,如 CAR 亚基二聚化试剂、具有小分子接头剂(small molecule adapter agents)关闭/开启相关功能的 CAR T 细胞、CAR下游信号抑制剂、使用蛋白酶抑制剂控制 CAR 蛋白表达、以及可合成因子的工程化修饰CAR T 细胞,(可以对抗细胞因子风暴,以及控制 CAR 表达)。
兔抗胸腺细胞球蛋白 (ATG) 管理神经毒性
R/R MCL 患者接受 CAR T 细胞治疗后的脑水肿可能具有致死性,而一项研究认为CAR T细胞治疗引起的脑水肿可通过包括兔抗胸腺细胞球蛋白 (ATG) 在内的多模式临床干预完全恢复。ATG 注射后,生物标志物数据显示初始和剧烈的 CAR T 细胞生长以及相关的炎性细胞因子生成,然后 CAR T 细胞和促炎性细胞因子水平迅速降低。该临床数据提供了 ATG 在治疗 CAR T 细胞引起的重度神经毒性中具有前景的信息。
工程化CAR T细胞管理毒性
为了达到治疗获益,CAR T细胞必须停留在其治疗窗内,因为超过治疗窗会导致毒性。癌细胞产生的肿瘤抗原数量、肿瘤负荷、抗原结合域与其靶表位的亲和力和 CAR 的共刺激成分均影响 CAR T 细胞的活化率。为了最大化治疗效果并降低毒性,谨慎分析 CAR 的许多模块化组件至关重要。预期随着抗原结合域亲和力的降低,肿瘤细胞上需要更大的抗原密度才能达到显著的活化水平。与低纳摩尔/亚纳摩尔亲和力的抗原结合结构域相比,具有微摩尔亲和力的抗原结合结构域对靶抗原表达水平更高的癌症的选择性更高。通过改变活化 CAR T 细胞的铰链和跨膜区域,也可以控制细胞因子的产生。CD8α衍生的跨膜氨基酸序列和铰链的改变可减少 CD19 靶向 CAR 中的细胞因子释放和 CAR T 细胞增殖。CAR 设计中另一个可定制的领域是共刺激结构域,例如通过使用不太发达的 T 细胞亚群或设计带有 4-1BB 配体的 CAR T 细胞,为 CAR-T 细胞创造支持性环境,可以提高 CAR T 细胞的体内疗效。通过克服实体瘤的物理障碍和抗原异质性,也可以改善 CAR T 细胞浸润实体瘤。
CAR免疫原性的管理
传统化疗药物的一般毒性可以通过修饰免疫细胞识别其靶点而下降,而CAR T 细胞中的药物免疫抑制、靶向活化和一些消除基因的表达是最小化 CAR T 细胞治疗不良反应的一些常见操作。使用人或人源化抗体片段代替鼠源性 CAR 降低 CAR 免疫原性可能有帮助,因为宿主免疫系统检测 CAR 结构可促进细胞因子相关毒性。
通过修饰CAR转导T细胞来管理神经毒性
骨髓细胞和细胞因子似乎在 CAR T 细胞诱导的神经毒性中发挥重要作用,因为≥3级神经毒性患者的CD14 + 细胞大幅增加。根据一项大 B 细胞淋巴瘤 CAR T 细胞关键研究,GMCSF增加是与≥3级神经毒性发生密切相关的血液生物标志物。在临床前研究中,Lenzilumab可抑制巨噬细胞和单核细胞活化细胞因子粒细胞-巨噬细胞集落刺激因子 (GMCSF),从而减少神经毒性和 CRS以及增加 CAR T 细胞活化。在 CAR 转导的 T 细胞中,GM-CSF突变失活似乎产生相似的结果。表明 GM-CSF 中和有助于降低神经毒性和CRS。此外,当酪氨酸羟化酶以骨髓细胞特有的方式缺失或该酶被酪氨酸抑制时,儿茶酚胺和细胞因子水平会降低。此外,根据临床前研究,当使用 IL-1 受体拮抗剂时,白血病/淋巴瘤动物模型 CD19 CAR 治疗的神经炎症减少。
CAR的自杀基因策略
自杀基因或“关闭”技术可通过使用继发诱导因子,从而更容易在不利事件开始发生时便选择性地减少工程细胞。例如设计用于表达全长 CD20 或 CD20 模拟表位的 CAR 可通过使用利妥昔单抗帮助消除 CAR-T 细胞。这些治疗方法或与它们相当的治疗方法的主要缺点在于,虽然它们是确保安全性所必需的,但它们的使用会突然结束(对一种正在迅速发展的疾病的)治疗。不管怎么说,这种限制为开发安全性增强技术(保留自杀基因激活作为最后选择)提供了巨大动力。
为了增加结果并超越 CAR T 细胞的限制,必须从患者识别到分离、产生、增殖和注射 CAR T 细胞做出积极而正确的努力。为避免 CAR T 细胞治疗限制或失败,在整个治疗期间监测 CAR T 细胞有效性和抗原丢失至关重要。海英改进传统 CAR-T 细胞设计,以克服该疗法的不足或不良反应。为了评估 KTE-X19 的长期保护作用,FDA强制要求该生产公司对接受 KTE-X19 治疗的患者启动药物警戒调查研究。由于成本和劳动力要求较高,研究开始关注异基因CAR T 输注,它们目前在临床开发的不同阶段。CAR T 细胞的输注通常是阻碍进一步进展并导致细胞毒性的问题。然而CAR T细胞治疗方式仍相对较新,CAR T细胞治疗的广泛应用无疑将面临科学知识的众多挑战,才能广泛使用。
总结
MCL 是一种病理学上独特的影响生命的疾病,需要创新的治疗方法,幸运的是CAR-T细胞方法和细胞免疫治疗的发展开辟了一个治疗选择的新世界。研究人员正在研究 CAR T 细胞治疗不同类型的肿瘤,但目前最成功的 CAR T 细胞治疗均为血液肿瘤。大多数 CAR T 细胞治疗都存在发生严重副作用的可能性,必须由精通该程序的医疗专业人员迅速谨慎地处理。此外患者和医疗保健提供者也有不同的后勤和财务挑战。CAR T 细胞疗法导致的重度毒性,如细胞因子风暴、巨噬细胞活化综合征、神经毒性和HLH,也是不可避免的障碍。为了将这些事件降至最低,研究人员正致力于通过更安全的抗原选择来增加 CAR 的选择性,或改变抗体单链可变片段的敏感性来实现 CAR T 细胞治疗的安全性,也可以通过组合抗原靶点和掩盖CAR,或通过引入自杀基因并限制 CAR 表达来控制 CAR T 细胞活性。
Brexu-cel治疗美国R/R MCL的真实世界结局,所有患者的 ORR 为84%,随访少于180天的患者的 ORR 为78%。6个月OS和 PFS 率分别为79%和66%。接受托珠单抗和皮质类固醇后,≥3级CRS(9%) 和 ICANS(29%) 在开始治疗后21天大部分消退。32%的患者发生获得性重度感染,22%的患者发生慢性血细胞减少,3%的患者随后发生恶性肿瘤。这是关于 brexu-cel 应用的最全面的报告,表明 CAR T 细胞治疗MCL(包括具有高危特征的MCL)获得成功,但重度毒性需要进一步研究。
尽管MCL 治疗仍需进一步的研究,但这些试验有望带来淋巴瘤治疗的新药,并为晚期肿瘤患者提供更好的治愈方法。这些研究将为研究不同类型的淋巴瘤铺平道路,改变这些以前难以治疗的患者的生活。
参考文献
Zoufang Huang,et al. CAR T-Cell therapy for the management of mantle cell lymphoma.Mol Cancer . 2023 Mar 31;22(1):67. doi: 10.1186/s12943-023-01755-5.


