【AJH】CAR-HEMATOTOX评分在CAR T治疗R/R MCL中的预后价值
时间:2023-08-24 13:43:16 热度:37.1℃ 作者:网络
CAR-HEMATOTOX评分
CAR T 细胞治疗复发或难治性套细胞淋巴瘤(R/R MCL),相当数量的患者可获得长期缓解,但 CAR T 细胞也伴随着一系列独特的副作用,包括细胞因子释放综合征 (CRS) 和免疫效应细胞相关神经毒性综合征 (ICANS)。然而其最常见的≥3级副作用是血液学毒性,可能表现为严重和/或持久的血细胞减少,且持续的细胞免疫抑制易引起严重的感染并发症,事实上致死性感染现在是非复发死亡率 (NRM) 的驱动决定因素,主要是由于 CRS 和 ICANS 的管理取得进展(例如托珠单抗、anakinra和早期糖皮质激素)。
CAR-HEMATOTOX(HT) 评分可确定R/R大 B 细胞淋巴瘤 (LBCL) 和多发性骨髓瘤(MM)患者中 CAR T 相关血液毒性的高风险患者,并对严重感染和不良治疗结局进行风险分层。
Brexucabtagene autoleucel (brexu-cel)给药后血细胞减少和感染性并发症的真实世界报告仍很少,尚未进行概述血细胞减少数量和质量的详细分析,也未在R/R MCL患者中验证血液学毒性、感染和生存结局的早期风险分层系统。因此,德国LMU大学医院Kai Rejeski教授牵头一项多中心观察性研究,旨在广泛描述大型多中心队列中brexu-cel治疗R/R MCL的毒性和生存期特征,以及HT评分对这些结局的影响。研究结果近日发表于《American Journal of Hematology》。

研究结果
患者特征和分布
纳入2015年12月至2022年7月在8家国际CAR T中心接受brexu-cel治疗的所有R/R MCL患者,并在103例患者中评估了毒性、临床特征和生存结局。https://www.german-lymphoma-alliance.de/Scores.html在线计算HT评分。
中位随访15.4个月。中位年龄为66岁,中位 ECOG 体能状态 (PS) 为1。患者接受的既往治疗线中位数为3,包括32%既往自体干细胞移植 (ASCT)、41%既往苯达莫司汀治疗和CAR T 输注前6个月内16%有苯达莫司汀暴露。大多数患者接受了桥接治疗 (79%)。在疾病特征方面,41例患者 (40%) 为母细胞样或多形性组织学,77例患者 (75%) 显示中危或高危sMIPI评分。在可评估患者中,78%的患者 Ki-67% 增殖指数升高 (≥30%),而42%的患者有 TP53 改变(alteration)。37%的患者存在骨髓 (BM) 受累,5例存在CNS受累。
103例中包括56例HTlow(评分0-1)和47例HThigh(评分2-7)患者,中位 HT 评分为1。两个风险组在基线ECOG、年龄/性别/人种分布、地理区域、肾功能、桥接治疗的使用和既往异基因或自体 SCT 方面无差异,但中或高 sMIPI 评分的患者HThigh比例增加(86% vs. 66%,p = .04),以及Ki-67增殖指数升高(88% vs. 69%,p=0.04)和不良风险母细胞样或多形性组织学中(51% vs. 30%,p=0.04)。在可评估患者中,HThigh与 HTlow患者的复杂核型无显著差异(50% vs. 24%,p=0.065),此外,高危组在 CAR T 末次活检时更常观察到BM浸润(49% vs. 27%,p=0.025),且清淋时血清 LDH 水平较高(中位数255 vs. 207 U/L,p=002)。由于评分的组成,HThigh组的血清炎症标志物CRP(中位数3.1 mg/dL)和铁蛋白(中位数324 ng/mL)水平较高;患者还表现出显著的基线血细胞减少,中位血红蛋白为10.1 g/dL,中位血小板计数为101 g/L,中位 ANC 为1640/μL。
早期和晚期血细胞减少的总体发生率和中性粒细胞恢复质量
队列中血液学毒性的总体发生率较高。重度中性粒细胞减少 (ANC<500/μL) 的中位持续时间为8天,高达91例患者 (88%) 在 brexu-cel 输注后30天内计数降至该阈值以下。61例患者 (59%) 的重度中性粒细胞减少持续≥7天(表1)。此外,28例患者 (27%) 在第+31至 +100天期间发生重度中性粒细胞减少。66例患者 (64%)在前100天内发生严重中性粒细胞减少 (ANC<100/μL),包括26%的长期、严重中性粒细胞减少(ANC<100/μL,持续≥7天)患者——该风险类别与疾病和肿瘤治疗中的感染并发症密切相关。此外,48例患者 (47%) 发生长期中性粒细胞减少,定义为第+21天后ANC<1000/μL。中性粒细胞恢复表型的分布为快速型(quick)41%、间歇型(intermittent)38%和再生障碍型(aplastic)21%。分别有57%和51%的患者发生重度血小板减少(血小板计数<50g/L)和贫血(Hb<8g/dL或需要输注浓缩红细胞 [pRBC]);在前30天内,34%和41%的患者应用了血小板和 pRBC 输注。58例患者 (56%) 在中位14天后接受了 G-CSF 的生长因子支持。8例患者应用血小板生成素 (TPO) 激动剂。仅1例患者接受了自体干细胞增强(autologous stem cell boost)。

CAR-HEMATOTOX评分可识别存在重度血液毒性和输血依赖风险的患者
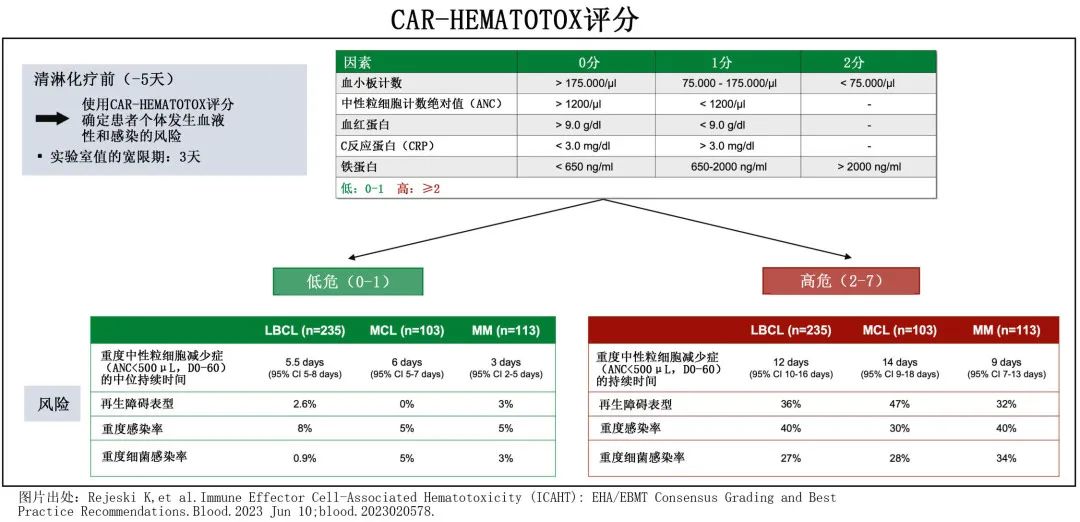
比较 HT 评分风险组时发现,HThigh患者更常表现出中性粒细胞恢复的再生障碍性表型,而在 HTlow 组中未观察到该表型(47% vs. 0%,p<0.0001,图1A)。此外,在多变量二元逻辑回归分析中,HT评分是中性粒细胞恢复再生障碍性表型的独立风险因素(校正比值比 [aOR]=33.0)。清淋时的血清 LDH 水平也与再生障碍性表型独立相关 (aOR=3.5);而CRS或 ICANS 分级、年龄、桥接治疗的使用、既往 ASCT 和 CAR T 输注前最后6个月内使用苯达莫司汀与再生障碍表型均无关。HThigh患者重度中性粒细胞减少的中位持续时间显著更长(14天vs.6天,p<0.0001,图1B)。与该发现一致,单变量分析发现HT 评分与重度中性粒细胞减少持续时间呈显著正相关(r=+0.58,p<0.0001,β1=4.96;图1C)。ROC 分析证实了 HT 评分对既往验证终点(重度中性粒细胞减少≥14天)的区分能力(AUC=0.84,p<0.0001,灵敏度=93%,特异性=70%;图1D)。
在所有血细胞减少类别中,HThigh组的血液毒性发生率均较高(表1)。例如,81%的 HThigh患者和41%的 HTlow患者中发生长期重度中性粒细胞减少 (p<0.0001),HThigh组中的长期严重中性粒细胞减少明显更频繁(43% vs. 13%,p=0.0007),发生长期中性粒细胞减少的患者比例也更高(66% vs. 30%,p=0.0004)。最后,HThigh组的早期(直至第+30天)和晚期(第+31天至第+100天)重度血小板减少和贫血发生率均较高,因此在 brexu-cel 给药后30天内和31-100天之间,HThigh组对血小板(55% vs. 16%,p<0.0001和40% vs. 4%,p<0.0001)和pRBC(53% vs. 30%,p=0.027和40% vs. 9%,p=0.0003)的输血需求均增加。HThigh组更常需要 G-CSF 支持(70% vs. 45%,p=0.01),TPO激动剂使用也有增加的数值趋势 (13% vs. 4%)。对1例 HThigh患者进行干细胞增强(CD34+选择自体产物,第+59天),该患者随后显示计数恢复,并在3个月随访时完全缓解。
CAR-HEMATOTOX评分和改良EASIX评分均与CRS或ICANS的严重程度无关
重度(≥3级)CRS和 ICANS 的发生率分别为6%和25%;大多数患者 (83%) 为轻度至中度CRS(1-2级),而11例患者 (11%) 无CRS。对于ICANS,38例 (37%) 为轻中度表现(1-2级),而39例 (38%) 无ICANS。在毒性管理方面,托珠单抗和皮质类固醇的使用率分别为80%和63%,9例应用抗白细胞介素-1受体拮抗剂anakinra,11例患者需要在ICU接受治疗。HT 评分未观察到 CRS 或 ICANS 严重程度的统计学显著差异。还计算了清淋时的改良 EASIX 评分(与R/R LBCL 患者的 CRS/ICANS 严重程度相关),但在本队列中,改良EASIX评分无法区分CRS或ICANS的严重程度。HT 高危组与低危组的中位住院时间相当(均为18天,p=0.7)。
brexu-cel治疗后感染的发生率和风险因素
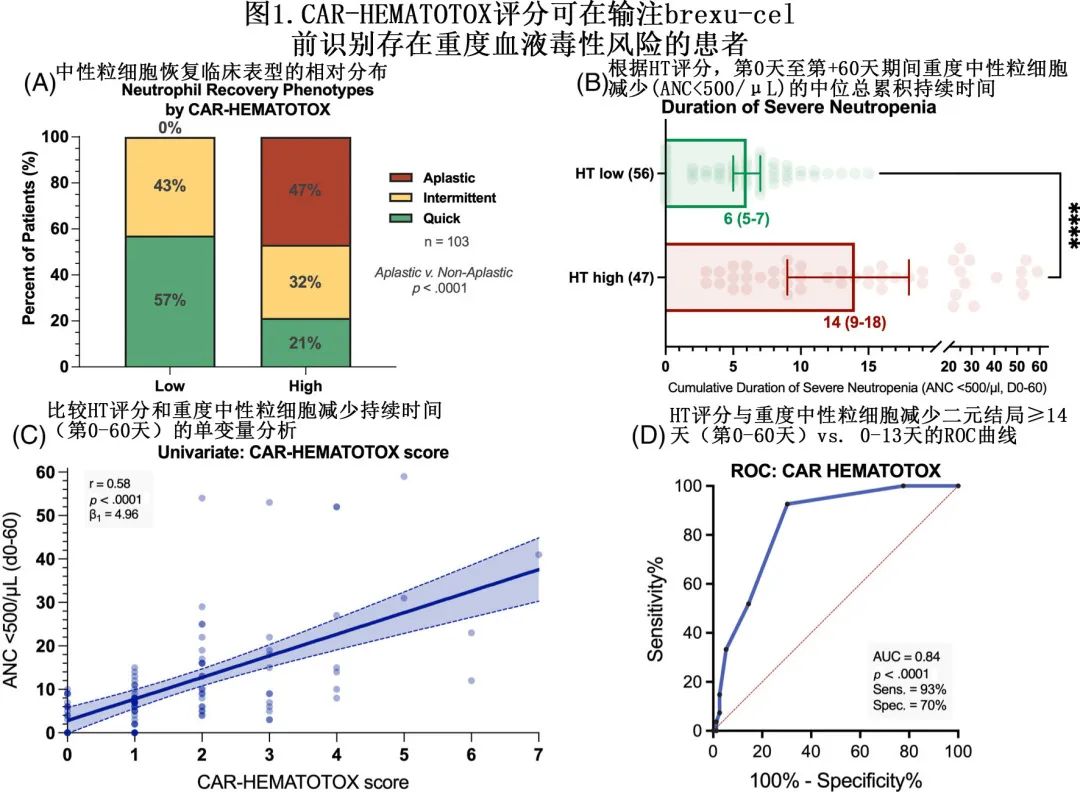
分析了 brexu-cel 输注后前90天内发生的早期感染。34例患者 (33%) 报告总计50起感染事件,血流感染是最常见的感染源 (40%),其次是下呼吸道感染 (24%) 和胃肠道感染 (16%)(图2A)。17例患者 (15%) 发生重度感染。单变量分析的风险因素包括 HT 评分、年龄、ECOG PS、sMIPI评分、再生障碍表型、CRS/ICANS严重程度和使用皮质类固醇。清淋时 CAR T 前因素的多变量分析表明,仅HT评分是重度感染的独立风险因素 (aOR=6.5);在 CAR T 后因素中,再生障碍性表型是重度感染的唯一独立不良风险因素 (aOR=5.5)。
CAR-HEMATOTOX评分与重度感染并发症(非复发死亡的最常见原因)相关
HThigh组任何级别感染的发生率高于HTlow组(43% vs. 25%,p=0.09),尤其是重度感染(30% vs. 5%,p=0.001)(图2B);且在细菌感染中尤其明显,包括所有级别感染(34% vs. 14%,p=0.02)和重度感染(28% vs. 5%,p=0.002)(图2C)。前90天内 HTlow组未观察到致死性感染,但HThigh组发生3例感染导致的死亡:1例在brexu-cel 输注后第+76天致死性真菌感染以及2例致死性细菌感染(第+22天、+40天)。仅2例患者因感染发作再次入院( HThigh组和HTlow组各一),住院时间均为5天。重要的是,HThigh患者中所有级别感染,尤其是重度感染的累积90天发生率更高(图2D,E)。感染亚型(细菌vs.病毒vs.真菌)分析显示,HT评分可识别有细菌感染风险的患者(图2F–H)。
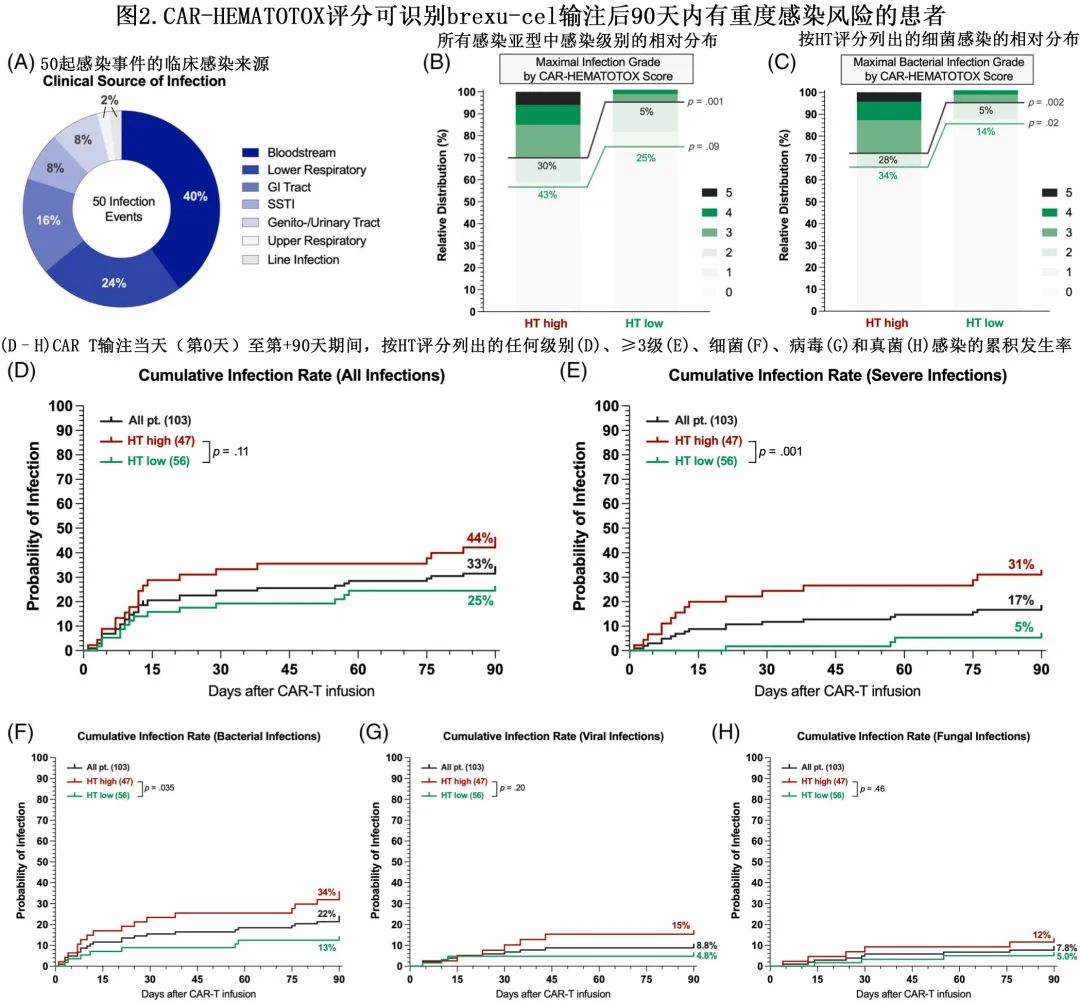
9例患者在末次随访时发生NRM:7例死亡归因于感染,1例归因于重度CRS,1例归因于一般失调。感染相关死亡归因于3例 Covid-19 感染、3例细菌感染和1例真菌感染。3例病毒感染均发生于 brexu-cel 输注后+177天至+349天的 B 细胞再生障碍性贫血背景下(2例HTlow,1例 HThigh 患者)。在 CAR T 后第一年,24例患者死于淋巴瘤进展。整个研究队列中估计的1年 NRM 率为10.4%,且HThigh患者明显高于HTlow(17.3% vs. 4.6%,p=0.04,图3A)。
CAR-HEMATOTOX评分对治疗反应和生存期的影响
根据 Lugano 标准评估可102例患者截至第90天的最佳总缓解率 (ORR)。ORR 为93%,而完全缓解 (CR) 率为81%(图3B)。中位随访15.4个月,中位 PFS 为25.2个月,未达到中位OS;1年 PFS 率为67%,1年 OS 率为80%。低 HT 评分与 ORR 显著改善(100% vs. 85%,p=0.003)和更优的 CR 率(93% vs. 68%,p=0.002)相关(图3B)。比较 HT 风险组可发现,HThigh组PFS(中位PFS 9.2 vs.未达到;p<0.0001;图3C)和OS(中位OS 25.6个月vs.未达到;p<0.0001;图3D)显著较差;HTlow组的1年 PFS 和 OS 率极佳,分别为82%和94%,而HThigh组的1年 PFS 和 OS 率分别为49%和65%。
HT评分≥4分的患者具有不良生存结局,这些超高危患者的生存期不佳,中位 PFS 仅为3个月(图3E),中位 OS 为10个月(图3F)。
在校正了其他 CAR T 前因素的多变量 Cox 比例风险模型中,HT评分是 PFS(校正风险比 [aHR]=3.7;p<0.001)和OS(aHR=5.6;p=0.002)较差的独立预测因素。sMIPI 评分是PFS的另一个独立的治疗前不良风险因素(aHR=1.8;p=0.05),对于OS仅有一定趋势(aHR=2.2;p=0.06)。虽然在单变量分析中,血清 LDH 水平大于正常上限会增加PFS(HRPFS 2.8) 和OS(HROS 2.9) 较差的风险,但在多变量分析中未观察到统计学显著性。
研究CAR T给药后的风险因素可发现,再生障碍性中性粒细胞恢复(aHR=2.1;p=0.05)和重度感染(aHR=2.3,p=0.06)与多变量分析中 PFS 较差相关,而应用皮质类固醇与 PFS(aHR=0.4;p=0.02)和OS(aHR=0.3;p=0.015)改善独立相关。
总结
该多中心观察性研究描述了103例接受 brexu-cel 的R/R MCL 患者的血细胞减少和感染,还报告了基线 CAR-HEMATOTOX(HT) 评分与毒性事件、非复发死亡率 (NRM) 和PFS/OS之间的相关性。清淋时56例患者为HTlow(评分0-1),而47例患者为HThigh(评分≥2)。HTlow队列显示中性粒细胞减少时间延长(中位数14天vs. 6天,p<0.001)和重度感染率增加(30% vs. 5%,p=0.001)。总体患者的1年 NRM 为10.4%,主要归因于感染,且不同基线 HT 评分有所不同(高与低:17% vs 4.6%,p=0.04)。HThigh患者的90天完全缓解率(68% vs. 93%,p=0.002)、PFS(中位9个月vs.未达到,p<0.0001)和OS(中位26个月vs.未达到,p<0.0001)均较差。多变量分析显示,高 HT 评分与严重血液毒性、感染和较差PFS/OS均独立相关。
总之,感染和血液毒性在 brexu-cel 给药后很常见,并导致NRM。HT 评分能够在 brexu-cel 输注前将 MCL 患者早期风险分层为长期中性粒细胞减少、重度感染和不良生存结局的高危与低危。该评分将使个体化的毒性管理策略成为可能,避免低危候选者的过度治疗,同时减轻高危患者的毒性后遗症。最后,该评分有助于患者选择,并有助于确定需要进一步治疗优化的超高危候选者。
参考文献
Rejeski K, et al. The CAR-HEMATOTOX score identifies patients at high risk for hematological toxicity, infectious complications, and poor treatment outcomes following brexucabtagene autoleucel for relapsed or refractory MCL.Am J Hematol . 2023 Aug 16. doi: 10.1002/ajh.27056.


