Adv Sci:徐美东教授团队发现TAOK3在食管癌耐药中起关键性作用
时间:2023-10-15 08:32:31 热度:37.1℃ 作者:网络
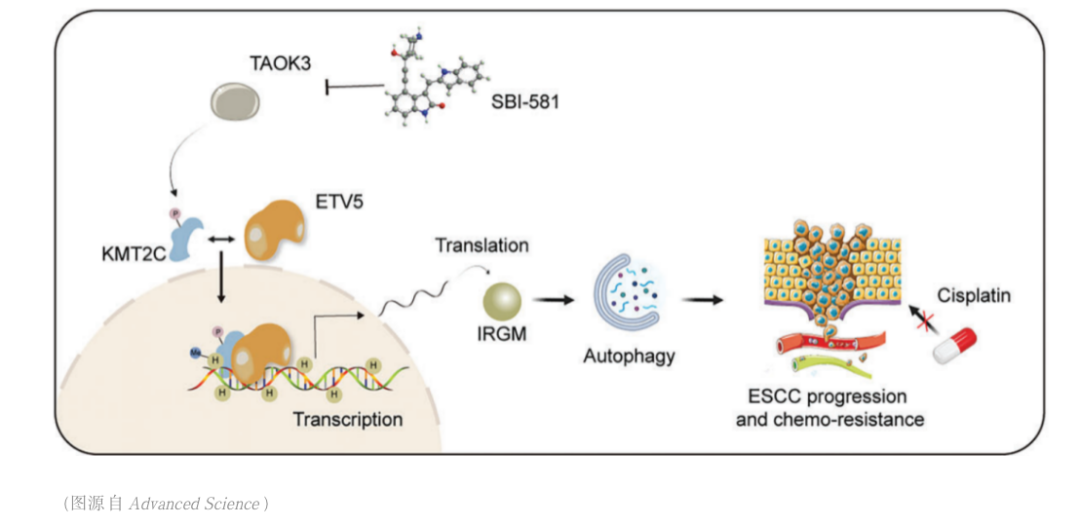
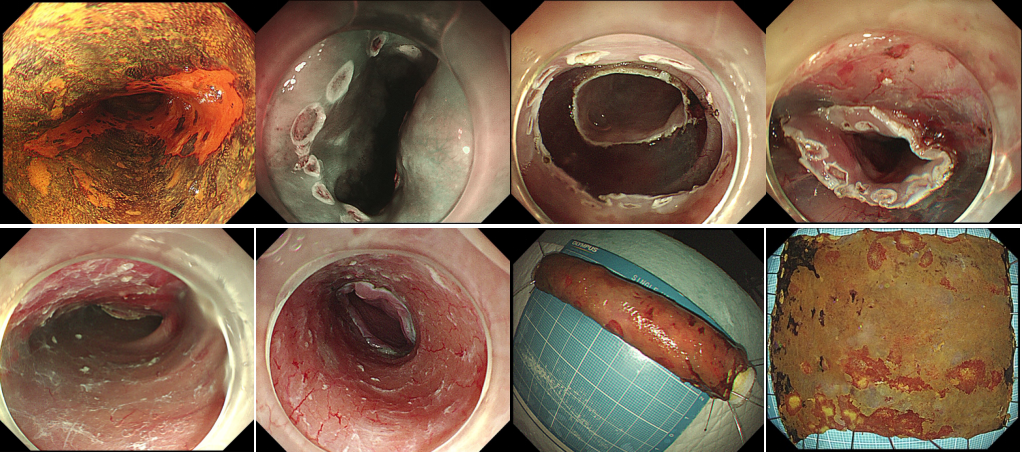
食管癌是消化道领域最常见的恶性肿瘤之一,中国是食管癌高发国家,每年新发病例数约占全球的53.7%,死亡病例数约占全球的55.7%。我们国家的主要亚型是食管鳞状细胞癌。近年来,随着人们内镜筛查意识的提高,以及消化内镜诊疗技术的飞速发展,食管鳞癌可在早期且毫无症状胃镜体检筛查时被发现,更可由内镜医生通过内镜黏膜下剥离术(ESD)微创实现食管早癌治愈性切除,切除后患者的生存质量不受影响,食管鳞癌的诊治模式已被悄然改变。然而,不幸的是,仍有相当部分进展期食管癌患者发现较晚,但食管鳞癌进展机制尚未完全明了,此外,尽管ESD技术切除食管早癌已相当成熟,但术后常见并棘手的并发症--食管狭窄,却将部分大面积病变患者拒于微创大门之外;为让更多的早期患者获益于微创诊疗,以及让更多的进展期患者追求更好的治疗效果,同济大学徐美东教授和团队一直致力食管癌ESD术后狭窄的防治方法以及寻找食管鳞癌的进展机制的探索之路。最近,喜讯频传,团队研究成果不断获得新的进展。 2023年9月13日,徐美东教授和团队在Advanced Science(IF=15.1)上在线发表题为TAOK3 facilitates esophageal squamous cell carcinoma progression and cisplatin resistance through augmenting autophagy mediated by IRGM的原创性研究论文[1],这一研究揭示了STE20蛋白激酶家族中重要成员TAOK3可以通过对组蛋白甲基转移酶KMT2C的S4588磷酸化修饰,促进组蛋白甲基转移酶KMT2C与转录因子ETV5的结合和核转位,从而影响下游分子IRGM的转录和表达,影响肿瘤细胞的自噬水平。同时,我们还发现TAOK3的特异性抑制剂SBI-581可以显著地降低食管鳞癌细胞的自噬水平,减少鳞癌细胞对化疗药物顺铂的抵抗,为进展期ESCC患者找寻新的药物靶标提供证据。 细胞自噬是诸多恶性肿瘤进展和化疗耐药的核心机制之一。自噬可以降解和消化受损和变性的细胞器、蛋白质与核酸等生物大分子,为细胞的再生和修复提供原料,实现细胞内物质的循环利用。在这个过程中蛋白激酶往往发挥重要的捕捉信号和传递信号的作用。在本研究中,我们发现TAO激酶家族中只有TAOK3在食管鳞癌中是显著高表达,且与肿瘤分期、转移以及患者的预后呈显著正相关;通过MDC染色、共聚焦显微镜观察LC3蛋白改变以及透射电镜观察自噬小体发现只有TAOK3可以显著增强ESCC细胞的自噬水平;体外实验发现TAOK3可以显著减少ESCC细胞的调亡水平,降低肿瘤细胞对于顺铂药物的敏感性。机制方面,发现KMT2C分别直接与TAOK3和ETV5结合,且TAOK3可以使KMT2C发生S4588位磷酸化,从而显著影响KMT2C与转录因子ETV5的结合,继而影响KMT2C的入核。KMT2C与转录因子结合入核增加后可以显著增强免疫相关GTP酶M(IRGM)基因启动子区H3K4的三甲基化水平,从而使IRGM的转录和表达水平增高。除了和固有免疫相关,IRGM目前更多地被发现可以在多种疾病中调控细胞自噬。 SBI-581是TAOK3的特异性抑制剂,通过结合TAOK3激酶结构域抑制蛋白激酶的活性。该研究进一步证实了SBI-581显著抑制TAOK3在食管鳞癌中的作用,发现SBI-581通过抑制TAOK3对KMT2C的S4588位点磷酸化最终减少KMT2C的入核和IRGM的表达。并且,本研究还首次发现SBI-581可以提高顺铂药物对肿瘤的治疗效果,成为潜在新的药物靶标,有望在临床上帮助对铂类化疗药物抵抗的食管鳞癌患者。 另外,2023年3月,徐美东教授和团队在Journal of Experimental & Clinical Cancer Research(IF=11.2)上发表题为Targeting IGF1R signaling enhances the sensitivity of cisplatin by inhibiting proline and arginine metabolism in oesophageal squamous cell carcinoma under hypoxia”的文章[2],该研究通过整合代谢组学和基因组分析发现食管鳞癌中代谢酶精氨酸琥珀酸合成酶1(ASS1)和吡咯烷-5-羧酸还原酶1(PYCR1)呈特征性的高表达,并且与肿瘤分期以及患者预后相关;功能上这两个关键酶的异常表达增强精氨酸/脯氨酸代谢,维持氧化还原平衡,并为生物合成提供前体,有助于代谢适应和食管鳞癌细胞在缺氧的微环境下生长;机制上,ASS1和PYCR1在食管鳞癌细胞中的表达与IGF1R一致,而缺氧也可以以时间依赖性的方式刺激这两种酶的表达;进一步研究发现IGF1R通路通过c-MYC的转录活性促进代谢酶表达,具体而言,ASS1的高表达促进精氨酸代谢以进行生物合成代谢,而PYCR1则激活脯氨酸代谢以维持氧化还原平衡。最终,异常的信号转导结合代谢重编程导致顺铂的耐药性。本研究揭示了靶向相关代谢途径可能改善顺铂在食管鳞癌中的治疗效果,可能是一种更有效的化疗新策略。 除了从分子机制研究食管癌外,2023年1月,同济大学附属东方医院徐美东教授和团队在Surgical Endoscopy上发表题为“Outcome of a novel self-control stricture-preventing water balloon for complete circular esophageal endoscopic submucosal dissection”的临床研究[3],该研究介绍了食管早癌患者环周ESD术后食管狭窄的有效预防方法—自控式防狭窄水囊导管装置的置入。这种新型自控式防狭窄水囊装置由徐美东教授发明,原理是通过水囊充盈的支撑扩张力,防止创面愈合过程中的疤痕挛缩,从而预防狭窄,已获发明专利授权(专号:CN211584837U)。该装置操作简单:ESD术后第4-5天医生在内镜下将自控水囊放至创面处,出院后患者在家自行操作,注水充盈水囊发挥预防作用,如需进餐则将水抽出,不影响进食。整个疗程平均约8-12周时间。研究中纳入了37例食管环周早癌行ESD的患者,长径为4-14cm(中位值7cm),所有患者术后均采用基于口服糖皮质激素的自控式防狭窄水囊置入治疗,随访期间中只有3例(8.1%)患者出现ESD术后狭窄,而食管环周ESD如无预防措施狭窄发生率为100%。本研究结果显示:在口服糖皮质激素治疗的基础上,置入自控式防狭窄水囊装置可以安全有效地预防食管环周早癌患者ESD术后的狭窄。 目前,本中心每年诊治来自全国各地的食管早癌高达数百例,是国内ESD治疗食管早癌最多的中心之一,且随着食管狭窄防治新方法的发明,越来越多的环周食管早癌患者在我中心得以经ESD方法成功治愈。为进一步探索新方法的疗效,目前我们已着手开展随机对照临床研究。同时,团队仍在探索食管鳞癌机制研究上不断努力,争取有更多突破,为我国食管癌诊治领域添砖加瓦。 图:环周食管早癌ESD治疗过程 图:水囊放置12周取出后,食管腔无狭窄 参考文献 [1] Sun M, Li Z, Wang X, Zhao M, Chu Y, Zhang Z, Fang K, Zhao Z, Feng A, Leng Z, Shi J, Zhang L, Chen T*, Xu M*. TAOK3 Facilitates Esophageal Squamous Cell Carcinoma Progression and Cisplatin Resistance Through Augmenting Autophagy Mediated by IRGM. Adv Sci (Weinh). 2023 Sep 13:e2300864. doi: 10.1002/advs.202300864. Epub ahead of print. PMID: 37705061 [2] Fang K, Sun M, Leng Z, Chu Y, Zhao Z, Li Z, Zhang Y, Xu A, Zhang Z, Zhang L, Chen T*, Xu M*. Targeting IGF1R signaling enhances the sensitivity of cisplatin by inhibiting proline and arginine metabolism in oesophageal squamous cell carcinoma under hypoxia. J Exp Clin Cancer Res. 2023 Mar 28;42(1):73. doi: 10.1186/s13046-023-02623-2. [3] Lian J, Chu Y, Chen T, Li F, Xu A , Zhang H, Xu M*. Outcome of a novel self‑control stricture‑preventing water balloon for complete circular esophageal endoscopic submucosal dissection. Surgical Endoscopy, 2023 Jan;37(1):290-297.