Cell Discovery:王福俤/闵军霞团队发现“神药”二甲双胍的严重肾脏副作用作用机制
时间:2023-10-18 14:32:44 热度:37.1℃ 作者:网络
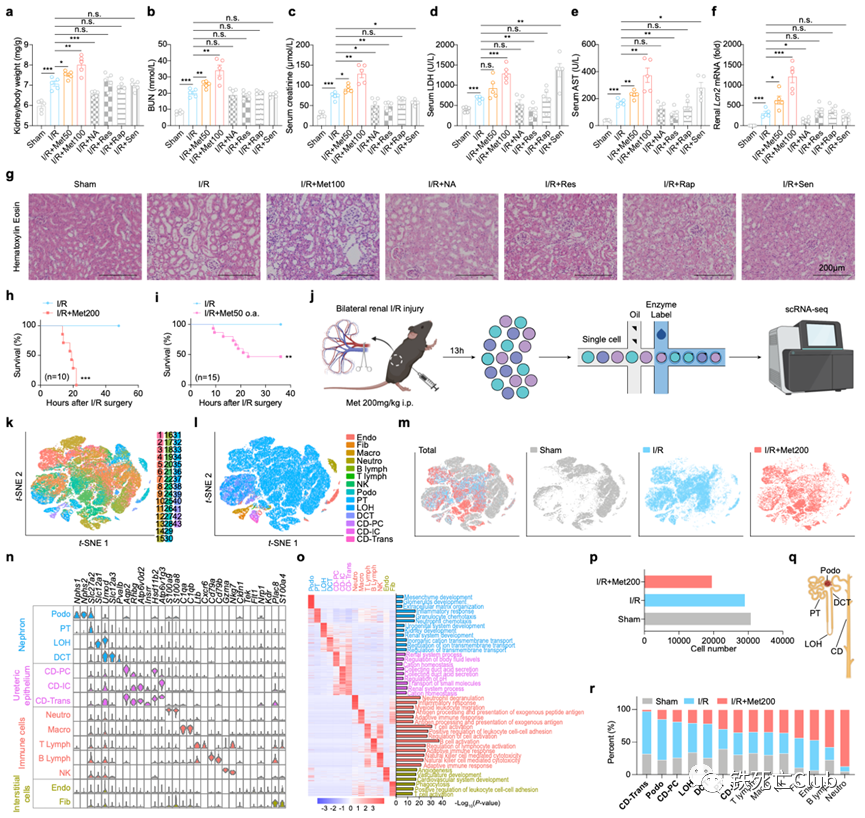
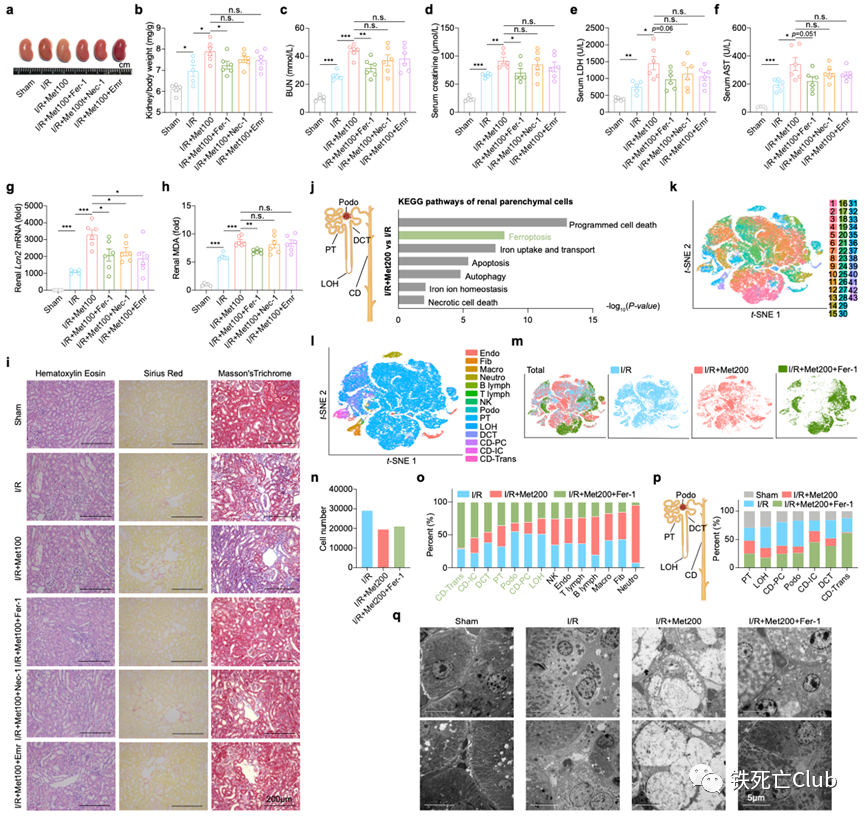
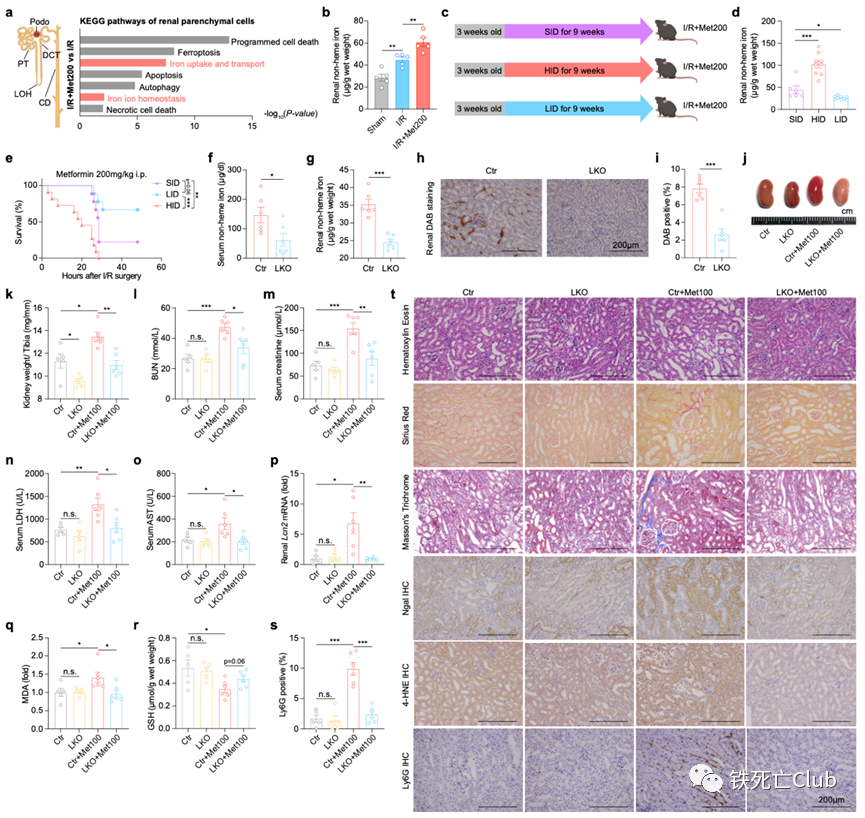
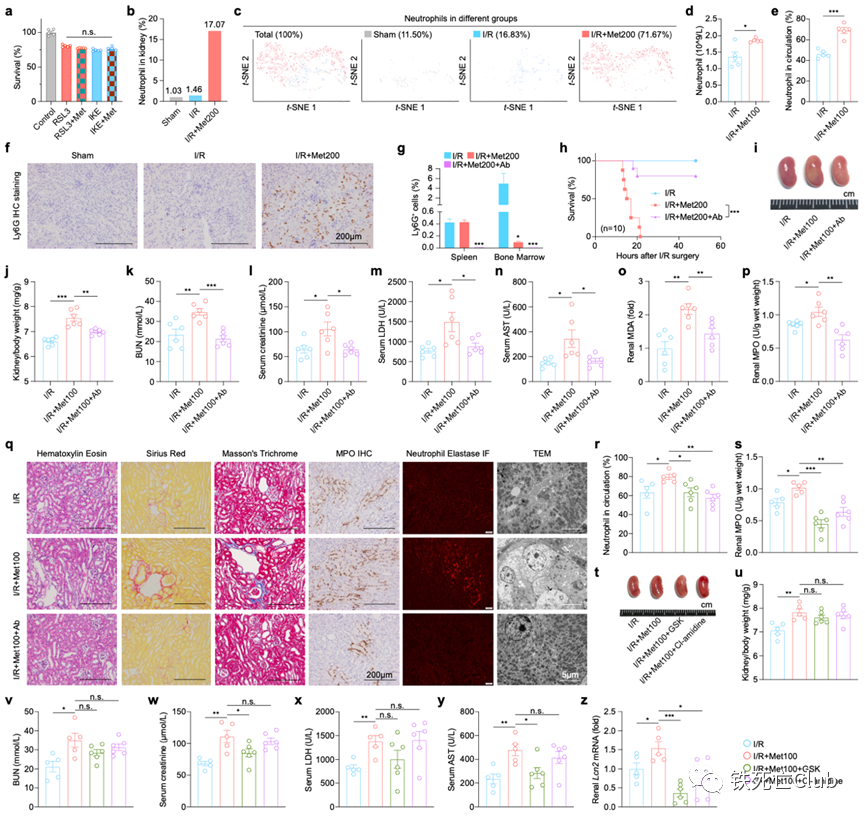
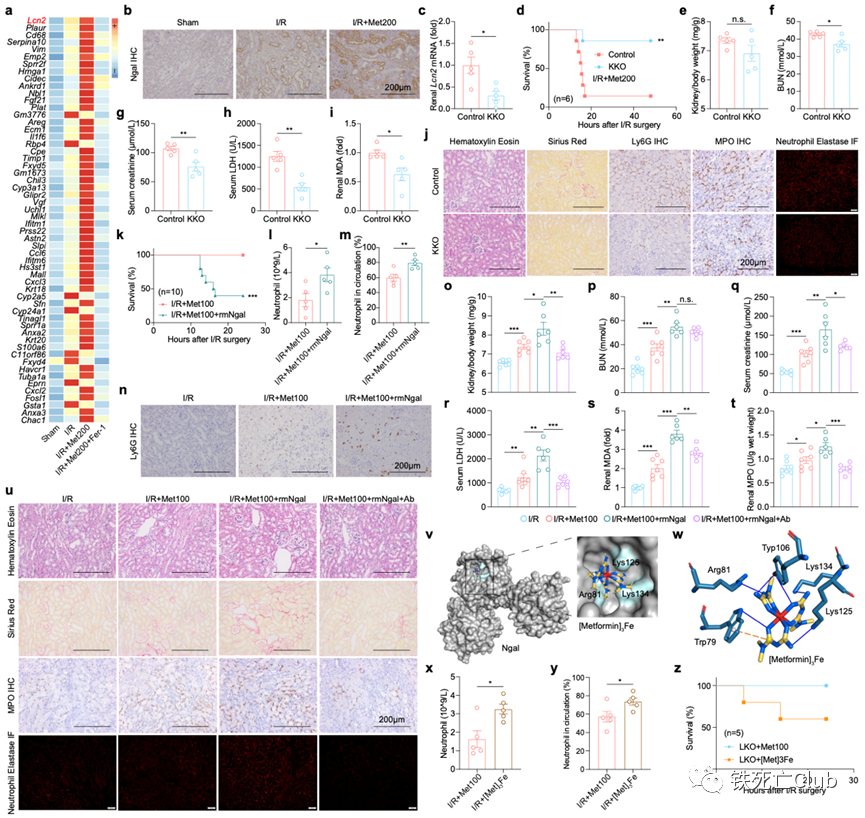
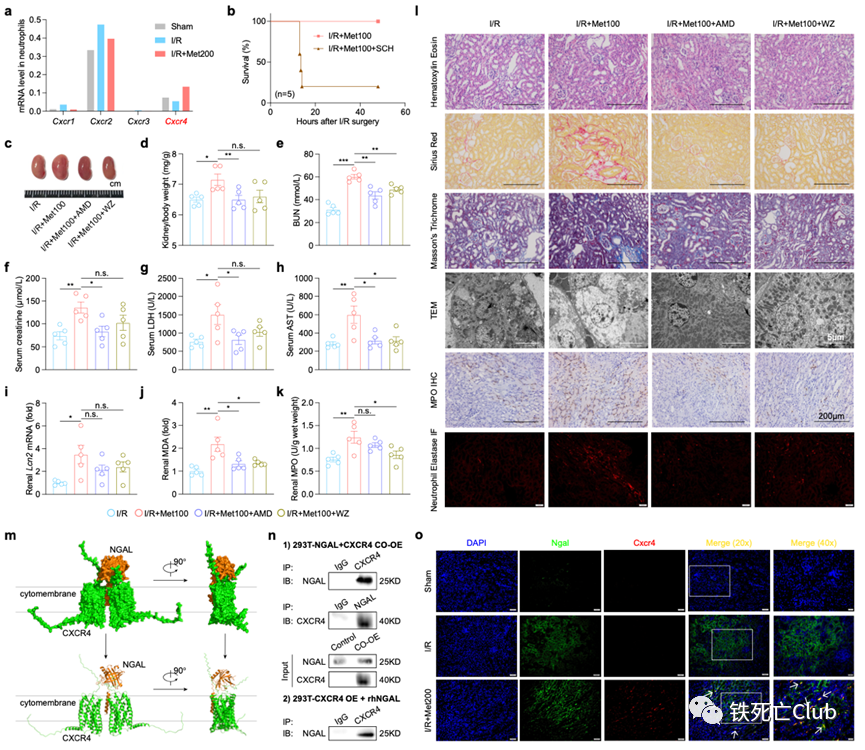
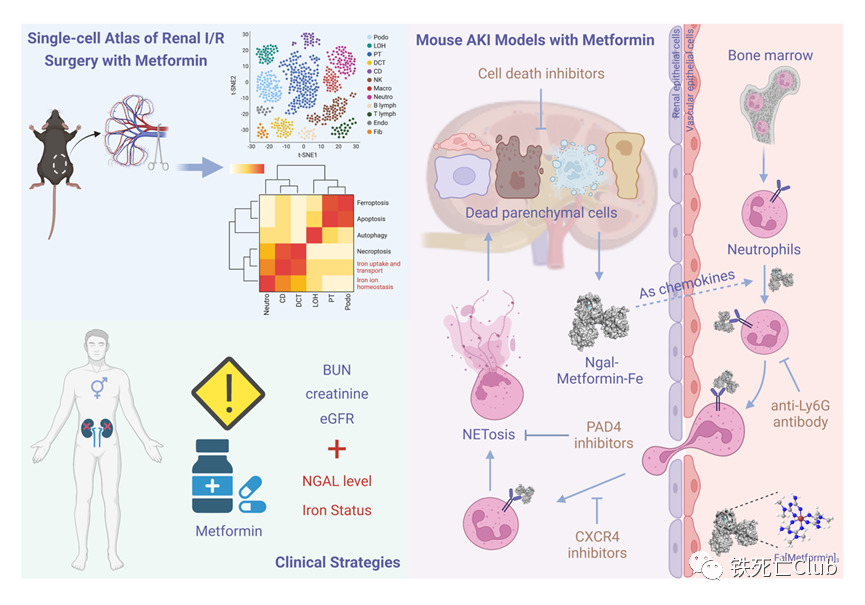
近日,浙江大学医学院王福俤教授和闵军霞教授课题组在国际优秀学术期刊Cell Discovery (Q1, IF=33.5) 发表题为“Metformin Potentiates Nephrotoxicity by Promoting NETosis in Response to Renal Ferroptosis”的研究论文。该研究意外发现长寿“神药”——二甲双胍具有显著加重急性肾损伤的毒副作用,严重时甚至导致致死效应;首次深入揭示了二甲双胍肾毒性的分子机制。该重大科学发现为科学评估和指导二甲双胍的临床应用提供了重要科学依据,也为全球糖尿病肾病人群高发提供了病因溯源的科学依据。 图1. 论文首页 世界老龄人口预计在2050年要达到20亿,中国已经步入了老龄化社会。衰老是最常见的人类慢性疾病发展的重大危险因素,90%的65岁以上老年人至少患有一种慢性疾病。 药物抗衰老策略已被报道可能通过多种途径。目前,二甲双胍 (Metformin)、烟酰胺 (Nicotinamide)、白藜芦醇 (Resveratrol)、雷帕霉素 (Rapamycin) 以及衰老细胞清除剂 (Senolytics, Quercetin + Dasatinib)具有较好的临床转化前景。 图2.长寿潜在药物的二维化学分子结构 肾脏疾病是影响人类健康长寿的重要危险因素,全球10%以上的成年人患有肾脏疾病。其中,急性肾损伤(AKI)是引发多种器官衰竭的常见临床病因,在危重症患者中的发病率高达50%。此外,AKI患者具有较高风险进展为慢性肾病、终末期肾病、直至肾衰竭。目前,缺乏靶向治疗肾脏疾病的特异性药物仍然是阻碍攻克肾脏疾病的重要原因,进而严重威胁人们的生活质量。因此,预防和治疗肾脏疾病是一个迫切需要被研究的公共卫生问题。 针对这一临床重大需求,王福俤教授指导蔡昭贤博士研究生利用以上5种长寿药物干预缺血再灌注诱发的急性肾损伤小鼠,旨在探究这些长寿神药是否具有保护肾功能的作用。 实验结果意外发现,二甲双胍不但没有保护效应,反而加重了缺血再灌注导致的急性肾损伤,并且呈现明显的剂量依赖性。在较高水平的二甲双胍暴露下,急性肾损伤小鼠全部出现死亡。进一步研究发现,二甲双胍肾脏毒副作用不仅在缺血再灌注引发的急性肾损伤中存在,而且存在于横纹肌溶解导致的急性肾损伤过程中。 值得注意的是,在二甲双胍的FDA服用指南以及我国专家临床共识中指出,以肾小球滤过率 (eGFR) 为评估指标,若患者在一定程度上伴有肾脏疾病不建议服用二甲双胍或调整服用剂量,存在潜在肾脏副作用,但机制并不清楚。由于越来越多的非糖尿病人群服用二甲双胍,因此,可能存在潜在风险。 此外,从药代动力学上来看,二甲双胍在人体内无法被分解代谢,一般主要在肝脏富集,并以原分子形式从肾脏排出。为进一步探究二甲双胍肾毒性的具体机制,研究团队引进单细胞转录组测序技术发现,肾脏14种细胞类型中,7种肾脏实质细胞类型 (Podo / PT / LOH / CD-PC / CD-IC / CD-Trans / DCT) 在二甲双胍的干预下数量明显减少。由于实质细胞的特性无法在短期通过迁移来改变数量,因此研究人员提出二甲双胍的干预可能会导致肾脏实质细胞发生死亡。 图3. 二甲双胍剂量依赖性诱导肾脏实质细胞死亡并加重急性肾损伤 (Cell Discovery, Figure 1) 前期研究提示,急性肾损伤多种程序性细胞死亡均发挥一定作用,如凋亡、程序性坏死和铁死亡等。因此,研究团队利用铁死亡抑制剂 (ferrostatin-1, Fer-1和liproxstatin-1, Lip-1)、程序性坏死抑制剂 (necrostatin-1, Nec-1和necrostatin-1s, Nec-1s) 和凋亡抑制剂 (emricasan, Emr) 处理二甲双胍加重的急性肾损伤。结果发现,多种细胞死亡抑制剂在一定程度上均具有一定保护效应,但铁死亡抑制剂的效果相对更佳。这一现象与二甲双胍加重的横纹肌溶解引发的急性肾损伤中实验结果一致。 通过对肾脏实质细胞差异变化基因进行通路富集分析,结果显示多种程序性细胞死亡均发生显著变化,但是铁死亡通路排名相对靠前。因此,以铁死亡为研究模型,研究团队利用单细胞测序技术进一步研究潜在分子机制。同样,在14种肾脏细胞类型中,7种肾脏实质细胞类型 (Podo / PT / LOH / CD-PC / CD-IC / CD-Trans / DCT) 在Fer-1的作用下数量显著增加。电镜下,肾小管上皮细胞的细胞形态也明显被保护,细胞空泡化、线粒体形态完整度等亚细胞结构明显好转。因此,二甲双胍的肾毒性主要表现为促进肾脏实质细胞发生多种形式的细胞死亡,破坏肾脏结构和功能。 图4. 肾脏实质细胞铁死亡为主要形式细胞死亡是二甲双胍肾毒性关键机制 (Cell Discovery, Figure 2) 不难发现,在对所有肾脏实质细胞差异变化基因的通路分析中,铁代谢通路“iron uptake and transport pathway”和“iron homeostasis pathway”显著变化。为了明确铁水平在二甲双胍肾毒性中的作用,研究人员利用不同铁含量的膳食构建了机体不同铁水平的小鼠,通过肾脏缺血再灌注手术,进行二甲双胍干预。结果发现,在高剂量二甲双胍暴露下,低铁水平的小鼠明显挽救了生存率,而高铁水平的小鼠死亡速率更快。接下来,作者利用机体铁缺乏的遗传动物敲除模型小鼠进行研究,TMPRSS6是编码二型跨膜丝氨酸蛋白酶家族的一员,又称为matriptase 2,主要在肝脏表达介导机体铁稳态代谢,其突变与人类难治性缺铁性贫血 (Iron-refractory iron deficiency anemia, IRIDA) 显著相关。Tmprss6突变小鼠以及全身敲除小鼠的肠道铁吸收和巨噬细胞铁循环被明显抑制,血清、组织铁降低伴随小细胞低色素性贫血和全身毛发脱落的表型。目前对于Tmprss6的研究,几乎都是运用全身敲除小鼠模型进行,但为了排除肾脏Tmprss6对于本研究的干扰,我们利用Cre-Loxp系统构建了Tmprss6肝脏特异性敲除小鼠 Tmprss6flox/flox; Alb-Cre+ (LKO)。LKO小鼠明显挽救了二甲双胍肾毒性,并且降低了肾脏铁死亡的水平,即MDA水平下降、4-HNE水平降低以及GSH水平上升。因此,铁代谢紊乱在二甲双胍肾毒性中发挥关键作用,低铁保护二甲双胍引发的急性肾损伤。 图5. 降低铁水平可有效减轻二甲双胍诱导的肾毒性 (Cell Discovery, Figure 3) 在体外细胞实验中,高剂量二甲双胍的直接暴露对原代肾小管上皮细胞没有明显作用。单细胞数据显示,中性粒细胞在二甲双胍的干预下数量显著上升,提示二甲双胍在加重急性肾损伤的过程中伴随着大量中性粒细胞的骨髓动员,从循环中迁移到肾脏。作者利用中性粒细胞中和抗体清除掉小鼠机体中的中性粒细胞,惊喜发现,上述处理显著保护了高剂量二甲双胍肾毒性的小鼠生存率,并且降低了较低剂量二甲双胍暴露下的肾脏损伤水平。中心粒细胞大量聚集是小鼠致死关键病因。 中性粒细胞是机体对抗细菌、真菌感染的先锋军,其存在一种特殊的细胞响应方式NETosis,活化的中性粒细胞排出致密的DNA网状结构并充斥着各种蛋白酶形成胞外陷阱来防止其传播,实现宿主防御作用,并且在无菌炎症、血栓形成、阿尔兹海默症、器官损伤等病理过程中发挥关键作用。 通过检测NETosis的特异性标志物髓过氧化物酶 (myeloperoxidase, MPO) 和中性粒细胞弹性蛋白酶 (Neutrophil Elastase) 的水平,以及中性粒细胞NETosis关键基因PAD4特异性抑制剂GSK484和Cl-amidine的作用,结果表明:在二甲双胍的干预下,中性粒细胞从骨髓迁移至肾脏,通过激活NETosis 进一步加剧肾脏的损伤程度。 图6. 中性粒细胞诱发的NETosis在驱动二甲双胍肾毒性中起重要作用 (Cell Discovery, Figure 4) 那么损伤的肾脏实质细胞是通过释放什么信号影响了中性粒细胞从骨髓迁移到肾脏并发生NETosis?作者利用单细胞测序技术,对不同实验处理组小鼠所有肾脏实质细胞群体转录组数据进行差异基因分析,结合模糊聚类分析,发现Lipocalin-2(Lcn2)基因表达的变化趋势不仅符合小鼠表型而且排名最高。LCN2基因编码的NGAL (Neutrophil Gelatinase Associated Lipocalin) 蛋白,又称中性粒细胞明胶酶相关脂质运载蛋白,是1993年被丹麦科研团队发现的一个25KDa大小的分泌蛋白,可作为人中性粒细胞终末分化的标志物。2005年,《Lancet》中指出,人体尿液、血清中的NGAL水平是手术后并发急性肾损伤的敏感性、特异性、高预测性的早期生物标志物。在2011年,科学家们研究发现Ngal的表达水平在小鼠的肾脏损伤过程中具有敏感、快速并与损伤程度呈正相关的特点。为研究内源性Lcn2在二甲双胍肾毒性中的作用,于是作者利用Cre-Loxp系统构建了肾脏Lcn2特异性敲除小鼠Lcn2flox/flox; Six2-Cre+ (KKO),显著保护了高剂量二甲双胍干预的小鼠生存率,并降低了低剂量二甲双胍加重的急性肾损伤程度,中性粒细胞NETosis的水平也下降。相反的,外源补充鼠源重组的rmNgal蛋白明显加重了二甲双胍的肾毒性,并且这一现象可被中性粒细胞的中和抗体逆转。 NGAL蛋白的结构中存在一种口袋结构,可以结合一些有机小分子和铁元素。因此特性,中性粒细胞利用NGAL蛋白可以与细菌分泌的嗜铁素结合,阻碍细菌从环境中摄取生长所需的铁元素,发挥先天免疫方面的生理病理功能。为验证二甲双胍是否能与机体中的三价铁离子形成复合物并发挥生理功能,作者将二甲双胍与氯化铁在无水乙醇溶剂体系中进行化学反应,利用元素分析手段和分子对接分析方法,并借助计算机蛋白—配体对接分析,发现二甲双胍可以与三价铁离子形成一个三聚体络合物,并与Ngal蛋白形成Ngal-metformin-Fe复合物([metformin]3Fe)。对缺血再灌注引发的急性肾损伤小鼠干预[metformin]3Fe复合物,使得小鼠循环中的中性粒细胞被调动,并且逆转了低铁小鼠LKO对二甲双胍肾毒性的保护作用。 图7. 肾源性Ngal与二甲双胍-铁形成复合物并加重肾毒性 (Cell Discovery, Figure 5) 那么中性粒细胞是如何识别损伤信号的?中性粒细胞在骨髓生成后,其表面受体CXCR家族在其迁移、归巢等过程中发挥关键作用。作者利用单细胞测序技术,对肾脏中所定义到的中性粒细胞群进行Cxcr家族转录水平的分析,结果发现,Cxcr4的变化规律更符合小鼠表型。同样的,Cxcr1/2抑制剂SCH527123不能挽救二甲双胍的肾毒性,但两种Cxcr4的小分子抑制剂AMD3100 和WZ811可以明显保护肾脏损伤程度。CXCR家族一般通过识别CXCL家族成员来调节免疫细胞响应。但作者用CXCL抑制剂UNBS5162并没有显示出肾脏保护作用,提示可能存在其他的识别底物。因此,作者对Ngal-metformin-Fe复合物进行了探究,利用计算机模拟蛋白间相互作用,结合体外Co-IP和体内Co-IF实验证明了CXCR4与Ngal-metformin-Fe之间存在明显的相互作用关系。提示:中性粒细胞通过表面受体Cxcr4识别Ngal-metformin-Fe肾损伤信号迁移至肾脏参与二甲双胍肾毒性病理作用。 图8. Cxcr4通过识别Ngal-metformin-Fe复合物迁移至肾脏损伤部位 (Cell Discovery, Figure 6) 论文成果总结 该研究论文使用两种不同的急性肾损伤小鼠模型发现不同剂量的二甲双胍在不同给药方式时均有明显的肾毒性,也为全球糖尿病肾病人群高发提供了病因溯源的科学依据。 借助单细胞测序技术发现二甲双胍的干预能够导致多种肾脏实质细胞发生多种形式的细胞死亡,并引起大量中性粒细胞的骨髓迁移和肾脏浸润。 在机制上,损伤的肾脏实质细胞分泌大量的Ngal蛋白,和循环中的二甲双胍、游离铁形成Ngal-metformin-Fe复合物,与中性粒细胞表面受体Cxcr4结合发挥趋化作用,通过介导中性粒细胞浸润至肾脏并发生NETosis,从而进一步加重肾脏损伤。 在治疗新策略方面,细胞死亡抑制剂靶向保护肾脏实质细胞死亡以减少Ngal蛋白的分泌;Cxcr4抑制剂、Pad4抑制剂以及中性粒细胞中和抗体等都能够靶向阻碍中性粒细胞在肾脏中的作用,从而减轻肾脏损伤程度。 从临床转化应用角度,该研究结果表明:接受二甲双胍治疗的患者除了评估其肾功能指标外,应该监测全身NGAL水平和铁水平,以规避潜在的临床肾毒性风险。 图9. 论文模式图 浙江大学蔡昭贤博士生(已按时毕业)和博士研究生吴晓甜、宋秭君为论文共同第一作者。 王福俤教授、闵军霞教授为论文的共同通讯作者。 参考文献: Cai, Z., Wu, X., Song, Z. et al. Metformin potentiates nephrotoxicity by promoting NETosis in response to renal ferroptosis. Cell Discov 9, 104 (2023). https://doi.org/10.1038/s41421-023-00595-3