同样是多肽,为什么司美格鲁肽可以口服,而胰岛素却不行?
时间:2023-11-03 14:41:44 热度:37.1℃ 作者:网络

口服多肽面临的障碍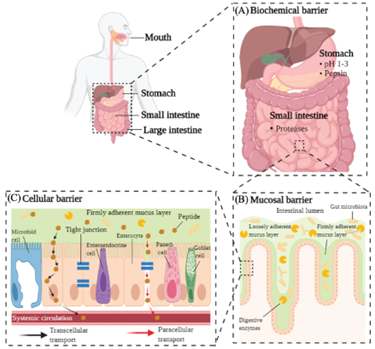
黏膜障碍,则是指人体胃肠道表面覆盖的一层高度复杂的黏液层会对药物的吸收产生明显的阻碍,该黏液由杯状细胞分泌,主要由黏蛋白组成,负责润滑摄入的食物、维持上皮细胞的水化层以及防止病原体和外来物质进入上皮细胞。对于多肽类药物而言,药物分子只有穿透黏液层才能通过上皮细胞进行吸收,而药物在黏液层的穿透性主要由药物的颗粒大小和所带电荷决定。比如黏液层的孔隙率在25-200nm之间,且黏蛋白带有负电荷,因此尺寸在此范围内且带有正电荷的药物颗粒更易透过黏液层。而成功穿过黏液层的药物会以两种方式穿过上皮细胞:细胞旁转运和跨细胞转运。由于上皮细胞间存在紧密连接、粘附连接以及细胞桥粒,因此细胞旁转运只适合分子量相对较小(≤20 kDa)的多肽分子,且有研究证明带负电荷的分子更易通过细胞旁转运。而跨细胞转运中主要存在的障碍是多肽药物分子在进入小肠上皮细胞后可能会被当做是外来分子,从而被细胞内的蛋白酶水解,或被再次排出小肠细胞,这些情况都会对药物的生物利用度产生影响。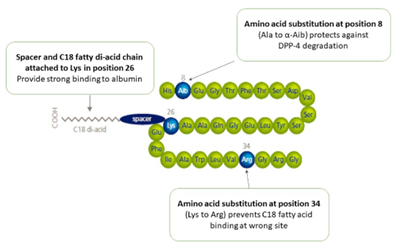
SNAC是由美国Emisphere公司于20世纪90年代开发的一种具有两亲性的吸收促进剂,全称为Sodium N-(8-[2-hydroxybenzoyl]amino) caprylate。在SNAC成功合成之后Emisphere选取了一系列渗透性差的药物进行测试,这其中普通肝素的口服递送是SNAC第一个应用案例,然而令人遗憾的是,在Ⅲ期临床试验中口服配方相比于皮下注射而言并未显示出更优越的疗效,因此该产品最终并未上市。SNAC成功应用的第一个案例为2014年FDA批准上市的口服维生素B12(Eligen B12)。对于司美格鲁肽而言,由于其分子量低、半衰期长且效力较高,因此成为了SNAC口服配方的理想候选药物。其作用机制如下图所示:首先当司美格鲁肽药片在胃内崩解后,SNAC通过缓冲作用增加局部pH值,通过降低胃蛋白酶原向胃蛋白酶的转化来降低司美格鲁肽的降解;其次,溶解后的SNAC可以改变局部溶液的极性,从而减弱司美格鲁肽由于疏水相互作用而引起的寡聚化;最后SNAC可以通过流化胃上皮细胞细胞膜来促进司美格鲁肽的跨细胞膜转运[3]。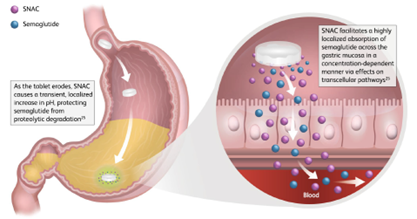
Rybelsus的临床试验(PIONEER系列)结果如下图所示,从结果中我们可以看到,在控制血糖方面,不管是对于糖尿病早期病人、中期病人还是长期病人,与安慰剂相比口服3mg、7mg和14mg司美格鲁肽治疗26周之后均能有效的降低糖化血红蛋白(HBA1c)水平,并且降低幅度与剂量呈正相关,剂量越高降幅越大,同时与经典降糖药物恩格列净和西他列汀相比,口服14mg司美格鲁肽均显示出更优的降糖效果,如在PIONEER 7 Flex试验中,口服司美格鲁肽治疗52周之后HBA1c的降幅达1.3%,而对照组西他列汀只有0.8%;而在减重方面口服司美格鲁肽同样表现不俗,在PIONEER 1试验中,口服3mg、7mg和14mg司美格鲁肽可分别使体重降低1.5kg、2.3kg和3.7kg[3]。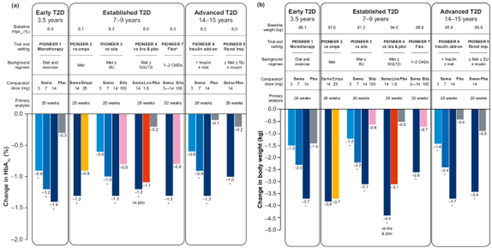
口服胰岛素
与司美格鲁肽一样,初期SNAC也同样被用于开发口服胰岛素,因为根据部分文献报道,SNAC对于胰岛素的跨细胞转运同样具有促进作用:从下图中我们可以看到,在向配方中加入SNAC后,SNAC可以将胰岛素透过Caco-2单层细胞的渗透率增加约10倍,并且在基底侧并未发现明显的乳酸脱氢酶累计(Lactate Dehydrogenase,LDH),通常来说乳酸脱氢酶可作为细胞毒性的标识,这就初步说明SNAC可以促进胰岛素的细胞透过性,且不会引起细胞损伤。其次从图D中我们可以看到,SNAC的存在并不会引起甘露醇的增加,而甘露醇一般被作为细胞旁转运的标识,说明胰岛素基本都是通过跨细胞途径转运的[5]。基于上述的理论研究,Emisphere开展了一系列Ⅰ&Ⅱ临床试验,来证明通过Eligen技术口服递送胰岛素的安全性和有效性。与此同时,诺和诺德也看中了Eligen技术的潜在价值,与Emisphere签订了多个独家开发协议,用于诺和诺德胰岛素和GLP-1激动剂的口服开发。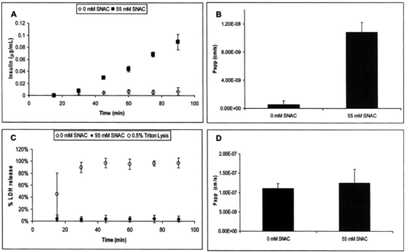
然而令人遗憾的是,在早期临床试验中Emisphere发现,与皮下注射相比口服胰岛素的吸收速度要快得多(Tmax分别是27min和161min),并且口服胰岛素的清除速度也要快得多(2小时内),说明口服胰岛素虽然起效快但作用时间却非常短,且口服的生物利用度仅为注射的3%。而在后续为期90天的Ⅱ期临床试验中,Emisphere发现口服胰岛素并不能改善2型糖尿病患者的代谢控制,因此暂时终止了口服胰岛素的开发[6]。因此总结来说,相比于司美格鲁肽而言,口服胰岛素存在的难点首先在于胰岛素分子量更高,更高的分子量就意味着细胞跨膜运输的难度将更高;并且由于胰岛素是由两条肽链组成的,具有一定空间构象,在口服过程胰岛素需要通过口腔、胃和小肠等一系列消化道,其中任何会引起构象改变的因素均会影响生物利用度。并且我们需要知道的是,即使是司美格鲁肽其口服的生物利用度也仅为0.8%,因此如何通过新技术与新辅料来进一步提高口服胰岛素的生物利用度,仍是摆在科研工作者面前的一道难题。
1.Jash A, Ubeyitogullari A, Rizvi S S H. Liposomes for oral delivery of protein and peptide-based therapeutics: challenges, formulation strategies, and advances[J]. Journal of Materials Chemistry B, 2021, 9.DOI:10.1039/D1TB00126D.
2.Kalra S, Sahay R. A Review on Semaglutide: An Oral Glucagon-Like Peptide 1 Receptor Agonist in Management of Type 2 Diabetes Mellitus[J].Diabetes Therapy, 2020(9).DOI:10.1007/s13300-020-00894-y.
3.Aroda V R, Blonde L, Pratley R E. A new era for oral peptides: SNAC and the development of oral semaglutide for the treatment of type 2 diabetes[J].Reviews in endocrine & metabolic disorders, 2022, 23(5):979-994.DOI:10.1007/s11154-022-09735-8.
4.Heinemann L, Jacques Y. Oral Insulin and Buccal Insulin: A Critical Reappraisal[J].Journal of diabetes science and technology, 2009, 3(3):568-584.DOI:10.1177/193229680900300323.
5.Dmitry Malkov, Robert Angelo, Huai-zhen Wang, Elizabeth Flanders, Heather Tang, Isabel Gomez-Orellana. Oral delivery of insulin with the eligen technology: mechanistic studies.[J].Current Drug Delivery, 2005, 2(2):-.DOI:10.2174/1567201053586001.
6.Zijlstra E, Heinemann L, Plum-Morschel L. Oral Insulin Reloaded: A Structured Approach[J].Journal of Diabetes Science & Technology, 2014, 8(3):458-465.DOI:10.1177/1932296814529988.


