CCR:血浆TP53突变当心!预测HR+/HER2-转移性乳腺癌预后差,与治疗无关
时间:2023-11-18 21:21:10 热度:37.1℃ 作者:网络
缺乏CDK4/6抑制剂的预后和预测生物标志物。接受这类治疗的患者可进行循环肿瘤DNA(ctDNA)分析,ctDNA的动态变化可能是治疗疗效的早期预测指标。PEARL试验比较了哌柏西利+氟维司群与卡培他滨,本研究对该试验中的患者进行了血浆ctDNA分析,探索基线基因图谱和治疗期间ctDNA动力学与治疗疗效的相关性。在基线(C1D1)和治疗期间(C1D15)收集相关血液样本,对血浆ctDNA进行测序。使用单变量和多变量Cox模型分析ctDNA突变与治疗疗效的相关性。在治疗期间ctDNA动力学模型中,使用预先指定的方法来评估C1D1和C1D15克隆突变的ctDNA变化。201例患者进行了基线样本分析,ctDNA阳性与较差的PFS/OS相关。在两个治疗组中,TP53突变阳性均与较差的PFS和OS相关,在基线ctDNA阳性患者中也是如此。在总体人群中,ESR1突变与较差的OS相关,在基线ctDNA阳性患者中,不存在该相关性。仅在哌柏西利+氟维司群组中,PIK3CA突变与较差的OS相关。ctDNA动力学分析(n=120)显示卡培他滨组的ctDNA抑制较高。在两个治疗组中,没有ctDNA抑制的患者PFS均较差。本研究表明,携带血浆TP53突变的HR+/HER2- MBC患者生存状况较差,无论接受内分泌治疗还是化疗。早期ctDNA抑制或可预测治疗疗效。需要进一步验证ctDNA动力学的临床效用。

研究背景
细胞周期蛋白依赖性激酶4/6抑制剂(CDK4/6i)联合内分泌治疗(ET)是激素受体阳性(HR+)、人表皮生长因子受体2阴性 (HER2-) 转移性乳腺癌(MBC)患者的主要治疗方案,可用于内分泌敏感和耐药人群。然而,最初未比较该联合疗法与标准治疗选择化疗在经治患者中的疗效。GEICAM/2013-02 PEARL研究(NCT02028507)是一项多中心随机3期临床试验,招募了芳香化酶抑制剂(AI)耐药的HR+/HER2- MBC患者。总体而言,该试验得出结论,在AI耐药患者中,哌柏西利+ET没有优于卡培他滨,CDK4/6i的安全性高于卡培他滨,支持CDK4/6i应考虑用于HR+/HER2- MBC患者的一线治疗,但需要深入研究预后和预测生物标志物,以更好地筛选潜在的治疗获益人群。
在PALOMA-3试验中,患者被随机分配接受哌柏西利+氟维司群或安慰剂+氟维司群治疗,进行血浆ctDNA分析,发现高ctDNA分数、TP53突变和FGFR1扩增与预后较差相关,无论治疗方案如何。临床情况与PEARL入组患者相似的患者中,MBC中其他重要的基因如PIK3CA和ESR1突变对CDK4/6i治疗决策没有显示出临床意义。
有研究提出,治疗压力导致的ctDNA动态变化可早期预测治疗疗效。几项研究分析了接受CDK4/6i联合治疗的患者,发现治疗期间高水平的ctDNA是不良预后标志物,预测较差的无进展生存期(PFS),尽管这些研究使用了不同的技术和ctDNA变化计算方式,方法未标准化。一项探索性研究纳入了少量接受不同靶向治疗的MBC患者,旨在比较各种策略来确定最优的预测阈值,提出了一种最佳方法,需在更大的队列中进一步探索。
本研究对PEARL试验队列2中的患者进行了血浆ctDNA分析,收集基线(C1D1)和治疗期间(C1D15)血液样本,探索基线基因图谱和治疗期间血浆ctDNA动力学与疗效的相关性。流程如图1所示。
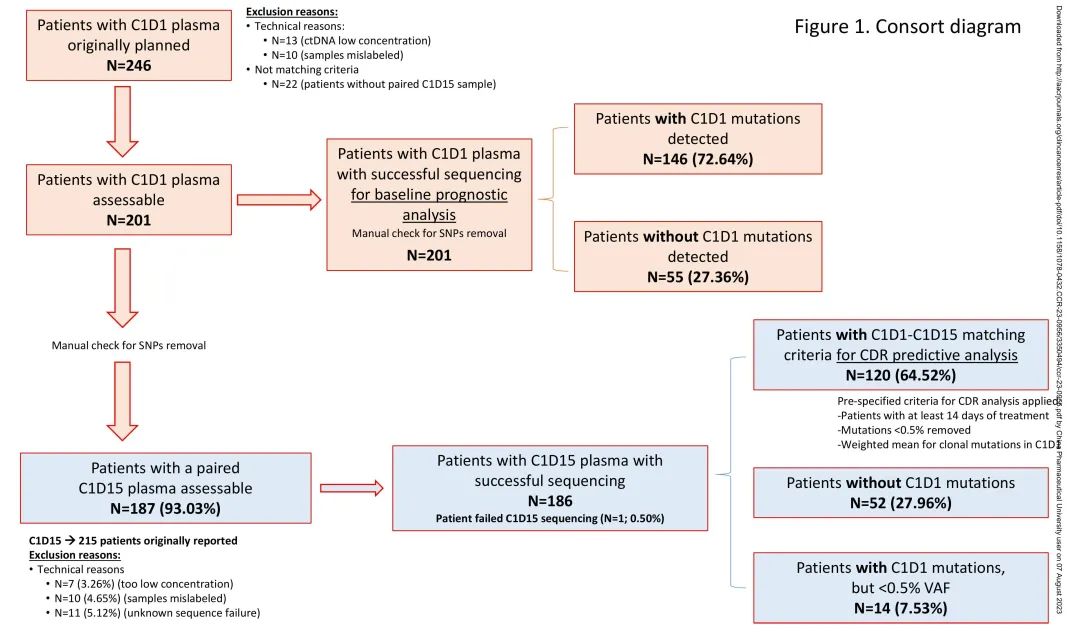

图1. 研究流程
研究结果
人口统计分析
201例有基线样本的患者纳入预后分析,其中107例(53%)接受哌柏西利+氟维司群治疗,94例(47%)接受卡培他滨治疗。本研究人群与总体PEARL人群的基线特征没有差异。对经典人口统计学特征的分析显示,两组患者没有显著差异,除了卡培他滨组有多个转移部位的患者较多(76.6% vs 59.81%;p=0.02),但两组内脏与非内脏疾病没有差异。类似地,两组的PFS没有显著差异(中位PFS [mPFS] 7.82 vs 9.26个月[m];HR 0.97,CI95% 0.7-1.35,p=0.86,校正后p=0.96)。探索性OS分析也显示两组无显著差异(中位OS[mOS] 23.95 vs 30.03m;HR 1.24,CI95% 0.74-2.06,p=0.41,校正后p=0.45)。
基线ctDNA突变与预后
在201例患者中,146例(73%)基线样本至少检出一个突变(ctDNA阳性),55例(27%)未检测到任何突变(ctDNA阴性)。两个治疗组的基线基因图谱没有差异,均ESR1、PIK3CA和TP53基因突变频率最高(图2A)。ctDNA阳性患者的PFS显著短于ctDNA阴性患者(mPFS 7.23m vs 14.75m;HR 1.85,CI95% 1.24-2.76,p<0.01)(图2B)。ctDNA阳性患者的OS也显著短于ctDNA阴性患者(mOS 23.26m vs 未达到;HR 5.22,CI95% 2.08-13.08,p<0.01)(图2C)。
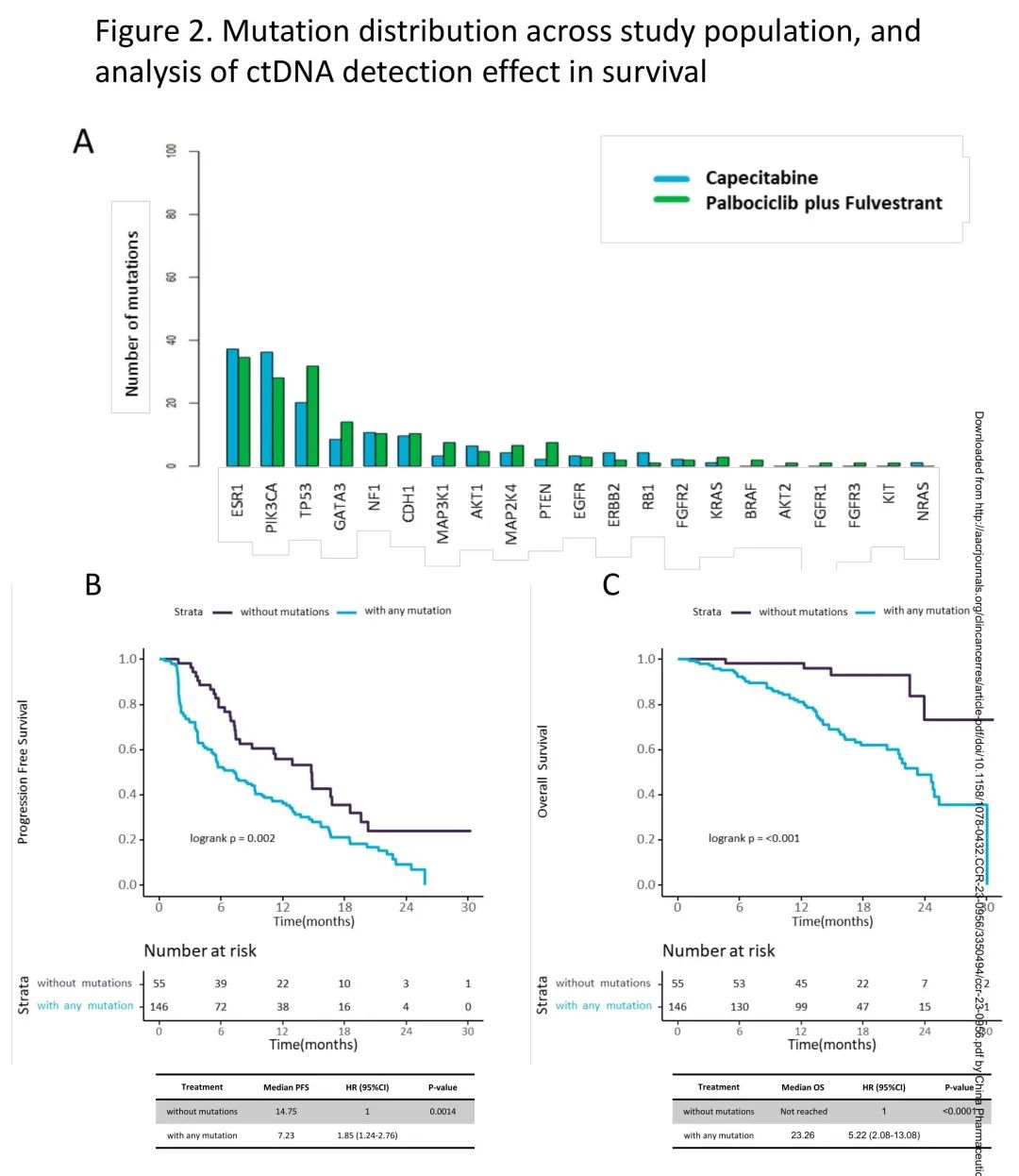

图2. ctDNA突变分布,以及ctDNA状态对PFS、OS的影响
基线ctDNA TP53、ESR1、PIK3CA突变与PFS
在总体人群中,有TP53突变患者的PFS短于无TP53突变患者,mPFS分别为4.4m和10.9m(HR 1.84;95%CI 1.28-2.63;p<0.01;校正后p<0.01)(图3A)。此外,有一个以上、一个、无TP53突变的患者mPFS分别为3.55m、5.26m和10.91m,与无TP53突变的患者相比,有一个以上TP53突变的患者HR为1.98(CI95% 0.8-4.9),有一个TP53突变的患者HR为1.82(CI95% 1.25-2.64)(p<0.01;校正后p=0.02)(图3B),提示有一个以上TP53突变的患者进展风险高于有一个TP53突变的患者。在哌柏西利+氟维司群组中,有TP53突变的患者PFS短于无TP53突变的患者(mPFS 4.83 vs 10.18m;HR 1.74,CI95% 1.08-2.78,p=0.03;校正后p=0.06)(图3C)。在卡培他滨组中,有TP53突变的患者PFS也短于无TP53突变的患者(mPFS 3.78 vs 11.99m;HR 2.07,CI95% 1.17-3.67,p=0.02;p<0.05)(图3D)。当分别分析哌柏西利+氟维司群组或卡培他滨组时,多个vs一个vs无TP53突变的患者PFS也从短到长,但数量有限。
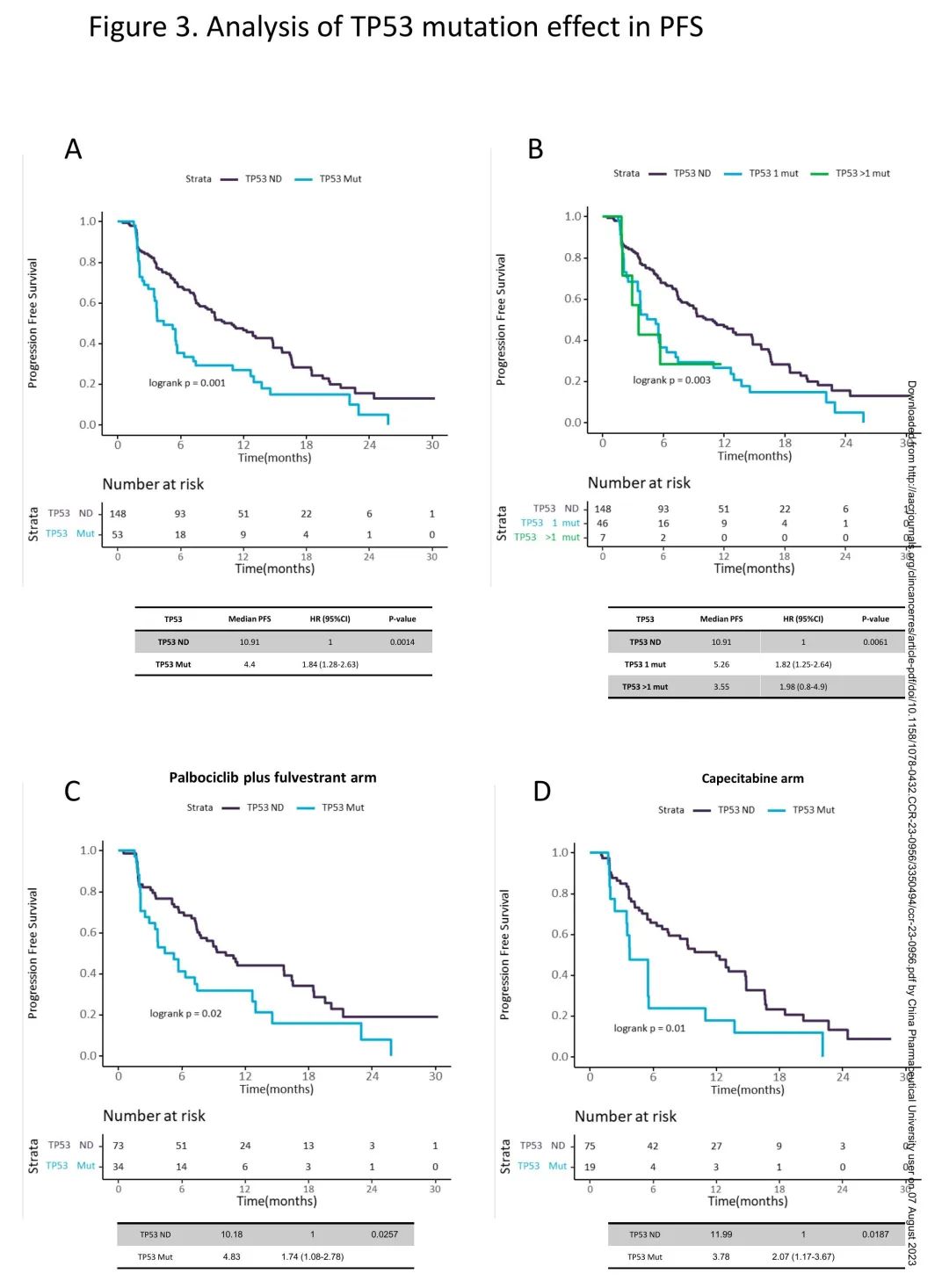

图3. TP53突变对PFS的影响
由于先前研究发现ctDNA阳性患者的PFS显著差于ctDNA阴性患者,ctDNA阳性视为更高的肿瘤负荷和更具侵略性的生物学的替代物,是潜在的混杂变量,因此去除ctDNA阴性患者,重复分析。在ctDNA阳性患者中,有TP53突变的患者PFS也短于无TP53突变的患者,mPFS分别为4.4和9.26个月(HR 1.48;95%CI 1-2.17;p=0.05;校正后p = 0.10)。
ESR1或PIK3CA突变状态不同的患者PFS没有显著差异,在总体人群和ctDNA阳性人群中均是如此。
基线ctDNA TP53与OS
有TP53突变的患者OS短于无TP53突变的患者,mOS分别为16.13m和30.03m(HR 2.89;95%CI 1.74-4.81;p = 0.0001;校正后p = 0.0004)(图4A)。与无TP53突变患者(mOS 30.03m)相比,携带一个以上TP53突变的患者OS(mOS 13.47m)短于、风险比(HR 4.79,CI95% 1.43-16.04)高于只有一个TP53突变的患者(mOS 21.42m;HR 2.76,CI95% 1.64-4.67)(p<0.001;校正后p = 0.001)(图4B)。单独分析接受哌柏西利+氟维司群治疗的患者(15.61m vs 未达到;HR 2.81,CI95% 1.44-5.49,p<0.01;校正后p=0.04)(图4C)和接受卡培他滨治疗的患者(22.08 vs 30.03m;HR 2.86, CI95% 1.29-6.38,p=0.01;校正后p=0.04)(图4D),有TP53突变的患者OS也短于无TP53突变的患者。
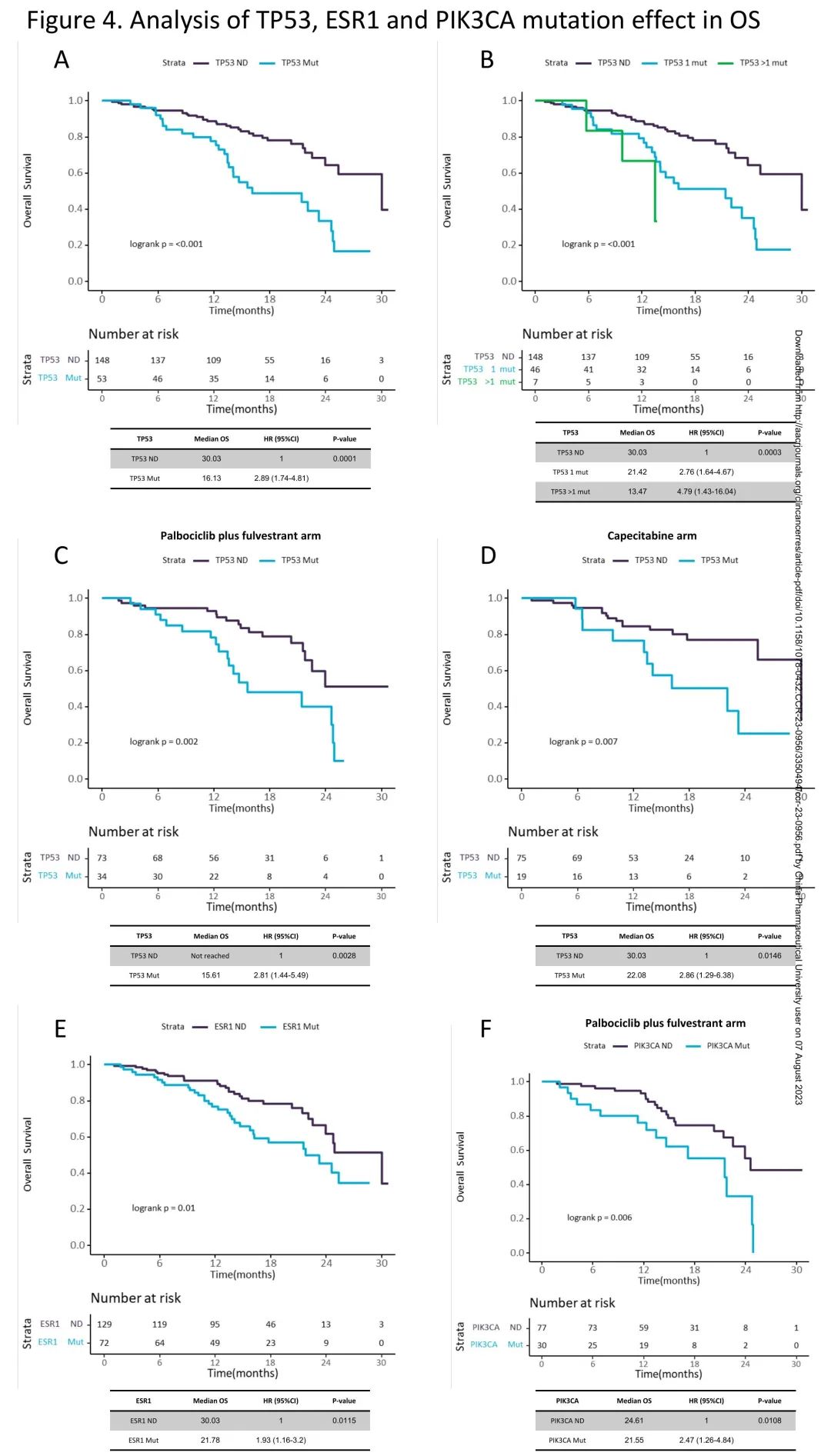
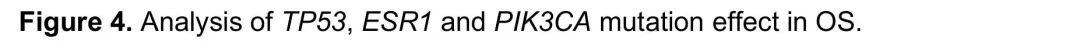

图4. TP53、ESR1、PIK3CA突变对OS的影响
由于ctDNA阳性对OS也有影响,在ctDNA阳性人群中重复OS分析。该分析证实,有TP53突变的患者OS短于无TP53突变的患者(mOS 16.13m vs 30.03m;HR 2.06;95% CI 1.21-3.5;p<0.01;校正后p=0.02)。此外,与无TP53突变的患者(mOS 30.03m)相比,携带一个以上TP53突变的患者OS短于、风险比高于(mOS 13.47m;HR 3.31,CI95% 0.98-11.19)只有一个突变的患者(mOS 21.42m;HR 1.97,CI95% 1.14-3.4)(p=0.02;校正后p=0.03)。
基线ctDNA ESR1、PIK3CA突变与OS
有ESR1突变的患者OS短于无ESR1突变的患者,mOS分别为21.78m和30.03m(HR 1.93;95%CI 1.16-3.2;p = 0.01;校正后p = 0.04)(图4E)。按突变数量分层时,这一结果维持,与无ESR1突变的患者(mOS 30.03m)相比,有一个以上ESR1突变的患者OS短于、风险比高于(mOS 21.55m;HR 2.45,CI95% 1.27-4.72)只有一个突变的患者(mOS 24.61m;HR 1.67,CI95% 0.92-3.01)(p=0.02,校正后p=0.07)。单独分析哌柏西利+氟维司群治疗组(21.55m vs 24.77m;p=0.09,调整后p=0.11)或卡培他滨组(23.26m vs 30.03m;p=0.04,调整后p=0.13),有和无ESR1突变的患者OS差异不显著。
在ctDNA阳性人群中,有和无ESR1突变的患者OS没有差异(p=0.47;校正后p=0.99)。
在总体人群中,有PIK3CA突变的患者OS与无PIK3CA突变的患者相似(p = 0.14)。有趣的是,与TP53和ESR1不同,OS的差异似乎仅限于接受哌柏西利+氟维司群治疗的患者,有和无PIK3CA突变的患者mOS分别为21.55m和24.61m(HR 2.47;95%CI 1.26-4.84;p=0.01;校正后p = 0.02)(图4F),按突变数量分层时保持这一结果,与无PIK3CA突变的患者(mOS 24.61m)相比,有>1个PIK3CA突变的患者mOS 12.32m;HR 7.16,CI95% 2.78-18.47,有1个PIK3CA突变的患者mOS 21.78m;HR 1.74,CI95% 0.79-3.83(p<0.01,校正后p=0.03)。
在ctDNA阳性人群中,PIK3CA突变与OS无关(p=0.71,校正后p=0.75),但按治疗方案分层时,PIK3CA突变与OS相关。
ctDNA动态分析的预测作用
120例患者符合标准,可以进行克隆突变(C1D1 VAF>0.5%)ctDNA动力学C1D15-C1D1 ctDNA比值(CDR)分析,哌柏西利+氟维司群组64例(53%),卡培他滨组56例(47%)。在总体基线人群中,81例(40%)患者未纳入CDR分析,因为基线未检测到ctDNA(n = 52;64%),基线突变VAF<0.5%(n = 14;17%),没有配对的C1D15样本(n = 14;17%)或C1D15样本测序失败(n = 1;1%)(图1)。CDR分析患者的ECOG 1显著高于非CDR分析患者,没有其他临床病理学差异。CDR和非CDR人群的生存存在显著差异(mPFS 6.21m vs 14.75m),CDR人群的进展风险较高(HR 1.78,CI95% 1.25-2.52,p<0.001),与81%的非CDR人群基线ctDNA阴性或突变丰度低(VAF<0.5%)一致。CDR和非CDR人群的基因图谱没有差异。
CDR与PFS
两个治疗组的中位CDR存在显著差异,卡培他滨组的CDR低于(即更深刻的ctDNA抑制)哌柏西利+氟维司群组(中位CDR 0.07 vs 0.21,p<0.01)(图5A)。此外,卡培他滨组中CDR=0(即ctDNA完全抑制,低于检测下限)的患者比例高于哌柏西利+氟维司群组(23.21% vs 7.81%,p=0.02)。
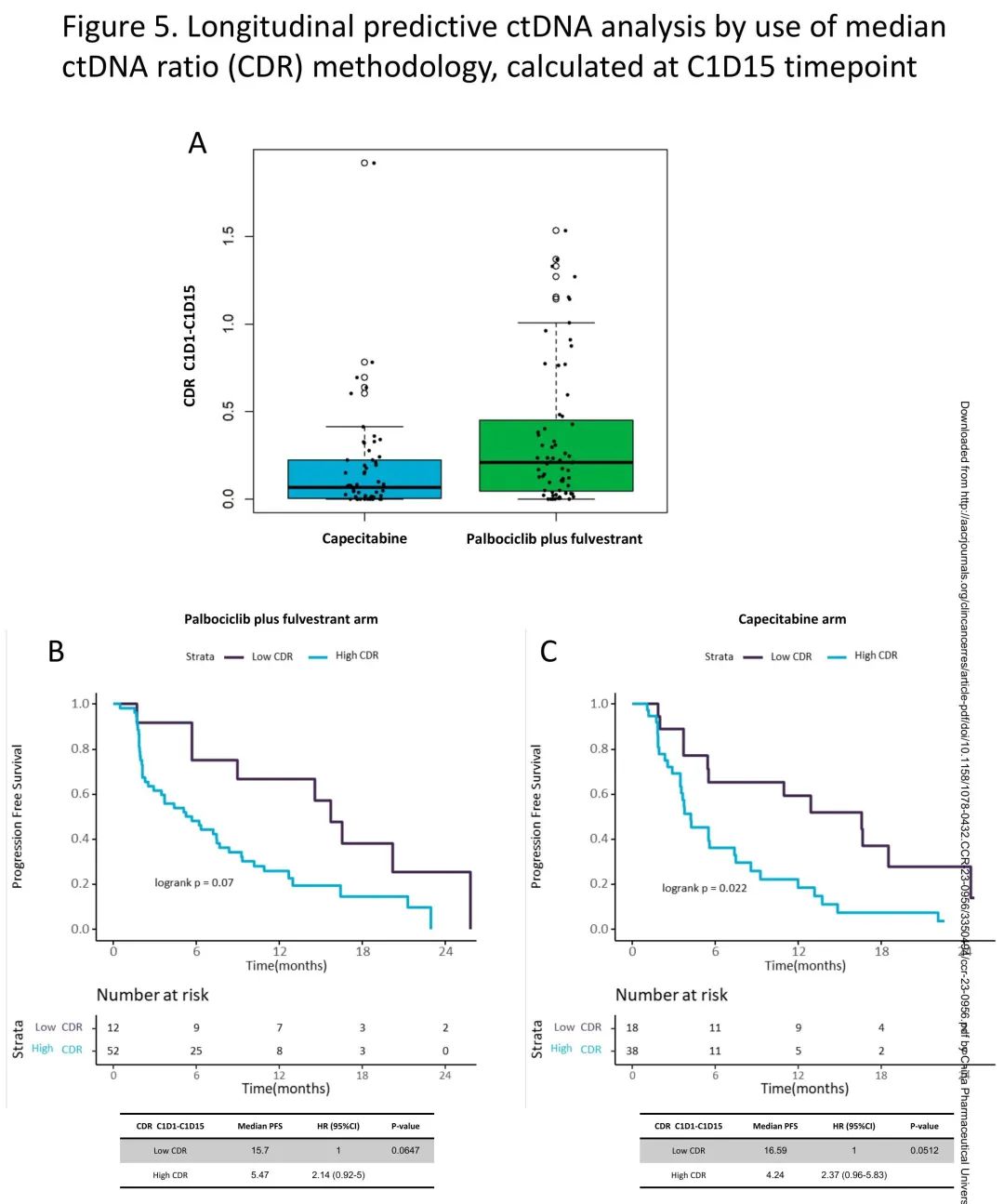

图5. C1D15时纵向预测性ctDNA分析,使用中位CDR
然后,探索了最佳方法用于预测每组的PFS。在哌柏西利+氟维司群组中,最佳阈值为CDR=0.0247,HR为2.14(95%CI 0.92-5),p=0.06(图5B)。在卡培他滨组中,最佳阈值为0.0127,HR为2.37(95%CI 0.96-5.83),p = 0.05(图5C)。
尽管数量有限,分析了ctDNA抑制患者中TP53突变的潜在不利影响,显示在两组中,有和无TP53突变的患者生存没有显著差异,TP53突变、ctDNA抑制患者的生存总体上较好,提示实现早期ctDNA下降超过了基线TP53突变的不利影响(哌柏西利+氟维司群:mPFS 14.55 vs 16.53m;HR 1,95% CI 02-5;p=0.99;卡培他滨:mPFS 8.25 vs 16.66m;HR 2.71,95%CI 0.52-14.06;p=0.27)。
C1D1克隆突变的加权平均值是最佳的预测方法,在两个治疗组中均是如此。用于CDR计算和预测的其他方法总体上显示出相似的结果,尽管不如最佳方法。
CDR与疗效
在纳入纵向预测ctDNA分析的120例患者中,118例疗效数据可及。客观缓解(OR)定义为完全缓解(CR)或部分缓解(PR),临床获益率(CBR)定义为OR和稳定疾病(SD)(根据RECIST v1.1),根据研究纳入的所有患者的CDR值进行评估。OR为18%(均为PR),CBR为73.7%。疾病进展(PD)患者占26.3%。
总体而言,CBR患者(N = 87)的CDR抑制高于进展患者(N = 31),CDR分别为0.1和0.2(p = 0.03),但按治疗方案分层时,不存在该差异(哌柏西利+氟维司群p=0.12,卡培他滨p=0.29),但样本量有限。
讨 论
本研究表明,很大一部分HR+/HER2-转移性乳腺癌患者血浆检测到TP53突变,与未检测到TP53突变的患者相比,其结局显著较差。在内分泌治疗或化疗组中,TP53突变患者生存均很差,扩展了PALOMA-3试验中接受内分泌治疗的患者的结果,提示侵袭性行为,与治疗无关,突出了设计临床策略以改善该人群结果的必要。我们认为TP53突变应该纳入未来HR+/HER2- MBC的预后和预测模型,因为该有害因素可能影响很大,模型不纳入该信息可能影响其适用性。此外,在我们的探索性OS分析中,TP53突变也导致OS较差。尽管在PEARL进展后,后续治疗不受控制,但研究显示,不同治疗组的PFS2和OS没有差异,提示与本研究中对OS影响的发现一致。有趣的是,我们发现多个TP53突变会带来更差的结果,这一观察结果需要进一步验证。我们承认这些发现的潜在局限是,我们没有对测序进行胚系校正,检出的一些TP53突变可能是由克隆性造血引起的。鉴于TP53突变在乳腺癌中的高发生率,克隆性造血可能对我们的结论有一定的污染作用。但是,我们试图采取一些措施来尽量减少这种影响。除了常规的质控外,根据变异群体频率消除了已知的群体水平胚系变异。我们使用基于VAF的潜在胚系突变的自定义R脚本进一步对剩余数据进行了分析和过滤,并且我们的分析中仅包括致癌/可能致癌变异。TP53突变存在于5-10%的CHIP,转移性乳腺癌患者中ctDNA检测到CHIP的比例最高约为25%。因此,在本研究中,只有1.25-2.5%的患者可能存在TP53 CHIP突变,其中大多数会被我们的分析方法过滤掉。因此,我们认为CHIP对我们结论的影响很小。我们承认胚系白细胞DNA测序有助于优化CHIP减法,但不幸的是,这在本研究中不可能。该人群中存在或获得的其他常见突变,如ESR1或PIK3CA突变,在探索性OS分析中特别相关。发现ESR1突变导致生存较差,与先前的研究结果一致。此外,在接受哌柏西利和氟维司群治疗的患者中,还发现PIK3CA突变对OS的不利影响。越来越多的证据表明,在转移性乳腺癌中,PIK3CA突变似乎会带来较差的结果,相比之下,在早期患者中,PIK3CA突变通常与较好的结局相关。与先前使用组织样本的研究相比,本研究中ESR1突变患者比例略高,这可能反映了ctDNA可以有效检测PIK3CA突变,PIK3CA突变通常是多克隆的,存在于亚克隆水平。
关于早期预测,我们应用了先前报告的15种方法来计算CDR,包括经治样本中潜在的克隆基因的VAF的加权平均值。本研究显示,在两个治疗组中,该方法均可以筛选出获益较多的患者,先前的研究表明,早期ctDNA动力学或可预测疗效,本研究提供了进一步证据。
我们承认,我们的CDR结果是探索性的,需要进一步验证。我们的panel似乎仅限于广泛探索ctDNA动力学,但我们的方法旨在评估相关突变的早期动力学,这些突变在患者的血液循环中具有足够的代表性,其变化可以可靠地评估,这是其他类似研究中未完全解决的重要问题。我们也承认我们的方法的灵敏度可能不如肿瘤知情方法,但鉴于我们重点关注变化,我们认为关键点是突变丰度的可靠定量(即我们研究中的VAF),试图通过关注相关基因和进行深度纠错测序来实现这一点。我们的CDR结果有局限性,但我们试图提供严格的数据。治疗疗效预测的最佳阈值在取决于背景,会因临床环境、治疗和用于评估ctDNA变化的算法而异。然而,有趣的是,使用我们的方法得出的PEARL最佳阈值与PALOMA-3和先前纳入接受靶向治疗的患者的研究一致,提示早期ctDNA抑制(通常为CDR处于0-0.1)很重要,可以筛选出获益较多的患者。我们注意到,这可能不适用于接受免疫治疗的患者,在接受免疫治疗的患者中,较少的ctDNA抑制就可能足以筛选出治疗反应较好的患者。我们假设,基于内分泌或化疗的治疗必须达到重要程度的细胞抑制或细胞毒性作用才能预测长期益处,而对于接受免疫治疗的患者,微环境在控制增殖方面起着重要作用,较小的细胞抑制或细胞毒性作用,反映在较高的CDR,可能足以筛选出获益较多的患者。
与哌柏西利和氟维司群相比,接受卡培他滨治疗的患者第15天时ctDNA抑制明显更显著,提示化疗细胞毒性可能导致更快的抑制。有趣的是,基线未检出任何突变的患者生存显著优于检出突变的患者。这是意料之中的,进一步证明没有检出突变可能反映了低肿瘤负荷或增殖,因此预后较好,无论治疗方案如何。
总之,本研究表明,携带血浆TP53突变的HR+/HER2- MBC患者PFS较差,无论接受内分泌治疗或化疗。此外,血浆ESR1突变的患者可能长期生存较差。本研究进一步证明了早期ctDNA抑制或可预测长期治疗疗效,提出了有助于选择获益较多患者的最佳方法。需要进一步验证ctDNA动力学的临床效用。
参考文献:
Pascual J, Gil-Gil M, Proszek P, Zielinski C, Reay A, Ruiz-Borrego M, Cutts R, Ciruelos Gil EM, Feber A, Muñoz-Mateu M, Swift C, Bermejo B, Herranz J, Margeli Vila M, Antón A, Kahan Z, Csöszi T, Liu Y, Fernandez Garcia D, Garcia-Murillas I, Hubank M, Turner NC, Martín M. Baseline mutations and ctDNA dynamics as prognostic and predictive factors in ER-positive/HER2-negative metastatic breast cancer patients. Clin Cancer Res. 2023 Jul 25:CCR-23-0956. doi: 10.1158/1078-0432.CCR-23-0956. Epub ahead of print. PMID: 37490393.



