好文推荐 | 非膝状体动脉闭塞导致丘脑梗死临床特征
时间:2023-11-18 21:29:45 热度:37.1℃ 作者:网络
摘要:
目的 探索3条少见而特殊的丘脑动脉(丘脑结节动脉、丘脑穿通动脉、脉络膜后动脉)闭塞在病因学特征。
方法 收集48例膝状体动脉闭塞和19例非膝状体动脉闭塞的患者,比较两组患者临床表现和病因学分型差异。
结果 与膝状体动脉闭塞组相比,在症状学上,非膝状体动脉闭塞组表现为高级智能减退(0 vs 21.1%,χ2=10.747,P=0.001),膝状体动脉闭塞组在偏身感觉障碍(75% vs 21.1%,χ2=16.466,P<0.001)的比例高。在病因学上,非膝状体动脉闭塞组在大动脉粥样硬化型(29.17% vs 84.2%,χ2= 16.679,P<0.001)的比例高。在病灶体积上,非膝状体动脉组患者梗死体积较大(t=10.86,P<0.0001)。
结论 非膝状体动脉闭塞引起的丘脑梗死有自身特征:症状学上以高级智能减退为主、在病因学上大动脉粥样硬化型为主,因此在临床上针对此类患者应加强大血管病变的筛查。
丘脑从事各种功能,包括感觉处理、注意力、决策和记忆。丘脑被Y形的内髓板分为4大灰质区域,(1)前部:前核群,主要由起源于后交通动脉的丘脑结节动脉供血;(2)旁正中部:内侧核群,主要由起源于大脑后动脉P1段的丘脑穿通动脉供血;(3)下外侧部:外侧核群,主要由起源于大脑后动脉P2段的丘脑膝状体动脉供血;(4)后部:枕核,主要由起源于大脑后动脉P2段的脉络膜后动脉供血。临床上最常见的是丘脑膝状体动脉供血区梗死,其他动脉供血区梗死较少见,为了方便起见,本研究将其统称为丘脑非膝状体动脉。虽然每条动脉闭塞后引起的临床症状已经熟悉,但是丘脑非膝状体动脉闭塞的患者的病因学特征分析缺如。本研究,拟探讨非膝状体动脉闭塞导致的丘脑梗死的临床特点,以指导临床上遇到少见的丘脑非膝状体动脉闭塞诊治方案的选择。
1 资料与方法
1.1 病例选择 选择2018年10月1日-2022年9月31日在上海市松江区中心医院神经内科住院的患者共67例,在收集临床资料前均告知患者并签署知情同意书,经我院伦理委员会批准同意,伦理号{2018[审]039}。根据MRI显示丘脑梗死部位不同,将患者分为两组:(1)膝状体动脉闭塞组:48例,男性28例,女性20例,平均年龄为(62.96±10.14)岁;(2)非膝状体动脉闭塞组:19例,男性11例,女性8例,平均年龄为(69.20±6.87)岁。诊断按照中华医学会神经病学分会编写的《中国急性缺血性脑卒中诊治指南(2018版)》。
纳入标准:(1)年龄>18岁;(2)经头部弥散加权成像(diffusion weighted imaging,DWI)、T1、T2 Flair、ADC检查证实为丘脑梗死患者;(3)久居上海松江的;(4)查体合作者。
排除标准:(1)无法完善磁共振检查者,如金属植入者、有幽闭恐惧症患者等;(2)合并严重的肝肾功能不全者;(3)DWI显示合并其他部位脑梗死者;(4)昏迷者,不配合体格检查者;(5)明确其他病因导致脑梗者,如外伤、肿瘤、血液系统疾病等;(6)脑梗死的部位靠近脑室、脑沟、脑回边缘者,临床医生[JP3]与放射医生诊断不一致者;(7)DWI阴性脑梗死患者。
1.2 基线资料 通过本院HIS(Hospital Information System)系统整理患者的数据。(1)年龄、性别;(2)实验室资料,白细胞计数、红细胞计数、血红蛋白、血小板计数、中性粒细胞计数、丙氨酸氨基转移酶、天冬氨酸氨基转移酶、尿素、肌酐、甘油三酯、总胆固醇、高密度脂蛋白、低密度脂蛋白、血糖、糖化血红蛋白、血沉、同型半胱氨酸、B型钠尿肽、肌酸激酶同工酶、肌钙蛋白T、凝血酶原时间、国际标准化比值、活化部分凝血活酶时间、凝血酶时间、D-二聚体;(3)影像学资料;(4)临床特征:高级智能减退(指大脑高级中枢出现障碍,表现为性格改变,记忆障碍,反应迟钝,计算力、理解力下降,影响生活)、偏瘫、偏身感觉障碍、构音不清;(5)血管危险因素:糖尿病、高血压、吸烟、酗酒、心房颤动等。
1.3 病因学特征 通过TOAST(the Trial Org 10172 in Acute Stroke Treatment)分型系统实现,这是一种于1993年制订的,有效且方便的系统,用于全球中风研究,分为大动脉粥样硬化性卒中(Large-artery atherosclerosis,LAA),心源性脑栓塞(Cardioembolism,CE),小动脉闭塞性卒中或腔隙性卒中(Small-artery occlusion,SAA),其他原因所致的缺血性卒中(Stroke of other determinded etiology,SOE),不明原因的缺血性卒中(Stroke of undeterminded etiology,SUE)。
1.4 脑白质病变 程度评估Fazekas量表是脑室旁高信号评分+深部白质信号评分,总分为6分。脑室旁高信号评分:(1) 0分,无病变;(2) 1分,帽状或者铅笔样薄层病变;(3)2分,病变呈光滑的晕圈;(4)3分,不规则的脑室旁高信号,延伸到深部白质。深部白质信号:(1)0分,无病变;(2)1分,点状病变;(3)2分,病变开始融合;(4)3分,病变大面积融合。分级:0级,0分;1级,1~2分;2级,3~4分;3级,5~6分。
1.5 头部MRI检查 采用磁共振仪(上海联影医疗科技有限公司,型号:uMR 770,3.0T)进行头部断层扫描,参数为横断面层7 mm、间隔1 mm;矢状面层6 mm,间隔1 mm。使患者取仰卧位,磁共振仪器从胼胝体上缘开始往枕骨大孔扫描。急性缺血性脑卒中磁共振表现:T1WI上呈现低信号区,T2WI上呈现高信号区,DWI上也是呈现高信号区。本研究中的脑梗死包括急性和亚急性的脑梗死。应用OsiriX软件,在弥散加权成像序列上,通过手动划定感兴趣区域,在每个层面中,这些区域被添加,梗死灶长度(mm)和宽度(mm)×层面厚度=病灶体积(mm3)。
1.6 统计方法 采用SPSS 22.0软件进行数据分析的,定性资料以百分比(%)表示,采用卡方检验;定量资料以x±s表示,采用配对样本t检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 两组患者基线资料对比 两组患者年龄、性别、既往史、个人史等基线资料,差异无统计学意义(P>0.05)(见表1)。
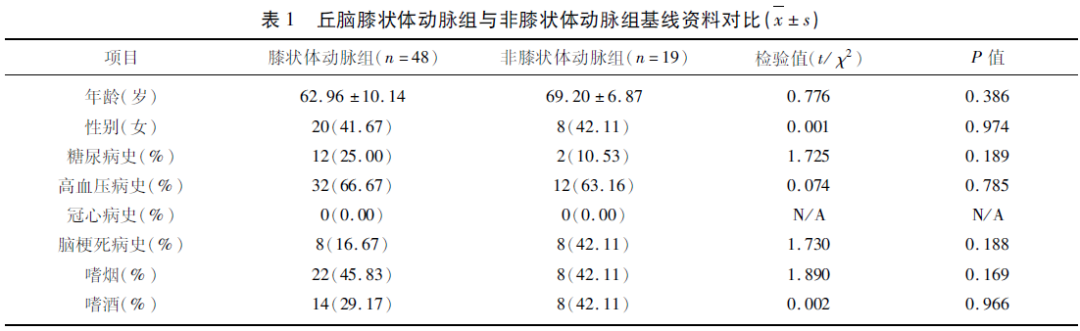
2.2 两组患者实验资料对比 与丘脑膝状体动脉组相比,非膝状体动脉组患者糖化血红蛋白水平低[(5.56±2.51) vs (6.40±2.01),t=5.333,P=0.029]、fT3水平低[(3.73±0.38) vs (4.40±0.60),t=2.392,P=0.024](见表2)。
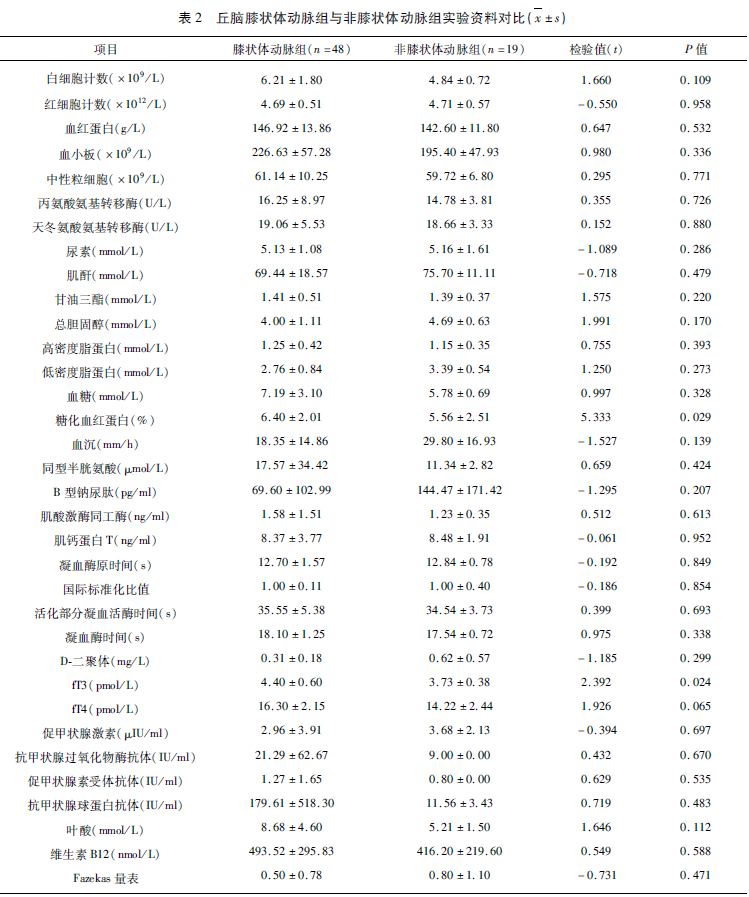
2.3 两组患者临床症状差别 与丘脑膝状体动脉组相比,非膝状体动脉组表现为高级智能减退的比例高(0 vs 21.05%,χ2=10.747,P=0.001)、表现为偏身感觉障碍的比例低(21.05% vs 75.00%,χ2=16.466,P<0.001)。两组患者在偏瘫、构音不清的症状相比,差异无统计学意义(P>0.05)(见表3)。
2.4 两组患者TOAST病因分型比较 与丘脑膝状体动脉组相比,非膝状体动脉组患者病因表现为大动脉粥样硬化性卒中(29.17% vs 84.21%, χ2= 16.679, P<0.001)的比例高;在不明原因的缺血性卒中、小动脉闭塞性卒中方面相比,两组的差异无统计学意义(P>0.05)。两组均未发现有其他原因所致的缺血性卒中、心源性脑栓塞病例(见表 3)。
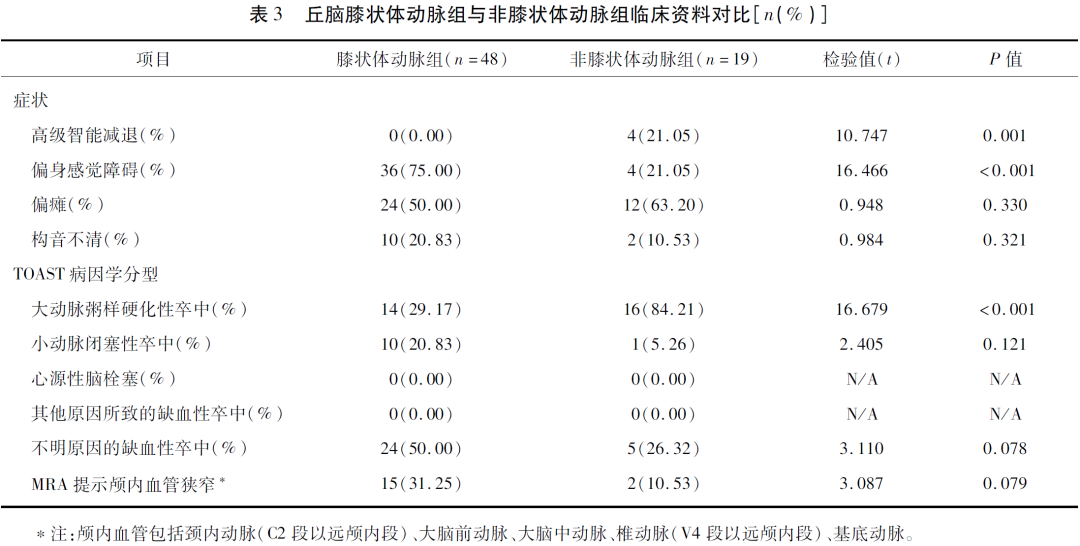
2.5 两组患者梗死体积的比较 与膝状体动脉组相比,非膝状体动脉组患者梗死体积较大(t=10.86,P<0.001)(见图1)。
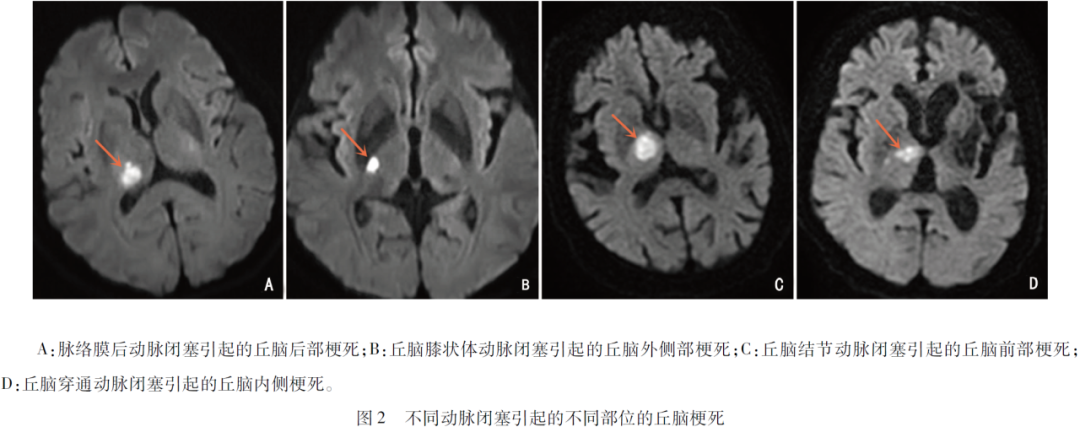
2.6 两组患者典型病例磁共振弥散加权成像图 不同的丘脑动脉闭塞可以引起的不同部位的丘脑梗死(见图2)。
3 讨论
丘脑主要由来自后交通动脉和大脑后动脉的P1和P2段的多个小血管供应。临床上,丘脑梗死常常被大家不规范的称为基底节梗死,累及丘脑四个部位(前部、后部、旁正中部、下外侧部)的梗死发生率差别很大,工作中最常碰到的是累及丘脑外侧部的梗死。本次研究发现,非膝状体动脉闭塞导致脑梗死较少见,发生率远远低于膝状体动脉闭塞,比例为1∶4.8。有研究显示丘脑膝状体动脉梗死是临床上最常见的丘脑梗死。这与我们研究相一致。其发生原因从解剖学上说,可能与丘脑膝状体动脉起源于大脑后动脉的P2段或周围段,与非膝状体动脉相比,膝状体动脉分支动脉较多(约为5~10条),所以更容易发生血管闭塞。
本研究发现,非膝状体动脉梗死主要表现为高级智能减退,可表现为远记忆、近记忆障碍和时间定向障碍,Dillingham等认为这可能由于丘脑投射受损导致乳头丘脑束与前核之间信号中断有关,O′Mara等也支持这一观点。有研究发现,高级智能减退与5-羟色胺、去甲肾上腺素和谷氨酸等神经递质的缺有关,其发生率最高的部位是丘脑结节动脉和丘脑穿通动脉区域,从解剖学上,这两动脉主要供应与丘脑高级智能有关的核团及神经纤维。丘脑前核的结构和功能连接的改变与衰老过程中的认知能力下降有关。丘脑前核具有许多支持情景记忆的关键认知功能。有报道1例左侧丘脑结状动脉闭塞丘脑前部梗死导致同侧面部和肢体不自主运动的症状。姜园等新近发现1例以眼睑下垂为临床表现的丘脑梗死,梗死部位为丘脑前内侧区域,该区域由丘脑结节动脉供血,该症状与该部位常见的表现例如认知、意识、行为、人格改变等不同。马浩源等有一过性的神经功能缺损(偏身麻木和乏力)为表现的双侧丘脑内侧梗死的报道。丘脑皮质网络功能障碍会导致丘脑失语症,这是一种罕见的语言障碍,由丘脑病变引起。由于标准语言测试可能经常无法发现其微妙的症状,丘脑失语症可能被低估。本次研究两组病例中,均未发现有失语的患者,可能与样本量较小有关。
本研究显示,约75%的膝状体动脉梗死患者出现偏身感觉障碍。可能是因为感觉传导必须经过丘脑,且膝状体动脉供应的腹后外核的损伤会出现对侧的深感觉障碍。既往也有研究发现,膝状体动脉梗死主要引起偏身感觉障碍、轻偏瘫,这与本次研究的结果相符合。Fazekas量表是对磁共振成像中的高信号白质信号异常评估的量表。脑白质高信号一般又称为脑白质疏松,是脑小血管病的一种。本次研究,Fazekas量表在膝状体动脉闭塞组和非膝状体动脉闭塞组中无差异[(0.50±0.780) vs (0.80±1.095),t=0.731,P=0.471],因此在临床工作中依靠Fazekas量表无法提示梗死部位在膝状体动脉还是非膝状体动脉供血区域。
有研究表明,丘脑梗死主要是小血管疾病。本次研究发现,与膝状体动脉闭塞相比,非膝状体动脉闭塞组的TOAST分型却以大动脉粥样硬化型较多,非膝状体动脉组患者梗死体积也较大,大动脉粥样硬化性卒中是指血管狭窄面积≥50%横截面积,梗死直径>1.5 cm的缺血性疾病。非膝状体动脉闭塞的原因主要为大动脉粥样硬化型。从动脉分支起源部位的角度分析,膝状体动脉较其他三条动脉的分支发出点更接近大脑后动脉的末端,该动脉管径较细、长度较短导致了膝状体动脉闭塞引起的梗死灶体积较小。本研究发现,无论是膝状体动脉还是非膝状体动脉的丘脑梗死,纳入研究的病例的病因学中,心源性栓塞和其他原因所致的卒中是极其少见的。Kumral等在7年内追踪研究了16例双侧丘脑梗死的患者发现,这些患者都是非膝状体动脉闭塞所引起,主要病因是首先是小动脉闭塞型,其次是心源性栓塞。从此可见,本次研究的目标群体单侧丘脑梗死,病因学上和双侧丘脑梗死有显著区别。
本研究缺陷为:首先,选取丘脑梗死的患者时已排除昏迷、查体不合作等患者,这可能对症状学的研究带来部分影响;其次,本研究选取了较为常见的单侧丘脑梗死,忽略双侧丘脑梗死以及合并累及其他部位的丘脑梗死的病例。最后,MRI、MRA、DWI等技术也存在不足(如:扫描厚度、扫描显影缺乏冠状位和矢状位等)也会对研究产生影响,新的技术如:7.0T磁共振成像和光谱磁共振会减少误差。
参考文献
[1]Roy DS,Zhang Y,Halassa MM,et al. Thalamic subnetworks as units of function[J]. Nat Neurosci,2022,25(2):140-153.
[2]Bordes S,Werner C,Mathkour M,et al. Arterial supply of the thalamus:a comprehensive review[J]. World Neurosurg,2020,137(5):310-318.
[3]郝悦含,伍博晰,何志义. 影像学表现为双侧丘脑病变的临床病例分析[J]. 中风与神经疾病杂志,2021,38(7):596-601.
[4]中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组. 中国急性缺血性脑卒中诊治指南2018[J]. 中华神经科杂志,2018,51(9):666-682.
[5]Adams HP Jr,Bendixen BH,Kappelle LJ,et al. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of org 10172 in acute stroke treatment[J]. Stroke,1993,24(1):35-4.
[6]Fazekas F,Chawluk JB,Alavi A,et al. MR signal abnormalities at 1.5 T in Alzheimer′s dementia and normal aging[J]. AJR Am J Roentgenol,1987,149(2):351-356.
[7]Matsumoto A,Hanayama H,Matsumoto H,et al. A case of posterior cerebral artery occlusion that developed into an artery of Percheron infarction[J]. Radiol Case Rep,2022,7(9):3046-3050.
[8]史丹丹,陈莉,罗天友,等. 慢性丘脑梗死患者全脑灰质体积改变及与认知功能减退的关系[J]. 中国医学影像技术,2016,32(5):683-687.
[9]Dillingham CM,Milczarek MM,Perry JC,et al. Mammillothalamic disconnection alters hippocampocortical oscillatory activity and microstructure:implications for diencephalic amnesia[J]. J Neurosci,2019,39(34):6696-6713.
[10]O′Mara SM,Aggleton JP. Space and memory(far) beyond the hippocampus:many subcortical structures also support cognitive mapping and mnemonic processing[J]. Front Neural Circuits,2019,13(8):1-12.
[11]Wu Q,Wang X,Wang Y,et al. Developments in biological mechanisms and treatments for negative symptoms and cognitive dysfunction of schizophrenia[J]. Neurosci Bull,2021,37(11):1609-1624.
[12]Roy DS,Zhang Y,Aida T,et al. Anterior thalamic circuits crucial for working memory[J]. Proc Natl Acad Sci U S A,2022,119(20):e2118712119.
[13]Aggleton JP,O′Mara SM. The anterior thalamic nuclei:core components of a tripartite episodic memory system[J]. Nat Rev Neurosci,2022,23(8):505-516.
[14]Li ZS,Fang JJ,Xiang XH,et al. Hemichorea due to ipsilateral thalamic infarction:A case report[J]. World J Clin Cases,2021,9(19):5287-5293.
[15]姜园,王霞,胡建军,等. 以同侧眼睑下垂为临床表现的丘脑梗死1例报告[J]. 中风与神经疾病杂志,2021,38(4):353-354.
[16]马浩源,贾彩云,宋怡瑶,等. 以TIA形式起病的Percheron动脉闭塞1例报告并文献复习[J]. 中风与神经疾病杂志,2019,36(7):654-656.
[17]Stockert A,Hormig-Rauber S,Wawrzyniak M,et al. Involvement of thalamocortical networks in patients with poststroke thalamic aphasia[J]. Neurology,2023,100(5):e485-e496.
[18]Fritsch M,Rangus I,Nolte CH. Thalamic aphasia:a review[J]. Curr Neurol Neurosci Rep,2022,22(12):855-865.
[19]Chen XY,Wang Q,Wang X,et al. Clinical features of thalamic stroke[J]. Curr Treat Options Neurol,2017,19(2):1-10.
[20]Bordes S,Werner C,Mathkour M,et al. Arterial supply of the thalamus:a comprehensive review[J]. World Neurosurg,2020,137(5):310-318.
[21]Graff-Radford J,Aakre JA,Knopman DS,et al. Prevalence and heterogeneity of cerebrovascular disease imaging lesions[J]. Mayo Clin Proc,2020,95(6):1195-1205.
[22]Gkal E,Sengü lY,Uslu F. Investigation of risk factors,topographic location and stroke mechanisms of unilateral isolated and posterior cerebral ARTERY thalamic infarcts[J]. Ideggyogy Sz,2019,72(7/8):251-256.
[23]Kumral E,Evyapan D,Balkir K,et al. Bilateral thalamic infarction. Clinical,etiological and MRI correlates[J]. Acta Neurol Scand,2001,103(1):35-42.
[24]Qureshi M,Qureshi M,Gul M,et al. Bilateral thalamic stroke as a cause of decreased responsiveness[J]. Cureus,2021,13(5):e14935.
[25]Fagan AJ,Bitz AK,Bjrkman-Burtscher IM,et al. ISMRM safety committee. 7T MR Safety[J]. J Magn Reson Imaging,2021,53(2):333-346.


