12例子宫外低级别子宫内膜间质肉瘤患者的回顾性分析及文献复习
时间:2024-06-02 06:00:31 热度:37.1℃ 作者:网络
子宫内膜间质肉瘤(endometrial stromal sarcoma,ESS)是一种恶性的子宫间叶源性肿瘤,在宫体恶性肿瘤中占比不到1%,女性生殖道恶性肿瘤中占比0.2%[1]。原发子宫外的子宫内膜间质肉瘤(extrauterine endometrial stromal sarcoma,EESS)是世界卫生组织(World Health Organization,WHO)2014年女性生殖器官肿瘤分类中新收录的间叶性肿瘤,非常罕见,目前未见其发病率的相关报道。迄今为止,笔者对PubMed和中国知网(CNKI)进行EESS检索,仅检索到97篇文献,其中样本量最大的是Masand团队报道的63例EESS[2]。卵巢、腹膜、肠壁是 EESS 的好发部位,病理学类型以低级别为主[2-3]。目前认为低级别子宫外子宫内膜间质肉瘤(low-grade extrauterine endometrial stromal sarcoma,LGEESS)患者的预后较好,但尚无统一的诊治指南。现有的诊疗方案多参考子宫ESS的指南,对可完整切除肿瘤的患者首选包括全子宫+双附件切除在内的肿瘤细胞减灭术,术后辅助治疗方式包括内分泌治疗、放疗、化疗等[4-5]。本文通过回顾性分析复旦大学附属妇产科医院诊治的12例LGEESS患者的临床资料和文献报道的案例,探讨其临床特点、病理学特征、治疗方法及预后情况,以期增加临床医师对该疾病的认识,并探索新的治疗思路。
1 资料和方法
1.1 研究对象
收集2010年1月—2023年3月复旦大学附属妇产科医院诊治的LGEESS患者12例。所有病理学检查经复旦大学附属妇产科医院病理科2名高年资深医师读片共同确认。LGEESS的诊断标准包括:① 肿瘤细胞核分裂象<10个/10个高倍镜视野并且细胞异型性低;② 肿瘤原发于子宫外,子宫内膜未见明显受侵;③ 若有子宫切除病史,必须经病理学检查证实无 ESS。排除标准:① 肿瘤原发于子宫,当前或既往有子宫内膜间质肉瘤史;② 子宫状态未知。本研究获复旦大学附属妇产科医院伦理委员会批准(伦理批号:2023-95)。所有患者均签署知情同意书。临床资料均由医院病历资料库取得,随访资料由门诊病历和2023年8月17日的电话随访获得。同时,在PubMed的检索界面以 “low-grade extrauterine endometrial stromal sarcoma”为检索式,检索1998年1月—2023年11月发表的LGEESS病例报道;在CNKI的“高级检索”界面以“[主题:低级别子宫外子宫内膜间质肉瘤(精确)]AND[篇关摘:例(精确)]”为检索式,收集1998年1月—2023年11月发表的LGEESS病例报道。患者临床病例信息严重缺失的案例被排除。
1.2 数据收集
收集患者的年龄、首发症状、月经史、生育史、子宫肌瘤相关手术史、术前B超、影像学及实验室检查报告、手术记录、术后病理学检查报告、治疗方式和随访结果。无进展生存期(progression-free survival,PFS)定义为自初次手术后第1天起至明确疾病进展或死亡/随访终点的时间。
1.3 统计学处理
使用EXCEL对所有数据进行收集整理。计数资料以例数及百分数表示,分析和描述病例的肿瘤部位、肿瘤大小、肿瘤数量、手术方式、内分泌治疗等基本特征及情况。
2 结 果
2.1 临床病理学特征
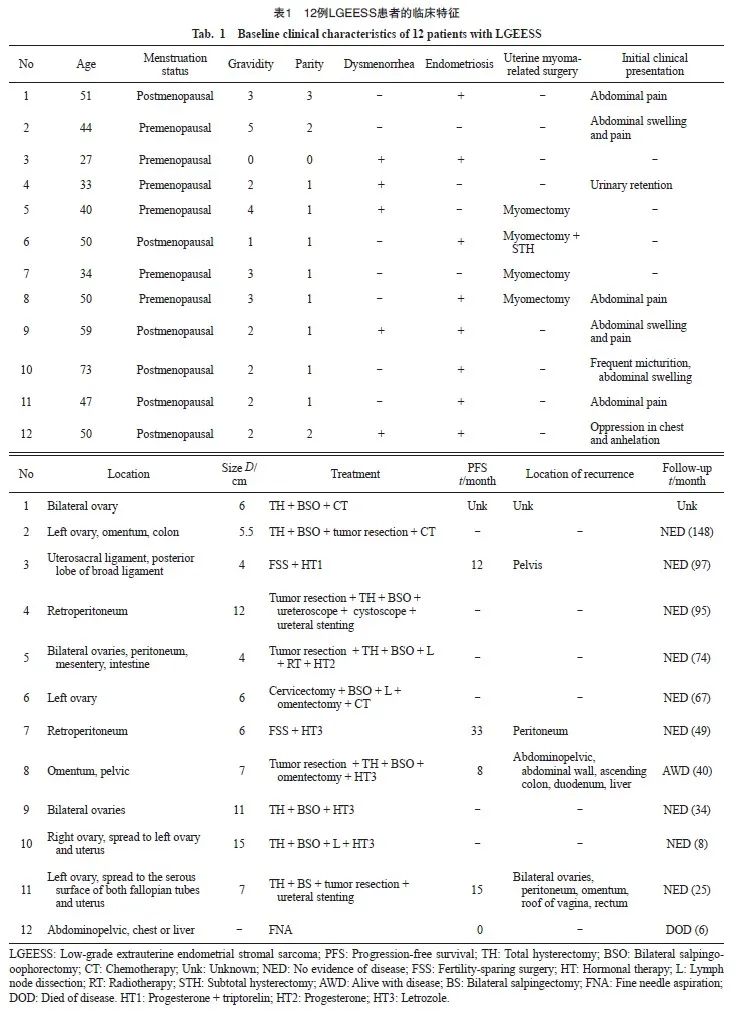
共纳入12例病历资料。患者的初次确诊年龄为27~73岁(中位年龄48.5岁),约50%的患者未绝经。除1例(病例3)外,其余患者均已分娩。腹胀和(或)腹痛是主要的首发症状,占50%,4例为体检发现盆腔肿块。症状的持续时间从数天到1年不等。8例患者合并子宫内膜异位症,占66.7%(表1)。
所有患者术前均行B超检查及CA12-5、CA19-9、HE4等血清肿瘤标志物检测。最大肿块直径均大于6 cm,其中7例超声提示低回声占位性病变,5例提示肿块血流丰富。仅1例(病例10)磁共振成像(magnetic resonance imaging,MRI)检查结果提示有淋巴结转移可能。1例患者(病例12)在就诊时MRI检查结果提示有胸腔和肝脏转移的可能。3例患者术前CA12-5水平轻度升高(病例1、病例7、病例12),均未高于100 U/mL,其中2例患者合并子宫内膜异位症,这可能也会导致CA12-5数值的升高。此外,这3例患者中1例患者术后CA12-5下降明显(病例1),1例在术后复发后CA12-5数值显著升高至209.7 U/mL(病例7)。血清CA19-9水平均在正常范围内。
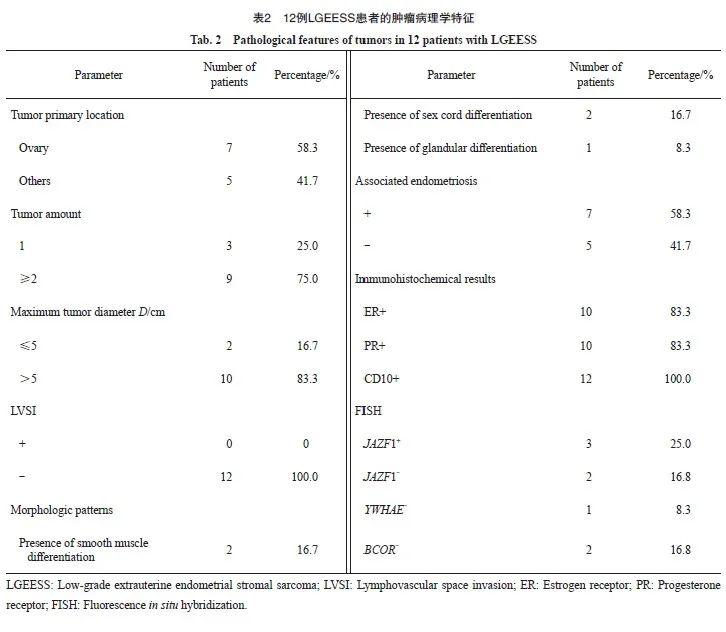
12例LGEESS患者的临床病理学特征见表2。肿瘤主要累及卵巢(7例),占58.3%。3例淋巴结清扫术术后病理学诊断结果均未提示淋巴结转移。对于有多个受累部位的病例,我们测量并描述其中体积最大的肿块。肿块最大直径在4~15 cm。显微镜下肿瘤组织可见平滑肌分化(2例)、性索样分化(2例)、腺体分化(1例)等非典型形态。7例患者病理学检查结果提示肿瘤起源于子宫内膜异位症。12例患者均进行了免疫组织化学检测。其中9例肿瘤中雌激素受体(estrogen receptor,ER)和孕激素受体(progesterone receptor,PR)均为阳性。此外,所有肿瘤细胞均为CD10阳性。通过荧光原位杂交(fluorescence in situ hybridization,FISH)分析,在5例肿瘤中发现3例有JAZF1基因易位。
2.2 治疗方式及预后
关于初始治疗,12例患者中有11例接受了手术治疗,1例患者(病例12)因广泛转移及个人因素放弃治疗。虽然肿瘤不累及子宫,但4例患者初始治疗时接受了全子宫+双附件切除术,1例接受了全子宫+双侧输卵管切除术+肿块切除术,1例既往子宫次全切术后,此次对其行残端宫颈+ 双附件切除术。3例未绝经的患者初次手术只切除了肿瘤,术后病理学检查确诊后补充了全子宫+双附件切除术。2例患者接受了保育手术治疗和术后辅助激素治疗,3例患者接受了淋巴结清扫术。5例患者接受了术后内分泌治疗(4例来曲唑治疗,1例孕激素+曲普瑞林治疗)。3例患者术后接受了化疗。对1例患者采用放疗联合孕激素治疗,2例患者术后未进行辅助治疗。
生存时间自确诊之日算起,随访时间截至 2023年8月17日。中位随访时间为49个月(范围:6~148个月),有1例患者失访。随访期间,共有4例患者分别在术后12、33、8和15个月出现复发。复发部位均位于盆腹腔,复发后均再次进行手术切除联合激素辅助治疗。在11例手术治疗的患者中,9例无病存活,1例带病存活。在病例12中,通过超声引导下腹腔肿物穿刺进行病理学诊断。患者病情进展快、迅速恶化,但患者拒绝进一步治疗,在电话随访时发现已经死亡(表1)。
2.3 文献病例分析
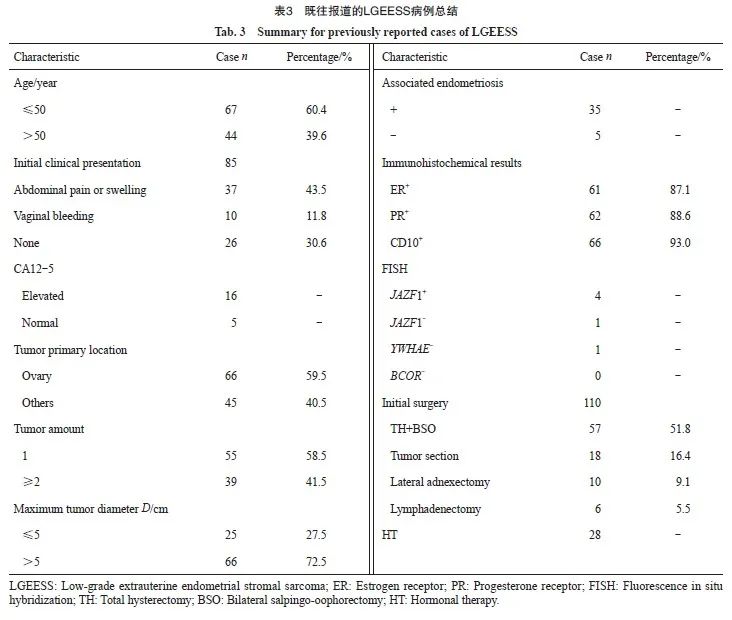
通过检索PubMed和CNKI,本研究收集了1998年1月—2023年11月发表的LGEESS中英文个案报道和系列病例报告,共111例病例纳入研究(表3)。111例患者的年龄范围为26~76岁,中位年龄为49岁。临床表现以腹痛、腹胀为主(43.5%),26例无临床症状,在检查中意外发现。确诊时16例报道了血清CA12-5升高(范围:37.5~473.2 U/mL)。肿瘤原发部位主要位于卵巢,占59.5%。据文献,有55例肿瘤表现为单发,39例肿瘤多发,17例未报告肿瘤数量。91例报道的肿瘤最大直径中有66例大于5 cm,占72.5%。35例LGEESS患者提示肿瘤来源于子宫内膜异位症。110例患者进行了手术治疗,其中57例接受了全子宫+双附件切除术,4例接受了双附件切除术,18例患者只接受了肿块切除术,对10例卵巢EESS患者进行患侧附件切除术,对6例行淋巴结清扫术,21例患者具体术式不详。33.7%(28/83)患者接受了术后辅助内分泌治疗。经过治疗,56.2 %(50/89)的患者获得缓解;12.4%(11/89)的患者肿瘤未获得完全缓解,带病生存中;21.3%(19/89)的患者术后复发;9例患者死亡。文献报道中的64例随访病例中,经过1~252个月的随访,27例行全子宫+双附件切除的患者无复发或进展,中位PFS为38个月(范围:1~156个月);14例行肿块切除或患侧附件切除的患者无复发或进展,中位PFS为37个月(范围:7~252个月);术后内分泌治疗的23例患者中20例无复发或进展,中位PFS为37个月(范围:1~121个月);术后未行内分泌治疗的34例患者中21例无复发或进展,中位PFS为38个月(范围:3~140个月)。
3 讨 论
LGEESS是一种罕见的低度恶性的子宫间叶源性肿瘤,发病年龄26~76岁,临床表现主要有腹痛腹胀、异常阴道流血等,缺乏特异性[6]。术前肿瘤指标CA12-5的水平也存在差异,仅在部分患者中升高。根据本研究中2例CA12-5升高患者的CA12-5变化情况,术前CA12-5水平的升高在其术后随访中可能具有一定意义。病理学诊断是确诊LGEESS的金标准,肿瘤典型的组织病理学特征为小圆形或短梭形的肿瘤细胞围绕经典的薄壁螺旋动脉样血管呈弥漫生长,结合CD10、ER、PR、desmin等免疫组织化学标记辅助诊断,与LGESS相类似[7]。本研究中有8例患者合并子宫内膜异位症,7例病理学检查结果提示肿瘤起源于子宫内膜异位症,既往文献报道病例的统计中有35例来源于子宫内膜异位症的LGEESS。研究[2]显示,60%~69%的EESS患者与子宫内膜异位症有关,因此有学者提出子宫内膜异位症恶变可能是EESS的发病机制,该假说在本研究中得到了证实。但目前尚无文献报道子宫内膜异位症与LGEESS预后的关联。近年来融合基因的检测逐渐用于ESS的诊断[7-8]中,JAZF1、SUZ12、PHF1、MEAF6等基因主要和LGESS相关,其中,JAZF1基因易位是LGESS中最常见的遗传变化,50%~60%的LGESS伴JAZF1基因融合,但在LGEESS中,JAZF1基因重排的阳性率明显低于子宫内LGESS,融合基因易位重排是否影响LGEESS的预后,其机制有待进一步研究。
LGEESS通常生长缓慢,与LGESS一样被认为是一种惰性的激素依赖性肿瘤[2],治疗方法尚无统一标准。其中手术治疗是首选,完整切除病灶是减少复发和进展的先决条件[4,9-10]。现有文献[11]报道的死亡病例几乎均为有残留病灶的患者。尽管LGEESS病灶通常不累及子宫,但目前手术方式多参考子宫内ESS的治疗,行全子宫、双附件及病灶切除术。而目前LGESS的保育手术已经逐步被大家认可和开展,一项153例LGESS的回顾性研究表明初次手术保留子宫和卵巢不影响OS[12-17]。文献报道中保育对象主要集中在ⅠA期患者和部分ⅠB期患者。术后随访中ⅠA期患者均未见复发,虽然ⅠB期患者部分出现复发,但生存结局良好,保育后总体成功妊娠率可达62.5%[12]。2018年,罗祎团队曾报道了1例阴道低级别ESS患者保育治疗的案例,患者在局部阴道肿块切除术后3年余成功自然受孕并分娩,术后5年肿瘤局部复发,但未见其他部位转移,再次给予局部病灶切除+辅助内分泌治疗后得到了完全缓解[18]。在本研究中,两例年轻患者初次治疗时接受了保留生育手术+术后辅助内分泌治疗,分别在初次术后12和33个月复发,复发后均进行全子宫+双附件切除+病灶切除术,术后辅助内分泌治疗。但两例患者二次术后病理学诊断报告均未提示病变累及子宫或卵巢,截至目前,两例患者均未出现二次复发,PFS分别达到了83和11个月。因此,对于经过评估和筛选的LGEESS患者,在完整切除病灶的前提下,短期内保留子宫和卵巢具有一定可行性,尤其对于年轻有强烈保留生育期望的育龄期患者,完整切除子宫外病灶可作为手术选择。后续通过辅助生殖技术或卵巢组织冻存、取卵等方式,为提高患者的生育能力和生活质量提供可能。LGEESS的保留生育治疗是一项艰巨的任务,需要多学科团队合作,其中包括评估保留生育功能的可行性、手术完整切除病灶、术后辅助治疗、妊娠准备,妊娠后长期管理等[13]。
内分泌治疗是LGESS患者的主要术后辅助治疗手段,放疗和化疗的应用逐步减少。有报道称内分泌治疗可延长 Ⅰ期LGESS患者的无复发生存期(relapse-free survival,RFS),接受孕激素治疗的患者平均RFS为306.2个月(95% CI: 259.7~352.6),而未接受辅助内分泌治疗的患者平均RFS为90.8个月(95% CI: 56.8~124.9)[4,19]。12例病例中,有6例接受了术后内分泌治疗,主要以来曲唑治疗为主;在术后复发的4例病例中,内分泌治疗组最长无病生存期为33个月,而无内分泌治疗组最长无病生存期为15个月。尽管目前缺乏大样本研究,但内分泌治疗也逐渐应用于LGEESS患者的术后辅助治疗[4,20],其可行性值得进一步研究。
综上所述,LGEESS的临床表现缺乏特异性,其合并子宫内膜异位症的比例较高,临床病理学特征与子宫内LGESS相似。治疗的首要原则是完整切除病灶,避免残留。如果患者有强烈的保留生育意愿,在充分告知风险的前提下,经过多学科团队评估,可在密切监护下试行保留生育治疗。完善LGEESS患者保留生育治疗,探讨辅助内分泌治疗的可行性及具体实施方案是未来的研究方向。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
史佳璐:收集与分析数据、文献调研与整理、绘制图表、起草论文;朱婷婷:文献调研与整理、设计论文框架、修订论文;陶祥:收集数据、修订论文;马凤华:收集数据、修订论文;林芝:收集数据、修订论文;邵珺:审核并修订论文;赵宇清:提出研究方向、设计研究方案、审核并修订论文。
[参考文献]
[1] ALI R H, ROUZBAHMAN M. Endometrial stromal tumors revisited: an update based on the 2014 WHO classification[J]. J Clin Pathol, 2015, 68(5): 325-332.
[2] MASAND R P, EUSCHER E D, DEAVERS M T, et al. Endometrioid stromal sarcoma: a clinicopathologic study of 63 cases[J]. Am J Surg Pathol, 2013, 37(11): 1635-1647.
[3] OLIVA E, EGGER J F, YOUNG R H. Primary endometrioid stromal sarcoma of the ovary: a clinicopathologic study of 27 cases with morphologic and behavioral features similar to those of uterine low-grade endometrial stromal sarcoma[J]. Am J Surg Pathol, 2014, 38(3): 305-315.
[4] WU Y, LI N, ZHANG R, et al. Primary low-grade extrauterine endometrial stromal sarcoma: analysis of 10 cases with a review of the literature[J]. World J Surg Oncol, 2022, 20(1): 17.
[5] XIE W M, BI X N, CAO D Y, et al. Primary endometrioid stromal sarcomas of the ovary: a clinicopathological study of 14 cases with a review of the literature[J]. Oncotarget, 2017, 8(38): 63345-63352.
[6] MASAND R P. Unusual presentations of gynecologic tumors: primary, extrauterine, low-grade endometrioid stromal sarcoma[J]. Arch Pathol Lab Med, 2018, 142(4): 536-541.
[7] 王富强, 谭改民. 子宫外子宫内膜间质肉瘤6例临床病理分析[J]. 临床与实验病理学杂志, 2017, 33(5): 565-567.
WANG F Q, TAN G M. Clinicopathological analysis of 6 cases of extrauterine endometrial stromal sarcoma[J]. Chin J Clin Exp Pathol, 2017, 33(5): 565-567.
[8] SUN L L, ZHAO W, ZHAO Z H, et al. JAZF1, YWHAE and BCOR gene translocation in primary extrauterine low-grade and high-grade endometrial stromal sarcomas[J]. Histopathology, 2022, 80(5): 809-819.
[9] GNANGNON F H R, LAWANI I, NATTA N’TCHA H N, et al. A giant metastatic low-grade endometrial sarcoma requiring surgical management[J]. Int J Surg Case Rep, 2022, 94: 107163.
[10]ABU JAMEA G A, AL RIKABI A C, AKKOUR K. Primary low-grade endometrial stromal sarcoma arising in the vagina: report of an unusual case and literature review[J]. J Surg Case Rep, 2017, 2017(11): rjx238.
[11]WANG Q, ZHAO X, HAN P. Endometrial stromal sarcoma arising in colorectal endometriosis: a case report and review of the literature[J]. Case Rep Obstet Gynecol, 2015, 2015: 534273.
[12]XIE W M, CAO D Y, YANG J X, et al. Fertility-sparing surgery for patients with low-grade endometrial stromal sarcoma[J]. Oncotarget, 2017, 8(6): 10602-10608.
[13]LAUFER J, SCASSO S, KIM B, et al. Fertility-sparing management of low-grade endometrial stromal sarcoma[J]. Int J Gynecol Cancer, 2023, 33(7): 1145-1149.
[14]PIĄTEK S, SZYMUSIK I, DAŃSKA-BIDZIŃSKA A, et al. Fertility-sparing management may be considered in young women with uterine sarcoma[J]. J Clin Med, 2022, 11(16): 4761.
[15]DONDI G, PORCU E, PALMA A D, et al. Uterine preservation treatments in sarcomas: oncological problems and reproductive results: a systematic review[J]. Cancers, 2021, 13(22): 5808.
[16]GU Y Z, DUAN N Y, CHENG H X, et al. Fertility-sparing surgeries without adjuvant therapy through term pregnancies in a patient with low-grade endometrial stromal sarcoma: a case report[J]. World J Clin Cases, 2021, 9(4): 983-991.
[17]BAI H M, YANG J X, CAO D Y, et al. Ovary and uterus-sparing procedures for low-grade endometrial stromal sarcoma: a retrospective study of 153 cases[J]. Gynecol Oncol, 2014, 132(3): 654-660.
[18]罗 祎, 尹楠林, 曹 毅, 等. 阴道子宫内膜间质肉瘤5年后局部复发病例临床病理观察(病例报道+文献复习)[J]. 重庆医科大学学报, 2018, 43(3): 473-476.
LUO Y, YIN N L, CAO Y, et al. Clinicalpathological observation of local recurrence cases after 5 years of vaginal endometrial sarcoma[J]. J Chongqing Med Univ, 2018, 43(3): 473-476.
[19]DESHMUKH U, BLACK J, PEREZ-IRIZARRY J, et al. Adjuvant hormonal therapy for low-grade endometrial stromal sarcoma[J]. Reprod Sci, 2019, 26(5): 600-608.
[20]SQALLI HOUSSAINI M, HALOUA M, MOURABITI A Y, et al. A case of ovarian endometrial stromal sarcoma: radiological and histopathological findings[J]. Radiol Case Rep, 2023, 18(10): 3529-3534.


