Cell host & microbe:“神药”翻车了?!阿司匹林诱发胃肠道损伤的机制找到了!但补充这个可以缓解
时间:2024-06-06 21:00:46 热度:37.1℃ 作者:网络
阿司匹林因其镇痛、抗血小板和潜在的抗肿瘤效果,而成为医药史上三大经典药物之一。此外,阿司匹林还可以用于预防心脏病、中风、甚至某些类型的癌症,被誉为“百年神药”。
但一直以来,阿司匹林诱发的胃肠道损伤备受关注。已有研究表明,阿司匹林可调节肠道微生物群及相关代谢产物,但其对肠道稳态的影响仍不清楚。
近日,西安交通大学研究团队在cell host & microbe杂志发表了研究成果发现:阿司匹林可通过抑制肠道微生物—金氏副拟杆菌(P. goldsteinii)的生长及减少其代谢物7-酮石胆酸(7-keto-LCA)产生来诱发肠损伤;但补充金氏拟杆菌或7-酮石胆酸,能够改善阿司匹林诱发的肠损伤。

一、研究内容与思路
1、阿司匹林会导致肠道菌群失调
研究者收集了23名健康志愿者口服阿司匹林前(BA)和口服阿司匹林后(AA)的粪便样本,分别进行宏基因组测序分析。
结果发现,阿司匹林治疗后Simpson指数下降,且PCA分析结果显示肠道菌群组成发生了很大的改变,进一步分析显示副拟杆菌(Parabacteroides)是导致群体分离的主要肠道菌群。物种丰度分析显示,金氏副拟杆菌(P. goldsteinii)、粪副拟杆菌(P. merdae)、和迪氏副拟杆菌(P. distasonis)的丰度均减少。
基于上述结果,作者开展了动物实验,发现口服阿司匹林会改变肠道微生物群组成。同样,金氏副拟杆菌的a-多样性和丰度也呈时间依赖性下降。综上所述,阿司匹林在人类和小鼠中会引起肠道生态失调,其特征是金氏副拟杆菌丰度降低。
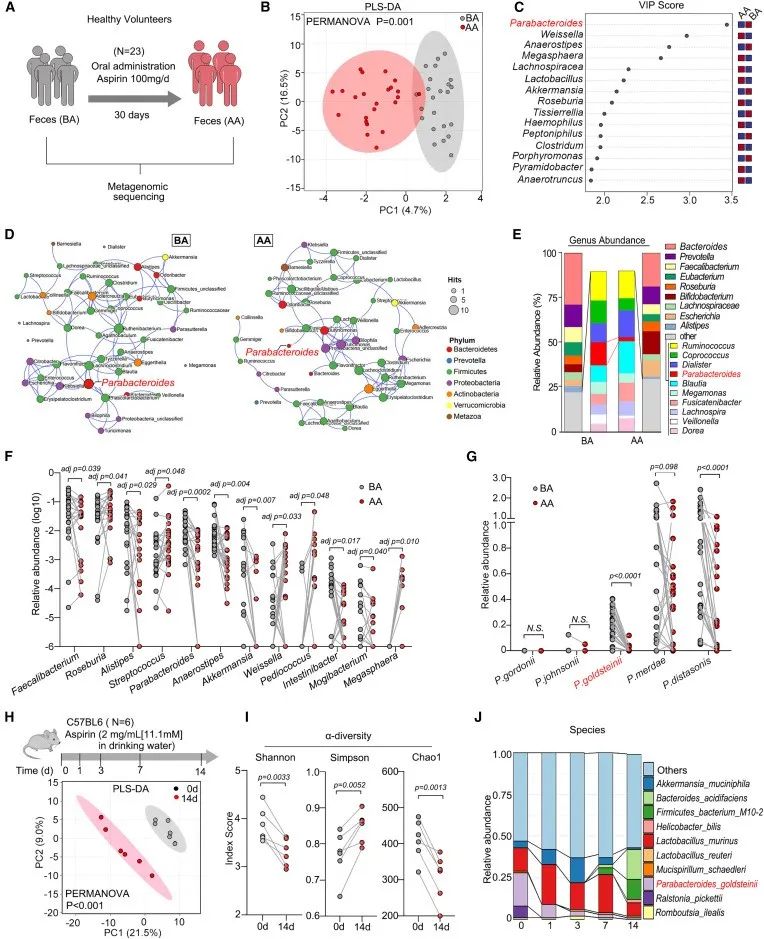
研究思路1:作者研究目的明确,探讨阿司匹林对肠道的影响。对此,作者收集了患者服用阿司匹林前后的粪便进行测序,发现肠道菌群发生显著改变,进一步分析结合动物实验发现金氏副拟杆菌。
2、阿司匹林损害肠道屏障功能并导致肠道损伤
对阿司匹林治疗小鼠的肠道损伤进行评分,发现金氏副拟杆菌的丰度与肠道损伤严重程度呈负相关。分析比较发现,相比于生理盐水组小鼠,阿司匹林组和新霉素组小鼠肠道菌群多样性均减少,尤其是金氏副拟杆菌。
此外,阿司匹林组和新霉素组小鼠肠黏膜变薄、肠通透性增加、肠道出血发生率升高,细胞凋亡增加,表明阿司匹林治疗后肠道屏障受损。有趣的是,正常小鼠的粪便菌群移植(FMT)改善了在阿司匹林治疗小鼠中观察到的异常表型。
综上所述,这些数据表明阿司匹林可能通过诱导肠道生态失调和抑制金氏副拟杆菌而损害肠道屏障功能。
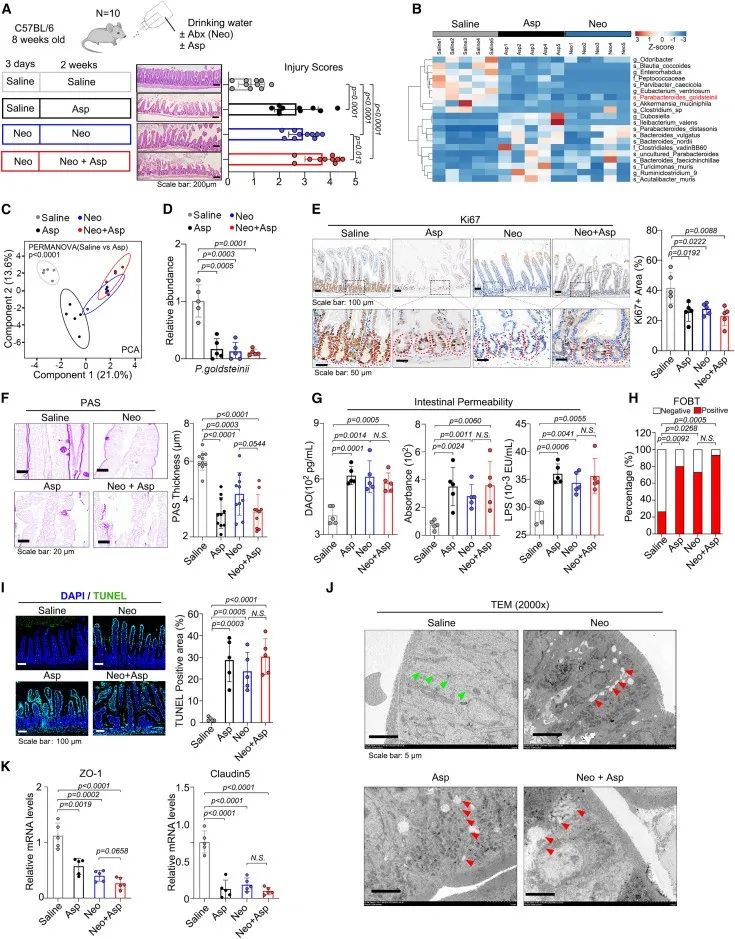
研究思路2:找到了金氏副拟杆菌这一主角后,下面便是进行实验验证,明确金氏副拟杆菌是否的确与阿司匹林破坏肠道稳态相关。对此,作者设计了肠道菌群移植实验,发现当肠道菌群正常时,肠道稳态逐渐恢复正常,表明金氏副拟杆菌在肠道稳态中的重要性。
3、被阿司匹林耗尽的金氏副拟杆菌可恢复胆汁酸代谢物谱
阿司匹林对金氏副拟杆菌的生长抑制呈剂量依赖性,非靶向代谢组学分析显示,阿司匹林相关代谢物与氨基酸代谢相关的化合物有关,其中,L-谷氨酰胺、瓜氨酸和L-脯氨酸是网络互作分析中的核心成分。对此,作者验证发现,补充L-谷氨酰胺和瓜氨酸可以抵消阿司匹林对金氏副拟杆菌生长的抑制。
此外,阿司匹林治疗后肠道胆汁酸池减少,包括牛磺α/β-鼠胆酸(Tα/βMCA)、熊去氧胆酸(UDCA)和7酮基石胆酸(7-keto-LCA),金氏副拟杆菌的丰度与胆汁酸水平呈正相关,移植金氏副拟杆菌可以有效恢复以上胆汁酸代谢物水平。宏基因组分析结果显示,阿司匹林治疗后,hdhA基因(编码7-α-HSDH)拷贝数显著减少,而hdhA编码的7-a-HSDH能够在体内和体外将CDCA转化为7-keto-LCA和UDCA,以及在小鼠中转化为βMCA。对此,作者检测发现金氏副拟杆菌在体外产生7-keto-LCA,但不产生UDCA。
综上所述,这些结果表明,阿司匹林消耗的金氏副拟杆菌可以在一定程度上恢复肠道胆汁酸谱的稳态。
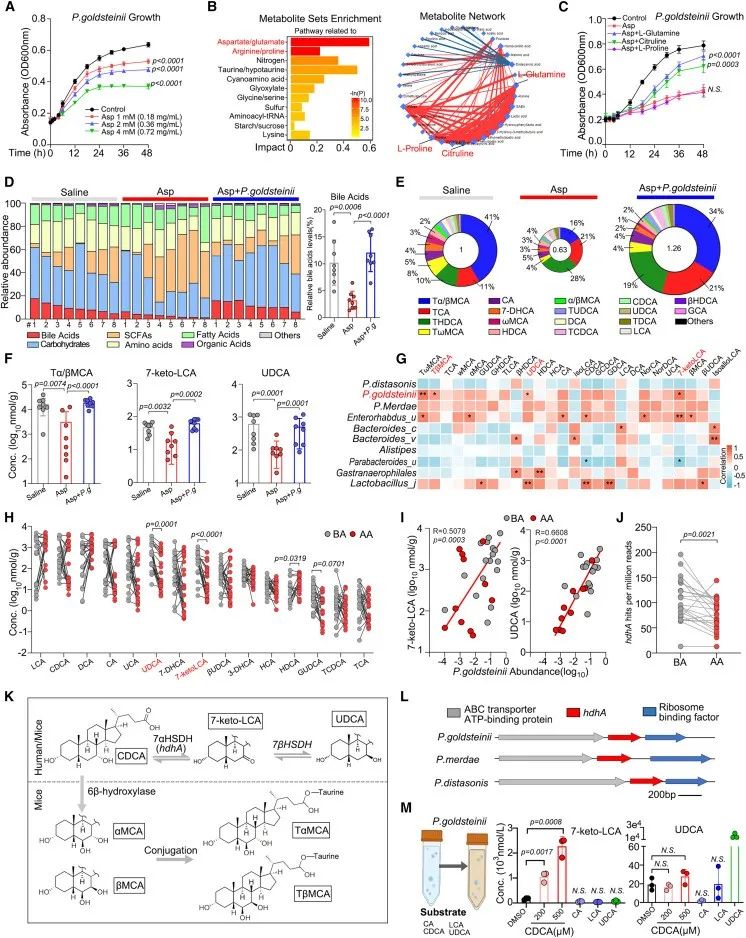
研究思路3:金氏副拟杆菌究竟是如何发挥调节肠道稳态的作用的?肠道菌群常与代谢相联系,对此,作者进行了代谢组学分析,发现了氨基酸代谢以及胆汁酸代谢。在这里,作者将研究目光集中在胆汁酸代谢环节,探讨了金氏副拟杆菌如何调节的胆汁酸代谢,发现了7-keto-LCA这另一个主角。
4、金氏副拟杆菌通过hdhA改善阿司匹林诱导的肠道损伤
敲除hdhA基因构建了hdhA缺陷突变株(PG-hdhA),且证明突变株不能将CDCA转化为7-keto-LCA。研究发现,LPG(活的金氏副拟杆菌)和PGwt(野生型金氏副拟杆菌)改善了损伤评分,而不是HPG(加热灭活的金氏副拟杆菌)或PG-hdhA可以改善阿司匹林导致的肠道损伤、包括肠道通透性、肠道粘液屏障损伤以及细胞凋亡等。
此外,这一实验还说明了hdhA参与了7-keto-LCA的生成,相比于移植PG-hdhA,移植了LPG或PGwt的小鼠7-keto-LCA生成增加。PAS染色发现胆汁酸代谢产物在维持肠道粘液屏障和保存杯状细胞方面起到重要作用。
这些数据表明,金氏副拟杆菌以及它通过hdhA产生的胆汁酸可以改善阿司匹林引起的肠道损伤。
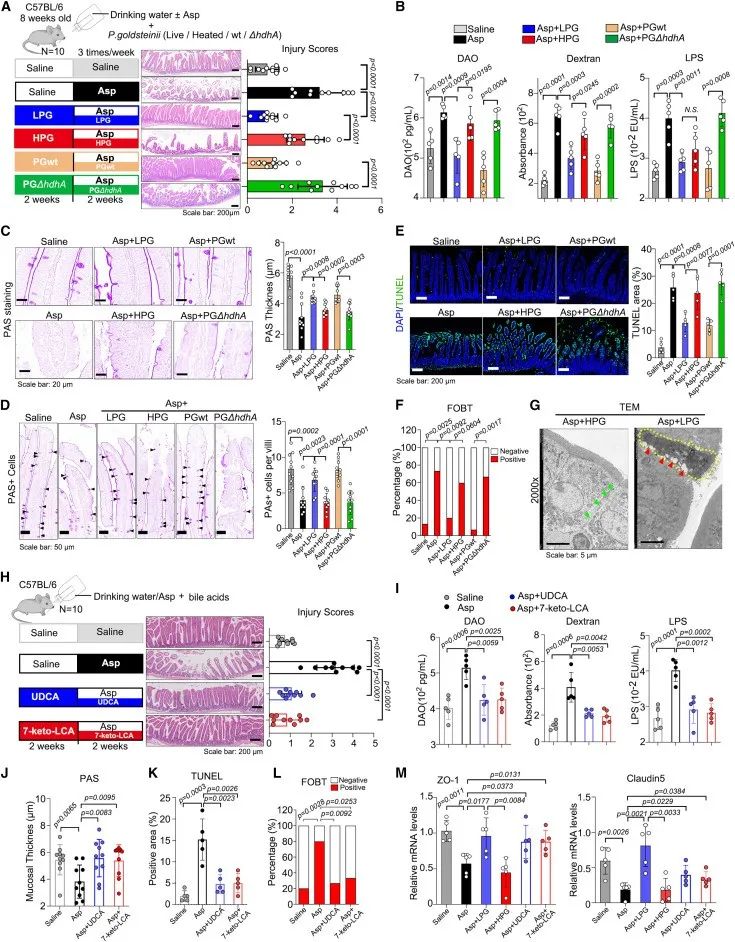
研究思路4:金氏副拟杆菌在体外产生7-keto-LCA,但不产生UDCA。那么,7-keto-LCA又是通过hdhA基因编码产生的,对此,作者探讨了金氏副拟杆菌与hdhA基因之间的联系。
5、胆汁酸受体FXR介导阿司匹林对肠道的影响
FXR是一种胆汁酸受体,在肠干细胞扩增和肠道屏障中起关键作用。对此,作者构建了肠道特异性敲除FXR小鼠模型(FXR-IE小鼠)。用阿司匹林治疗全身特异性敲除FXR(FXRfl/fl)和FXR-IE小鼠,结果发现,所有小鼠肠道损伤、肠道屏障破坏、生长抑制、细胞凋亡、粘膜厚度均严重增加。
16S测序分析发现,阿司匹林改变了FXRfl/fl和FXR-IE小鼠微生物群的主要组成,其中,金氏副拟杆菌的相对丰度都降低了,表明金氏副拟杆菌的抑制是由阿司匹林直接诱导的,而不是肠道损伤的结果。
综上所述,FXR部分介导了阿司匹林对肠道的影响。
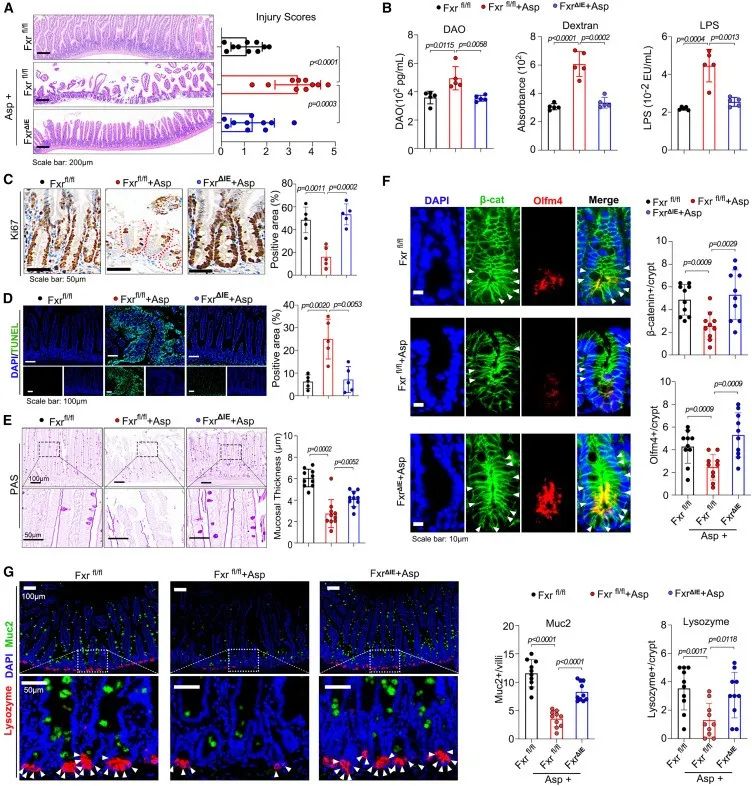
研究思路5:FXR是一种胆汁酸受体,在肠干细胞扩增和肠道屏障中起关键作用,而之前已经提到阿司匹林会影响肠道的胆汁酸代谢。对此,作者想要研究FXR受体在阿司匹林影响肠道稳态中发挥的作用。
6、金氏副拟杆菌通过调节胆汁酸代谢促进肠道自我更新
之前已有文献报道:胆汁酸代谢在肠道干性中发挥重要作用。对此,作者开展了小鼠实验以及肠道类器官实验发现司匹林抑制了肠道壁龛中的细胞增殖、抑制类器官形成,而金氏副拟杆菌移植后可以显著改善这一现象。
对此,作者进一步评估了金氏副拟杆菌对肠道干细胞的影响,发现与HPG共培养的类器官相比,LPG共培养的类器官的增殖能力增加,凋亡百分比降低,杯状细胞和潘氏细胞的数量也有所增加,干细胞指标物表达增加。
此外,UDCA和7-keto-LCA都消除了对阿司匹林诱导的类器官细胞增殖的抑制,恢复了肠道干细胞增殖功能。这些数据表明,金氏副拟杆菌及其胆汁酸代谢物有助于在肠道自我修复过程中维持肠道干细胞功能。
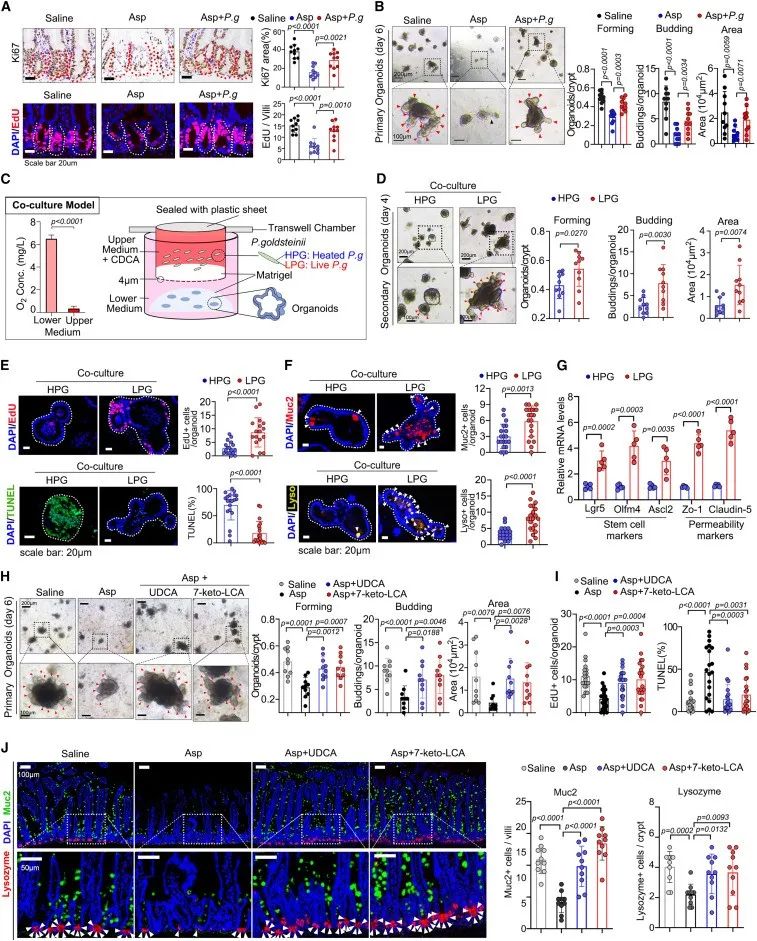
研究思路6:既然FXR这个胆汁酸受体部分介导了阿司匹林对肠道的影响,而FXR在肠干细胞中发挥重要作用。那么,在服用阿司匹林后,金氏副拟杆菌对肠干细胞有无影响?UDCA和7-keto-LCA这些代谢产物对于肠干细胞又有什么影响。
7、FXR拮抗剂7-Keto-LCA促进Wnt信号传导和干细胞增殖
UDCA和TβMCA都是被证实的肠道FXR拮抗剂,对此,作者测试了7-keto-LCA对FXR的作用。作者对经过胆汁酸处理的肠道类器官进行RNA测序及PCR验证发现,UDCA和7-keto-LCA都促进了干细胞特征(Lgr5-Ascl2)的表达。此外,7-keto-LCA治疗抵消了观察到的许多基因的抑制,最明显的是那些参与Wnt信号传导和增殖相关途径。
共免疫沉淀(coIP)研究显示,UDCA和7-keto-LCA处理后,FXR-β-catenin相互作用水平增加。这些数据表明,FXR拮抗剂7-keto-LCA促进Wnt信号传导以保持肠隐窝细胞的干性。
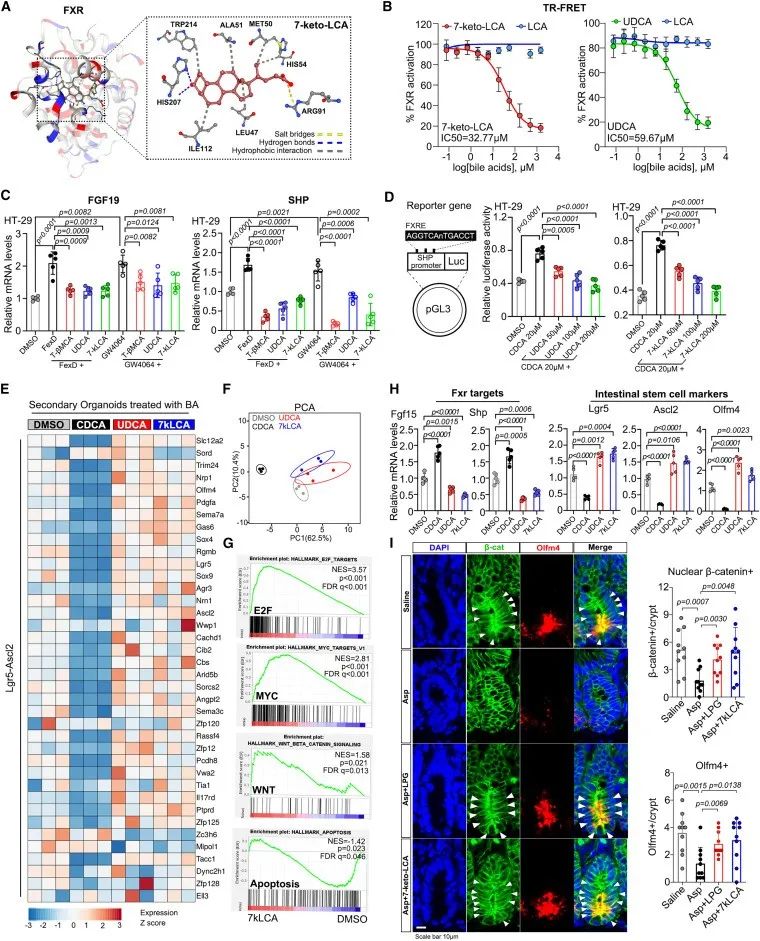
研究思路7:金氏副拟杆菌可以分泌7-keto-LCA,7-keto-LCA可以恢复了肠道干细胞增殖功能,而之前已经证明了金氏副拟杆菌对FXR的作用。那么,7-keto-LCA对FXR存在什么作用。
二、小结
作者采用测序发现,服用阿司匹林后肠道菌群丰度改变,进一步结合动物实验发现主角「金氏副拟杆菌」。之后深入挖掘,首先表明金氏副拟杆菌的确是在阿司匹林影响肠道稳态中发挥重要作用,接下来又发现它通过影响胆汁酸代谢来发挥的调节作用。进一步围绕胆汁酸代谢展开实验,发现7-keto-LCA,继而发现其作用机制。
该研究揭示了阿司匹林通过影响肠道细菌-胆汁酸代谢导致肠道损伤的新机制,并提出了预防阿司匹林诱导肠道损伤的潜在方法——肠道屏障功能受损的后续表型和胃肠道疾病的干性可能通过补充胆汁酸代谢产物和肠道共生菌而可逆。
参考文献:
[1]Li, T., Ding, N., Guo, H., Hua, R., Lin, Z., Tian, H., Yu, Y., Fan, D., Yuan, Z., Gonzalez, F. J., & Wu, Y. (2024). A gut microbiota-bile acid axis promotes intestinal homeostasis upon aspirin-mediated damage. Cell host & microbe, 32(2), 191–208.e9. https://doi.org/10.1016/j.chom.2023.12.015


