NPJ:首例原发性EGFR 19del/CDK4扩增NSCLC获益奥希替尼联合哌柏西利
时间:2024-06-09 22:00:29 热度:37.1℃ 作者:网络
肿瘤精准医学已经改变了携带特定分子变异的非小细胞肺癌(NSCLC)患者的治疗格局。目前非小细胞肺癌面临的一个主要挑战是如何管理肿瘤细胞对靶向治疗产生的耐药性,无论是原发性还是获得性耐药。本文报告了一名 61 岁的男性患者,患有转移性NSCLC,携带EGFR 19号外显子缺失(19del)、PIK3CA突变和CDK4扩增。患者最初对奥希替尼单药治疗(第三代EGFR酪氨酸激酶抑制剂)有部分反应,但在治疗 4 个月后病情进展,被转诊接受奥希替尼和哌柏西利(CDK4/6抑制剂)联合治疗。尽管并发一过性肺炎,但患者持续部分缓解超过 10 个月,并且通过这种治疗方案获得了临床改善。由于约 10% EGFR突变NSCLC初治患者会出现CDK4扩增,因此本文患者使用奥希替尼和哌柏西利的成功治疗可能对未来的NSCLC患者具有重要意义。

背 景
12–15% 的欧洲非小细胞肺癌(NSCLC)患者和 30–50% 的亚洲NSCLC患者携带表皮生长因子受体(EGFR)突变。目前,对于携带EGFR敏感突变(不包括 20 号外显子插入突变)的晚期NSCLC患者的标准治疗是使用第一代、第二代或第三代EGFR酪氨酸激酶抑制剂(TKI)进行一线系统性治疗,可联合或不联合单克隆抗体(如贝伐珠单抗和雷莫芦单抗),具体取决于EGFR突变类型。对于最常见的两种EGFR突变(即19del或L858R),首选的一线治疗是第三代EGFR TKI奥希替尼或第一代EGFR TKI与VEGFR2抑制剂厄洛替尼-雷莫芦单抗的组合。根据FLAURA2试验的结果,对于携带常见EGFR突变的转移性NSCLC患者,这种标准一线治疗可能会被奥希替尼联合化疗取代。
与其它靶向疗法一样,接受奥希替尼治疗的转移性EGFR阳性NSCLC患者将不可避免地经历疾病进展。疾病进展可能是由原发性耐药性引起的,其中发生的共突变会绕过奥希替尼的作用或阻止其与突变蛋白结合;也可能是由获得性耐药性引起的,这是由于肿瘤细胞暴露于特定靶向疗法期间产生其它分子变异。奥希替尼常见获得性耐药机制包括EGFR C797X突变和MET扩增。奥希替尼的主要耐药机制包括磷脂酰肌醇-4,5-二磷酸 3-激酶催化亚基α(PIK3CA)突变、肿瘤蛋白53(TP53)突变,还有细胞周期基因变异,包括细胞周期蛋白依赖性激酶4(CDK4)或细胞周期蛋白依赖性激酶6(CDK6)的扩增。治疗前存在的CDK4或CDK6扩增此前已被发现与EGFR敏感突变NSCLC患者对第一代或第二代EGFR TKI的原发耐药有关。重要的是,在约 10% 的EGFR突变转移性非小细胞肺癌初治患者中会发生CDK4扩增。
本文描述了一名新诊断的转移性NSCLC患者,该患者携带常见的EGFR突变、PIK3CA突变和CDK4扩增,在使用奥希替尼单药治疗后出现疾病进展,该患者从奥希替尼和哌柏西利联合治疗中获益。治疗开始和治疗结束的时间线如图1所示。
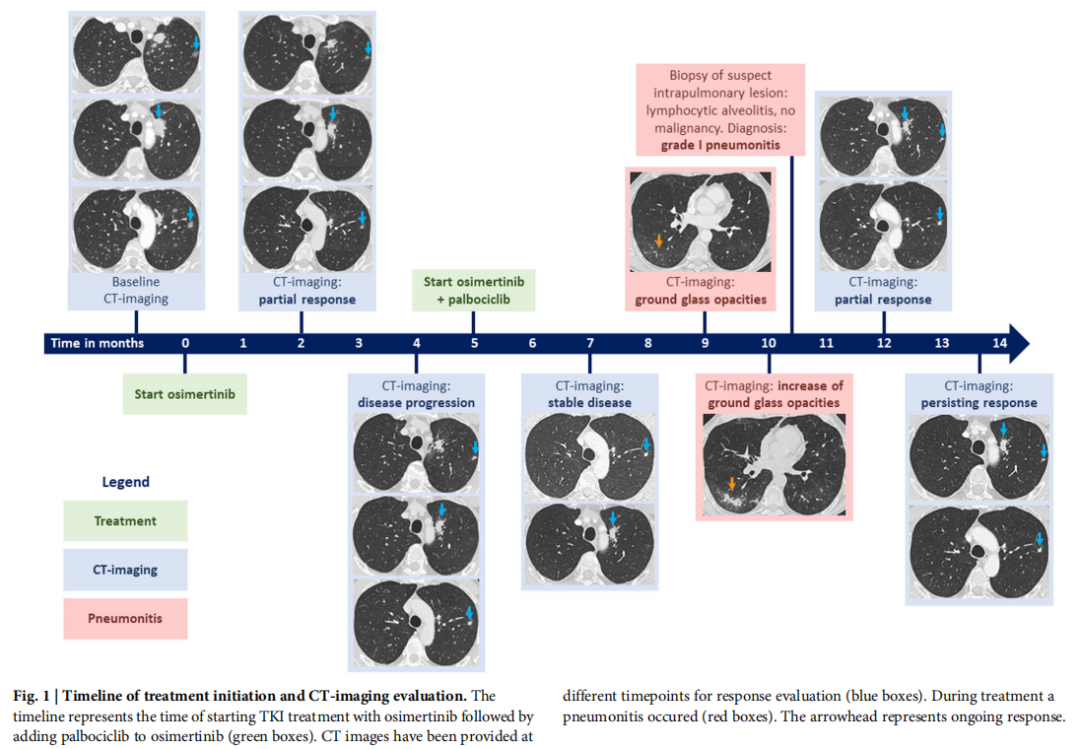
▲患者治疗时间线和CT影像学评估
病 例
患者男,61 岁,无肿瘤病史,被诊断为左肺上叶肺腺癌,并伴有肺内和骨转移(T4N2M1c)。使用NGS panel进行了肿瘤测序,肿瘤细胞占比为 30%,检测显示存在EGFR c.2235_2249del15(p.Glu746_Ala750del)突变(19 号外显子缺失突变)(参考序列NM_005228.5),变异等位基因频率(VAF)为 22%,PIK3CA c.3140 A>G(p.His1047Arg)突变(参考序列NM_006218.3),VAF为 17%,CDK4扩增拷贝数 21(参考序列NM_000075.3)。由于检测到EGFR突变,未进行RNA检测。免疫组织化学染色(22C3)检测PD-L1表达 >50%。由于同时检出这些分子变异以及EGFR突变,格罗宁根大学医学中心分子肿瘤委员会(UMCG-MTB)讨论了该患者。在MTB审查患者之前,研究人员已开始以标准剂量(80 mg/天)奥希替尼进行一线治疗。MTB的建议是等待并观察患者对奥希替尼治疗的反应,在病情进展时以奥希替尼和哌柏西利进行联合治疗。
经过 2 个月的奥希替尼治疗后,根据RECIST v1.1标准,患者的CT成像显示部分缓解。然而,治疗 4 个月后,由于肺内转移瘤的大小和密度增加,疾病出现进展。原发性肿瘤和骨转移瘤保持不变,未观察到新病变。因此患者转诊并接受奥希替尼和哌柏西利治疗。转诊时,患者感到下背部疼痛,并扩散至左腿。根据CT成像,这些症状是由骨转移导致的椎体压缩性骨折引起的,研究人员予以保守治疗。患者没有出现任何肺部症状。
奥希替尼初始治疗开始五个月后,出于同情用药目的,患者接受了哌柏西利治疗,治疗周期为 3 周,随后停用 1 周。奥希替尼继续以标准剂量 80 mg/天每天服用。联合治疗方案开始两个月后,CT影像显示治疗反应为病情稳定。左上叶原发性肿瘤略有缩小,双肺肺内转移瘤与之前影像学检查相比有所缩小或无变化。骨转移瘤保持不变,未观察到新病变。药物相关毒性包括II级白细胞减少和中性粒细胞减少,以及I级血小板减少和皮疹。联合治疗开始四个月后,CT影像显示双肺肺部异常,包括毛玻璃影。患者没有出现呼吸困难或咳嗽等任何肺部症状。鉴别诊断包括肺炎、药物治疗导致或病毒感染导致,或疾病进展。在没有肺部症状的情况下,4 周后重复影像学检查,结果显示双肺不规则实变和结节的数量和大小增加,同时伴有进展性毛玻璃影。多学科会议中讨论了该患者,结论是除了肺炎之外,还有可能是疾病进展。患者被安排接受经胸活检,检查疑似进展的右肺下叶病变。
在活检样本中,观察到淋巴细胞性肺泡炎,淋巴细胞、组织细胞和嗜酸性粒细胞受累有限。由于活检中没有恶性细胞,也没有肺部症状,因此诊断为I级肺炎。继续使用奥希替尼和哌柏西利进行联合治疗,治疗方案和剂量保持不变。在接下来的 3 个月内,CT成像显示肺炎相关的气腔实变和毛玻璃影减少,靶病变进一步缩小,根据 RECIST v1.1标准评估为部分缓解。在治疗期间,患者的下背部和左腿疼痛有所缓解,身体功能改善。患者已经可以度假,参与包括滑雪等体力活动。
讨 论
控制肿瘤对奥希替尼的耐药是EGFR突变NSCLC患者治疗的主要挑战。CDK4或CDK6扩增此前被描述为对EGFR TKI(包括奥希替尼)原发性耐药的生物标志物。CDK4和CDK6通过促进细胞分裂在细胞周期途径中发挥不可或缺的作用。在正常情况下,这些激酶通过D-细胞周期蛋白的表达进行调节,包括细胞周期蛋白D1/2/3(CCND1/2/3),它们与CDK4/6结合形成活性细胞周期蛋白D-CDK4/6复合物。在包括肺癌在内的许多癌症类型中,可能发生一个或多个基因的分子变异,从而导致细胞增殖和癌变。特定的CDK4/6抑制剂,例如哌柏西利(palbociclib)和瑞波西利(ribociclib),已被批准与氟维司群或芳香化酶抑制剂联合用于治疗激素受体阳性的转移性乳腺癌。然而,在三项基于细胞周期基因特定分子变异筛选患者的CDK4/6抑制剂单药泛实体瘤试验中,仅观察到有限的临床活性,没有部分或完全缓解。
有一例病例报告描述了阿法替尼和哌柏西利联合治疗,该治疗适用于一名携带EGFR L861Q突变的晚期肺鳞状细胞癌患者,在使用厄洛替尼、阿法替尼、帕博利珠单抗和纳武利尤单抗系统性治疗后,检测到CDK4扩增而开始接受哌柏西利治疗。然而,在该病例报告中,诊断时并未进行CDK4扩增检测,而是在免疫治疗后进行了肿瘤再次活检,随后进行了化疗联合重组内皮抑素治疗。最后,没有说明停止厄洛替尼和阿法替尼治疗的原因,患者的随访仅有 2 个月。如先前文献中所述,一些携带罕见EGFR突变NSCLC患者在阿法替尼治疗期间病情进展,随后接受化疗,这些患者可能对再次使用阿法替尼有反应。因此,不确定病例报告中描述的反应是肿瘤对阿法替尼治疗的重新敏感,还是在治疗方案中添加了哌柏西利的原因。
据研究人员所知,这是首例关于接受奥希替尼和哌柏西利治疗的、同时携带EGFR 19del和CDK4扩增患者的报告。本文患者对奥希替尼一线单药治疗产生了短暂的部分缓解。在接受奥希替尼和哌柏西利联合治疗作为二线治疗后,在 10 个月的随访中持续产生部分缓解。在奥希替尼治疗中添加哌柏西利 4 个月后,患者出现了短暂的无症状性肺炎。无论是奥希替尼还是哌柏西利,间质性肺病或肺炎都被报告为潜在的毒性。接受EGFR TKI治疗的晚期NSCLC患者中肺炎的患病率为 1.1%。在接受哌柏西利治疗的晚期NSCLC患者中,肺炎的患病率尚不清楚。在接受CDK4/6抑制剂治疗的晚期乳腺癌患者中,间质性肺病或肺炎的患病率为 1.6%。奥希替尼和哌柏西利联合治疗可能会增加药物性肺炎的风险。
总之,基于本病例报告中描述的独特发现,奥希替尼和哌柏西利联合治疗可能是转移性EGFR突变伴有CDK4扩增NSCLC患者的有效治疗选择。鉴于本文患者对奥希替尼的初始反应短暂,可以考虑将奥希替尼和哌柏西利联合治疗作为一线治疗,而不是等待奥希替尼单药治疗出现疾病进展。此外,如果CDK4扩增作为获得性耐药机制发生,可以考虑奥希替尼和哌柏西利联合治疗。接受这种靶向治疗组合的患者应仔细评估潜在的药物性肺炎,这种肺炎的发生率可能比单独使用任何一种靶向治疗更高。
参考文献:
de Jager VD, Stigt JA, Niemantsverdriet M, Ter Elst A, van der Wekken AJ. Osimertinib and palbociclib in an EGFR-mutated NSCLC with primary CDK4 amplification after progression under osimertinib. NPJ Precis Oncol. 2024 May 22;8(1):113. doi: 10.1038/s41698-024-00607-9. PMID: 38778166; PMCID: PMC11111758.



