病例分享 | 混杂性神经鞘膜肿瘤(Hybrid nerve sheath tumors,HNSTs)1例
时间:2024-06-13 20:03:25 热度:37.1℃ 作者:网络
01 病史介绍
患者,女,55岁。主诉检查发现左下腿软组织占位2月余。患者2月前因双膝关节酸、疼痛,遂至当地医院检查发现一肿块,为明确肿块性质来我院就诊。
患者既往体健。
专科检查
查体四肢深浅感觉正常,各肌群肌力V级,肌张力正常。术中检查发现肿块毗邻神经,考虑神经源性肿瘤可能性大。
辅助检查
MRI检测发现左胫骨中上段后方软组织占位性病变,增强MRI示:左侧小腿中上段后内侧软组织肿块,考虑脉管神经源性肿瘤可能性大,建议结合临床及其他检查(图1)。
大体所见
(左侧小腿)手术切除肿瘤标本:大小8.0 cm×4.5 cm×3.0 cm,切面灰黄、灰白色,结节状,质软到质中,部分似有光泽,无明显包膜(图2)。
镜下形态
低倍镜下可见分界清楚的两种类型梭形细胞,一种细胞纤细,核稍细长,排列杂乱不规则,胞质稀疏、淡染,个别细胞核深染稍大(图3);另一种胖梭形细胞(施万细胞)呈栅栏状排列,细胞稀疏区交替分布,多结节状生长。高倍镜下两种梭形细胞异型性不显著,罕见核分裂像,未见坏死(图4)。
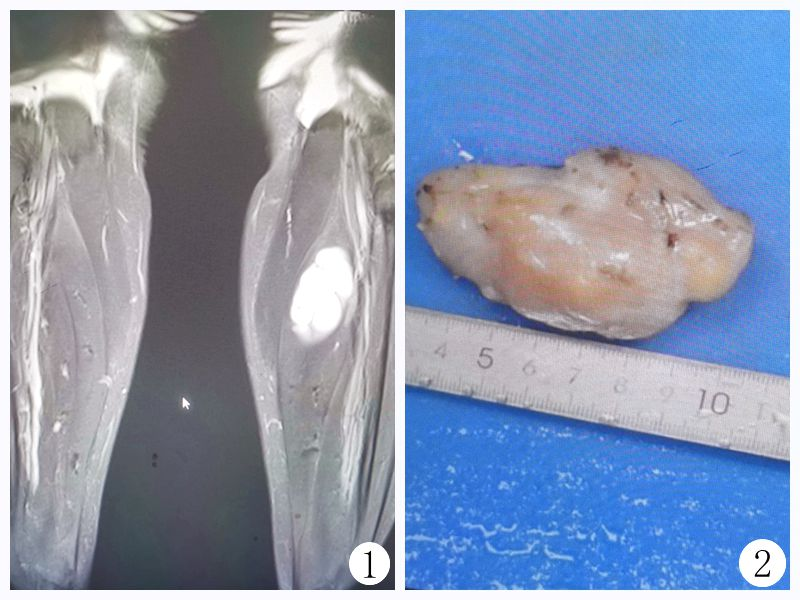
图1 HNSTs的影像学表现:左侧小腿中上段后内侧类圆形占位性软组织肿块;
图2 手术切除大体形态:大小8.0 cm×4.5 cm×3.0 cm,切面灰黄、灰白色,结节状,质软到质中,无明显包膜。
免疫组化结果
Vim、S-100、SOX-10和H3K27me3均(+),纤细梭形细胞表达CD34,EMA(灶+),Ki-67(+1%),CK、SMA、Desmin、CD117、Caldesmon均(-)。
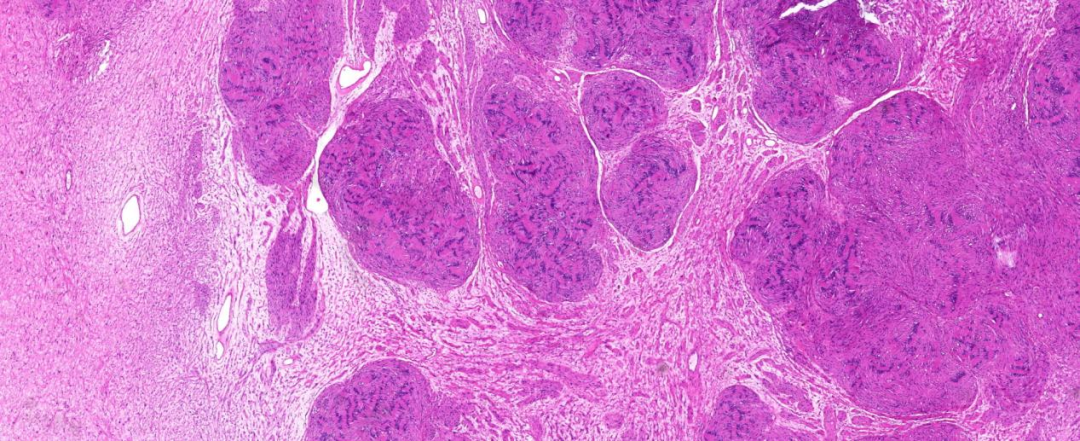
图3 低倍镜可见分界清楚的两种梭形肿瘤细胞构成,胖梭形细胞结节状生长,周围为纤细长梭形细胞 HE低倍放大;
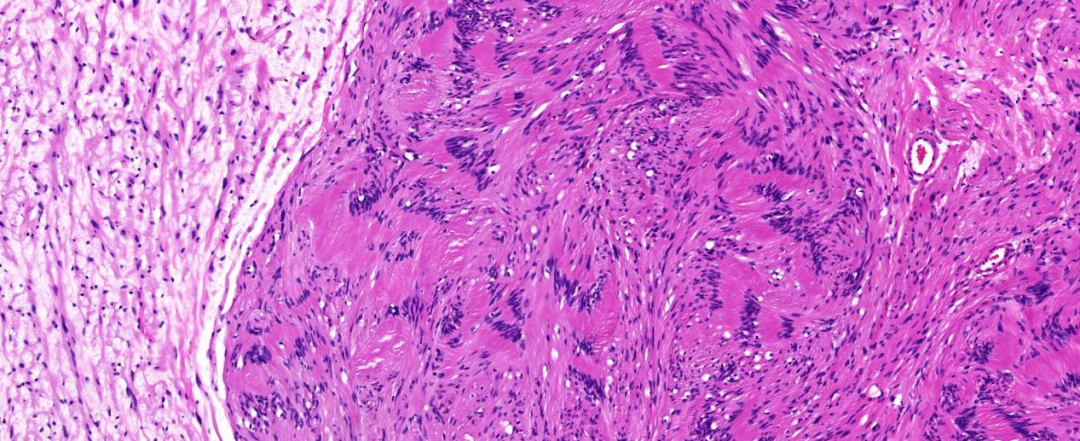
图4 高倍镜:栅栏状排列的胖梭形细胞及周围纤维细胞,异型性不明显 HE中倍放大;
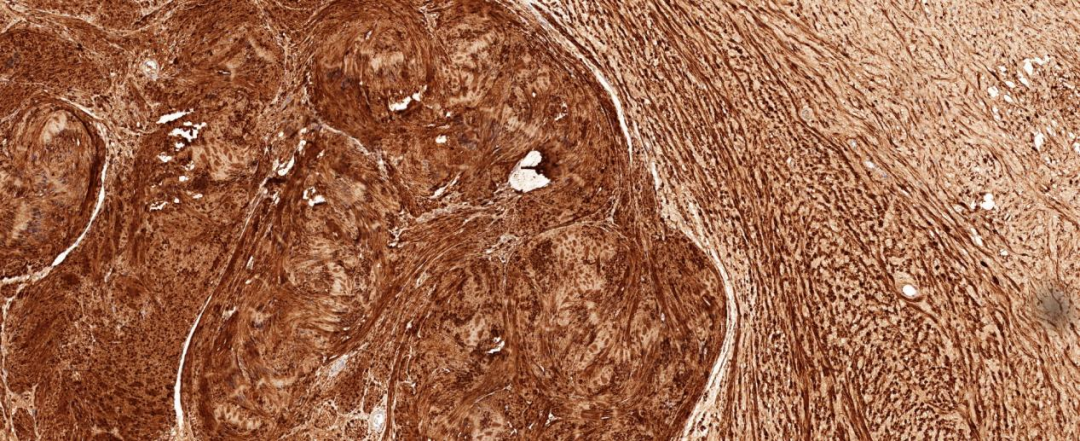
图5 肿瘤细胞S-100弥漫表达;EnVision法 中倍放大;
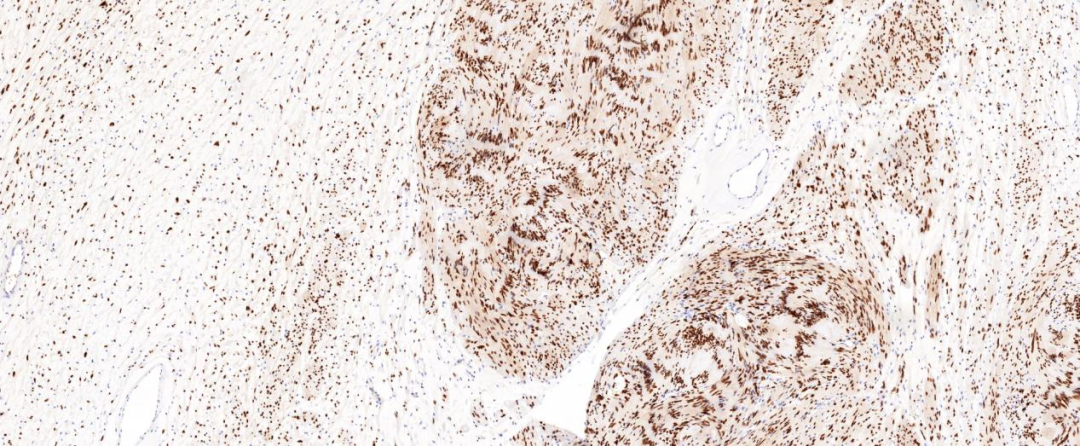
图6 肿瘤细胞SOX-10弥漫表达;EnVision法 中倍放大;
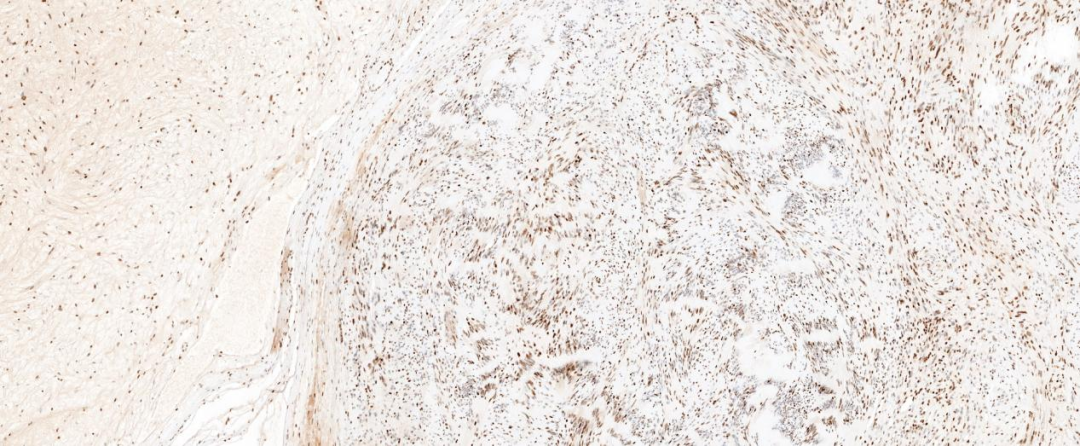
图7 肿瘤细胞H3K27me3弥漫表达示无缺失;EnVision法 中倍放大;
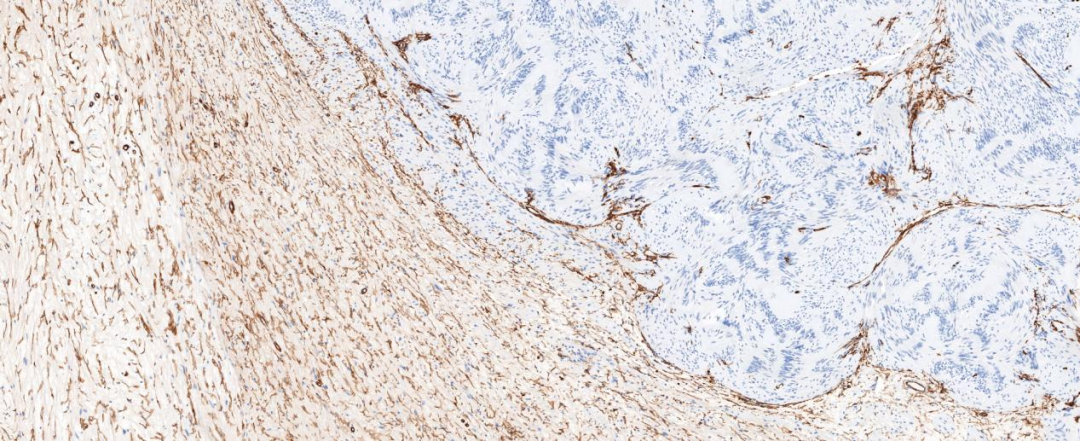
图8 神经纤维瘤成份表达CD34,神经鞘瘤成份不表达;
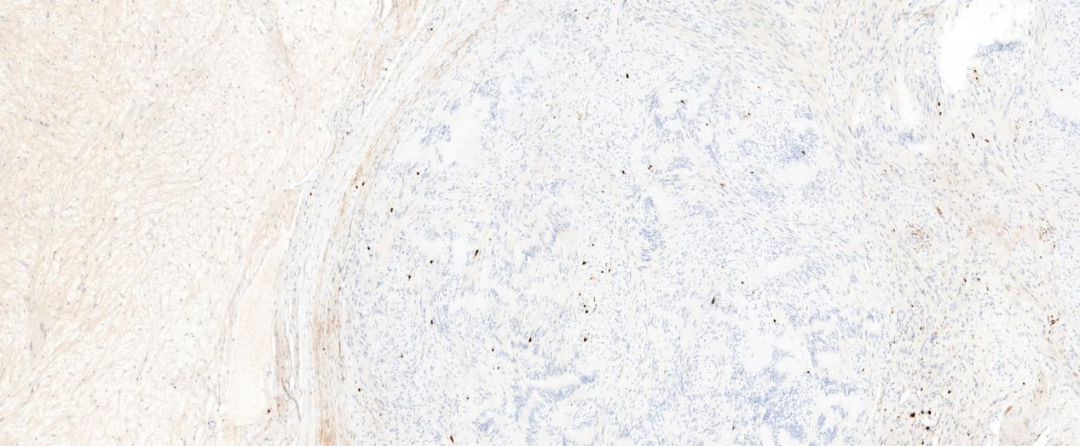
图9 Ki-67增殖指数低表达
病理诊断
(左侧小腿)混杂性神经鞘膜肿瘤(Hybrid nerve sheath tumors,HNSTs)。
02 讨 论
临床特征
混杂性神经鞘膜肿瘤是临床较少见的良性外周神经鞘膜肿瘤中常见类型,肿物生长缓慢,常常为无痛性肿块,部分病例可有微痛感。发病年龄分布较为广泛,从2岁到85岁均可发生,但大多数患者年龄范围为20岁到50岁,平均年龄约为38岁。性别上无明显差异,部位上以四肢和躯干皮肤多见,多发生于浅表软组织,个别病例发生于锁骨上、深部或实质脏器。
影像学特征
该病例影像学大多显示为孤立、界限较清晰的软组织内肿块,增强后呈高信号影、结节分叶状,动态增强MRI呈线样结节状强化,延迟期强化范围逐渐增大,最大截面可达7cm×4cm。
病理特征
1. 大体特点:
该肿瘤切面灰黄、灰白色,结节状,质软到质中,部分似有光泽,大多数肿瘤边界清楚,无明显包膜。
2.镜下表现:
文献报道HNSTs有两种混杂模式:一是分界清楚的组织学易于分别的双相型肿瘤,如神经鞘瘤/神经纤维瘤;另一种是分界模糊的、组织学混着一起的单相型肿瘤。低倍镜下粗略浏览,混杂性神经鞘瘤/神经纤维瘤形态由两种组织学成份构成,在经典的纤细梭形细胞(神经纤维瘤结节)背景内可见散在结节状胖梭形细胞区域即神经鞘瘤样结节,部分区可呈丛状。高倍镜下纤细梭形细胞核较细长,胖梭形细胞核大而饱满,核呈波浪状,胞界不清。两种梭形细胞异型性不明显,罕见核分裂或无核分裂(0-2个/50个HPF),也无坏死区域,这两种成份之间分界较清楚,肿瘤无明显包膜。个别病例两种组织学成份也可相互混杂,可见散在分布的奇异大细胞或肥大细胞,周边可见小的神经束或轴突,核染色质浓染,有时可见核内假包涵体。
3.免疫表型:
免疫组化染色肿瘤两种组织学成份均弥漫表达S-100和SOX-10蛋白,H3K27me3蛋白阳性显示均无缺失改变。神经纤维瘤成份还表达CD34、EMA、GLUT1和claudin-1,其中EMA蛋白较弱表达或局灶表达。神经鞘瘤成份CD34阴性,Ki-67增殖指数较低。本病例CD34表达于神经纤维瘤成份,而神经鞘瘤成份不表达。
分子遗传学
最新研究显示,HNSTs中发现有转录辅助因子退变样蛋白3(VGLL3)的融合改变。VGLL3伴侣基因包括染色质域解旋酶DNA结合蛋白家族7(CHD7)、CHD9和X染色体开放读码框架6(MAMLD1),也发现包括DST-BRAF和死骨片1基因(SQSTM1)-CDX1完全不同的融合,提示HNSTs可能与传统的神经鞘瘤或神经束膜瘤不相关,代表一个完全不同的肿瘤实体。此外,在混杂性神经鞘瘤/神经纤维瘤中鉴定出可靶向的酪氨酸激酶受体2(ERBB2)基因突变。文献数据显示44%肿瘤病例中存在22号染色体的缺失,α-T-catenin/ CTNNA3(10q21.3)基因参与肿瘤的发生。因此,临床上需要收集更多病例来研究VGLL3等基因改变。
治疗与预后
该肿瘤为良性肿瘤,常单纯手术完整切除获得治愈,极少数切缘阳性病例有局部复发的潜能。
鉴别诊断
1.低级别恶性周围神经鞘膜瘤(MPNST) 与HNSTs细胞成份相似,但是MPNST血管丰富,为后壁血管,部分区域可见到异源性成份如横纹肌母细胞、骨等。MPNST通常有良性神经肿瘤发展而来,多发生在深部软组织。二者都可表达神经标记S-100和SOX-10,但MPNST中免疫组化S-100表达率随着分化程度不同而变化,EMA、claudin-1均阴性表达,但常常H3K27me3缺失表达,Ki-67增殖指数常常>5%。
2.软组织神经束膜瘤 形态上与HNSTs相似,但神经束膜瘤完全由形态单一的神经束膜细胞构成,通常不含施万细胞区域,免疫组化EMA、claudin-1阳性表达,S-100阴性。
3.神经鞘瘤 经典型的神经鞘瘤由排列有序、交替分布的富于细胞的束状区(A区)和疏松黏液网状区(B区)构成,A区细胞密度高呈栅栏状排列,罕见核分裂像,B区可见微囊及大而不规则的血管。有Verocay小体及完整的包膜,免疫标记显示施万细胞分化。而HNSTs是两种分界清楚的组织学构成,无包膜,这一点与神经鞘瘤相鉴别。
4. 纤维组织细胞瘤 混杂性神经鞘瘤/神经纤维瘤形态上易于误诊为纤维组织细胞瘤,后者发生部位多位于真皮内,细胞成份多种多样,除成纤维细胞外还常常可见泡沫样组织细胞、含铁血黄素的巨噬细胞等细胞成份,免疫组化肿瘤细胞组织细胞样标记CD68和CD163阳性表达,而S-100、EMA和CD34均阴性,借此可以鉴别二者。
5. 孤立性纤维性肿瘤(SFT)发生于颅内部位的混杂性神经鞘瘤/神经纤维瘤易于SFT相混淆。SFT好发于胸膜和实质器官,经典型SFT由交替分布的细胞丰富区和稀疏区构成,瘤细胞多无结构或无模式生长,另见粗细不等形状不一的瘢痕疙瘩样的胶原纤维。免疫组化除CD34阳性外,BCL-2,CD99和STAT6阳性,而S-100、SOX-10皆为阴性,通过组织学形态及免疫组化标记可以鉴别二者。
*本文(包括图片)均为作者投稿, 仅供行业交流学习用,不作为医疗诊断依据。
参考文献
[1]蒋雪兵, 张磊, 孙蒙,等. 混杂性神经鞘瘤/神经束膜瘤35例临床病理学分析[J]. 中华病理学杂志, 2019, 48(9):688-693.
[2]Stemmer-Rachamunov AC, Reuss DE. Hybrid Nerve sheath tumour in WHO Classification of Tumours Editorial Board. CNS Tumours, 5th ed. Lyon (France): International Agency for Research on Cancer; 2022:271–272.
[3]Hornick JL, Bundock EA, Fletcher CD. Hybrid schwannoma/perineurioma: clinicopathologic analysis of 42 distinctive benign nerve sheath tumors[J]. Am J Surg Pathol,2009,33(10):1554-61.
[4]冯琨, 韩群, 姜慧峰,等. 混合型神经鞘肿瘤2例并文献复习[J]. 临床与实验病理学杂志, 2017, 33(10):1147-1149.
[5]Alomair A , Dababo M , Velagapudi S . Supraclavicular Solitary Hybrid Schwannoma/ Neurofibroma: A Case Report[J]. Cureus, 2020, 12(6):e8531.
[6]Choi JH, Ro JY. The 2020 WHO Classification of Tumors of Soft Tissue: Selected Changes and New Entities, Adv Anat Pathol, 2021,28(1):44-58.
[7]Montgomery B K , Alimchandani M , Mehta G U , et al. Tumors displaying hybrid schwannoma and neurofibroma features in patients with neurofibromatosis type 2[J]. Clinical Neuropathology, 2016,35(2):78-83.
[8] Harder A , Wesemann M , Hagel C , et al. Hybrid neurofibroma/schwannoma is overrepresented among schwannomatosis and neurofibromatosis patients.[J]. American Journal of Surgical Pathology, 2012, 36(5):702-709.
[9]Nihous H, Baud J, Azmani R, et al. Clinicopathologic and Molecular Study of Hybrid Nerve Sheath Tumors Reveals Their Common Association With Fusions Involving VGLL3[J]. Am J Surg Pathol. 2022;46(5):591-602.
[10]Dickson BC, Antonescu CR, Demicco EG, et al. Hybrid schwannoma-perineurioma frequently harbors VGLL3 rearrangement[J]. Mod Pathol. 2021;34(6):1116-1124.
[11]Michael W,Ronellenfitsch,Patrick N,et al.Targetable ERBB2 mutations identified in neurofibroma/schwannoma hybrid nerve sheath tumors.[J].The Journal of clinical investigation,2020,130(5):2488-2495.
[12]Stahn V, Nagel I, Fischer-Huchzermeyer S, et al. Molecular Analysis of Hybrid Neurofibroma/Schwannoma Identifies Common Monosomy 22 and α-T-Catenin/CTNNA3 as a Novel Candidate Tumor Suppressor[J]. Am J Pathol. 2016,186(12):3285-3296.

