CMI:苏州大学时玉舫/邵常顺发现颅内恶性肿瘤更有效免疫治疗的靶点!
时间:2024-07-27 15:05:10 热度:37.1℃ 作者:网络
脑肿瘤如胶质母细胞瘤对免疫检查点阻断治疗有抵抗性,主要是由于肿瘤中有限的T细胞浸润。
2024年7月24日, 苏州大学时玉舫、邵常顺共同通讯在Cellular & Molecular Immunology在线发表题为“Targeting the glucocorticoid receptor-CCR8 axis mediated bone marrow T cell sequestration enhances infiltration of anti-tumor T cells in intracranial cancers”的研究论文,该研究表明靶向糖皮质激素受体- CCR8轴介导的骨髓T细胞隔离增强了颅内肿瘤中抗肿瘤T细胞的浸润。
研究人员发现携带颅内肿瘤的小鼠表现出全身免疫抑制和骨髓中的T细胞隔离,导致脑肿瘤中T细胞浸润减少。在荷瘤小鼠中,血浆皮质酮升高通过糖皮质激素受体驱动T细胞隔离。糖皮质激素诱导的T细胞动力学介导的免疫抑制和随后的肿瘤生长促进可以通过肾上腺切除术、糖皮质激素激活抑制剂或糖皮质激素受体拮抗剂以及T细胞特异性缺失糖皮质激素受体的小鼠来消除。CCR8在荷瘤小鼠T细胞中的表达以糖皮质激素受体依赖的方式增加。此外,趋化因子CCL1和CCL8 (CCR8的配体)在荷瘤小鼠的骨髓免疫细胞中高度表达以募集T细胞。这些发现表明,脑肿瘤诱导的糖皮质激素激增和T细胞中CCR8的上调导致T细胞在骨髓中隔离,损害抗肿瘤免疫反应。靶向糖皮质激素受体-CCR8轴可能为颅内肿瘤的治疗提供一种有前景的免疫治疗方法。

脑肿瘤包括多种起源于脑部的恶性肿瘤,如胶质母细胞瘤(GBM)(约占成人原发性脑恶性肿瘤的50%)或来自其他原发部位的脑转移(BrM)(约占脑肿瘤的90%)。BrM通常起源于黑色素瘤、肺癌或乳腺肿瘤。GBM被认为是最致命的脑癌之一,复发率超过90%。平均而言,被诊断为GBM的患者的生存时间不到15个月,即使采用常规治疗方法,如手术切除后再使用替莫唑胺(TMZ)进行放疗和化疗。此外,GBM经常导致全身T细胞数量和功能的减少,使其对免疫检查点阻断治疗的反应降低。相反,大量的T细胞被发现被隔离在脑肿瘤患者的骨髓(BM)中,并伴有肿瘤诱导的T细胞表面鞘鞘肽1磷酸受体1 (S1P1)的丢失。
GBM和脑转移患者常并发瘤周血管源性水肿,这是神经肿瘤高发病率和死亡率的重要原因。迄今为止,合成皮质类固醇地塞米松(dexamethasone, DEX)是治疗神经外科和神经肿瘤病例水肿的首选药物。尽管在临床上治疗血管源性水肿是有效的,但有充分证据表明,DEX的使用与一系列全身副作用有关,包括与放疗和TMZ治疗同时使用时生存率降低。
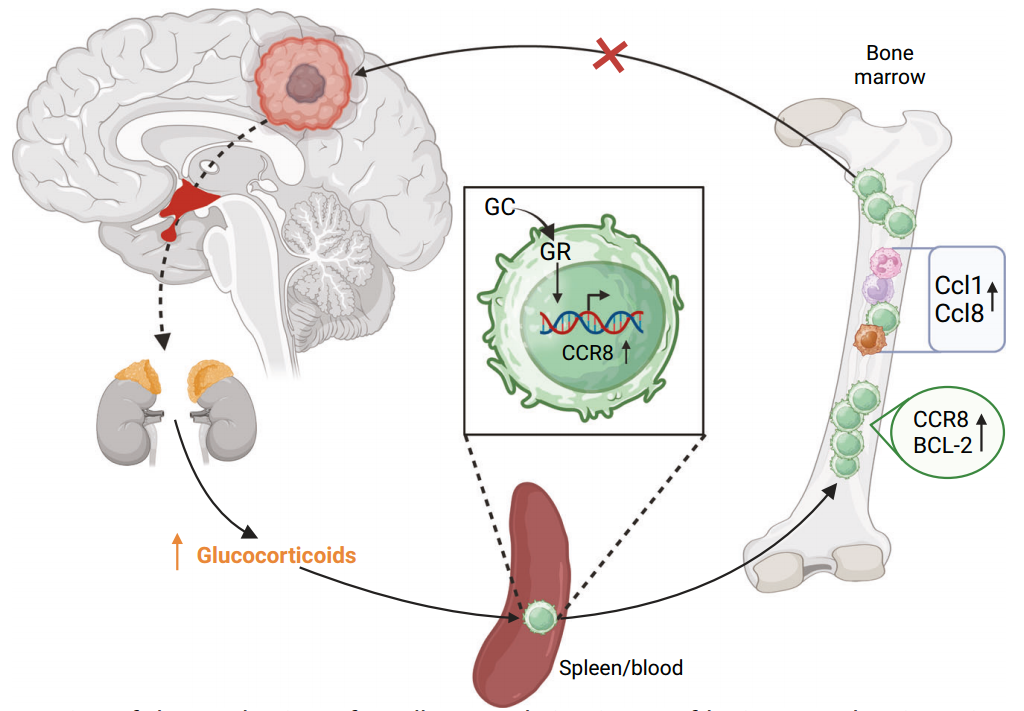
T细胞在荷瘤小鼠脑脊液中积累的机制示意图(图源自Cellular & Molecular Immunology)
此外,患者可能自然产生糖皮质激素水平升高,可能导致免疫治疗失败。肿瘤微环境中高水平的糖皮质激素会导致肿瘤浸润淋巴细胞(TIL)功能障碍,并促进表型耗竭。同样,在饮食限制小鼠模型中,血清糖皮质激素水平升高诱导BM中效应记忆T细胞的积累。然而,糖皮质激素是否介导颅内肿瘤患者BM中T细胞的积累仍有待确定。
在这项研究中,研究人员发现脑肿瘤引起的糖皮质激素增加导致T细胞上CCR8的表达增强,这反过来导致这些细胞在BM中被隔离,损害对脑肿瘤的免疫防御。这些新发现提示,糖皮质激素受体(GR)-CCR8轴可能是治疗颅内恶性肿瘤时实现更有效免疫治疗的靶点。
参考信息:
https://www.nature.com/articles/s41588-024-01852-1#Sec10


